Список биофизически важных макромолекулярных кристаллических структур

Кристаллические структуры молекул белков и нуклеиновых кислот и их комплексов занимают центральное место в практике большинства разделов биофизики и сформировали многое из того, что мы понимаем с научной точки зрения на уровне атомных деталей биологии. Их важность подчеркивается объявлением Организацией Объединенных Наций 2014 года Международным годом кристаллографии , поскольку отмечается 100-летие вручения Максу фон Лауэ 1914 года Нобелевской премии за открытие дифракции рентгеновских лучей на кристаллах. Этот хронологический список биофизически значимых структур белков и нуклеиновых кислот во многом основан на обзоре, опубликованном в Biophysical Journal . [1] В список вошли все первые дюжины отдельных структур: те, которые открыли новые горизонты в предметах или методах, а также те, которые стали модельными системами для работы в будущих биофизических областях исследований.
Миоглобин
[ редактировать ]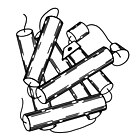

1958 г. – Миоглобин стал самой первой кристаллической структурой белковой молекулы. [2] Миоглобин содержит железосодержащую гемовую группу, которая обратимо связывает кислород для питания мышечных волокон, и эти первые кристаллы были миоглобином кашалота , мышцы которого нуждаются в большом запасе кислорода для глубоких погружений. Трехмерная структура миоглобина состоит из 8 альфа-спиралей , и кристаллическая структура показала, что их конформация была правосторонней и очень близко соответствовала геометрии, предложенной Лайнусом Полингом , с 3,6 остатками на виток и основными водородными связями пептида. NH одного остатка к пептиду CO остатка i+4. Миоглобин является модельной системой для многих видов биофизических исследований. [3] особенно с участием процесса связывания небольших лигандов, таких как кислород и окись углерода .
Гемоглобин
[ редактировать ]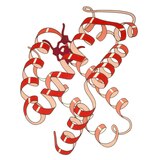

1960 – гемоглобина. Кристаллическая структура [4] показал тетрамер двух родственных типов цепей и был решен с гораздо меньшим разрешением, чем мономерный миоглобин, но он явно имел ту же основную 8-спиральную архитектуру (теперь называемую «складкой глобина»). Дальнейшие кристаллические структуры гемоглобина с более высоким разрешением (PDB 1MHB, 1DHB) вскоре показали связанное изменение как локальной, так и четвертичной конформации между окси- и дезокси-состояниями гемоглобина. [5] что объясняет кооперативность связывания кислорода в крови и аллостерический эффект таких факторов, как pH и DPG . На протяжении десятилетий гемоглобин был основным учебным примером концепции аллостерии, а также предметом интенсивного исследования и обсуждения аллостерии. В 1909 году кристаллы гемоглобина более чем 100 видов были использованы для связи таксономии с молекулярными свойствами. [6] Эту книгу процитировал Перуц в отчете 1938 года. [7] кристаллов лошадиного гемоглобина, с которого началась его долгая сага по разгадке кристаллической структуры. Кристаллы гемоглобина плеохроичны — темно-красные в двух направлениях и бледно-красные в третьем. [6] — из-за ориентации гемов, а яркая полоса Соре групп гема порфириновых используется в спектроскопическом анализе связывания лигандов гемоглобина.

Лизоцим куриного яйца и белка
[ редактировать ]куриного яичного белка 1965 – Лизоцим (PDB-файл 1lyz). [8] была первой кристаллической структурой фермента (она расщепляет небольшие углеводы на простые сахара), использованной для ранних исследований механизма фермента. [9] Он содержал бета-лист (антипараллельный), а также спирали, а также был первой макромолекулярной структурой, координаты атомов которой были уточнены (в реальном пространстве). [10] Исходный материал для приготовления можно купить в продуктовом магазине, а лизоцим куриного яйца очень легко кристаллизуется во многих различных пространственных группах ; это излюбленный пример для новых кристаллографических экспериментов и инструментов. Недавними примерами являются нанокристаллы лизоцима для сбора данных с помощью лазера на свободных электронах. [11] и микрокристаллы для микроэлектронной дифракции. [12]

Рибонуклеаза
[ редактировать ]1967 - Рибонуклеаза А (файл PDB 2RSA) [13] представляет собой фермент, расщепляющий РНК, стабилизированный четырьмя дисульфидными связями. Он использовался в плодотворных исследованиях Анфинсена по сворачиванию белков, которые привели к концепции, согласно которой трехмерная структура белка определяется его аминокислотной последовательностью. Рибонуклеаза S , расщепленная двухкомпонентная форма, изученная Фредом Ричардсом , также была ферментативно активной, имела почти идентичную кристаллическую структуру (файл PDB 1RNS), [14] и было показано, что он каталитически активен даже в кристалле, [15] помогая развеять сомнения относительно значимости кристаллических структур белков для биологических функций.

Сериновые протеазы
[ редактировать ]1967 - Сериновые протеазы представляют собой исторически очень важную группу ферментных структур, поскольку вместе они проливают свет на каталитический механизм (в их случае с помощью «каталитической триады» Ser-His-Asp), основу различной субстратной специфичности и механизм активации. при котором контролируемое ферментативное расщепление закапывает новый конец цепи, чтобы правильно перестроить активный сайт. [16] Ранние кристаллические структуры включали химотрипсин (файл PDB 2CHA), [17] химотрипсиноген (файл PDB 1CHG), [18] трипсин (файл PDB 1PTN), [19] и эластаза (файл PDB 1EST). [20] Они также были первыми белковыми структурами, которые имели два почти идентичных домена, предположительно связанных дупликацией генов . Одной из причин их широкого использования в качестве примеров в учебниках и классах была система нумерации кодов вставки, которая сделала Ser195 и His57 согласованными и запоминающимися, несмотря на различия в последовательностях, специфичных для белков. [ нужна ссылка ]
Папаин
[ редактировать ]1968 – Папаин

Карбоксипептидаза
[ редактировать ]1969 — Карбоксипептидаза А цинка — металлопротеаза . Его кристаллическая структура (файл PDB 1CPA) [21] продемонстрировали первую параллельную бета-структуру: большой скрученный центральный лист из 8 нитей с активным центром Zn, расположенным на С-концевом конце средних нитей, и лист, окруженный с обеих сторон альфа-спиралями. Это экзопептидаза , которая расщепляет пептиды или белки с карбокси-конца, а не внутри последовательности. Позже был обнаружен небольшой белковый ингибитор карбоксипептидазы (файл PDB 4CPA). [22] который механически останавливает катализ, представляя его С-концевой конец просто торчащим из кольца дисульфидных связей с плотной структурой позади него, не позволяя ферменту всасывать цепь мимо первого остатка.

Самый тонкий
[ редактировать ]1969 – Субтилизин (PDB файл 1sbt [23] ) представляла собой второй тип сериновой протеазы с активным центром, почти идентичным ферментам семейства трипсина, но с совершенно другой общей кратностью. Это дало первое представление о конвергентной эволюции на атомном уровне. Позже интенсивное мутационное исследование субтилизина задокументировало влияние всех 19 других аминокислот в каждом отдельном положении. [24]
Лактатдегидрогеназа
[ редактировать ]1970 – Лактатдегидрогеназа

Ингибитор трипсина
[ редактировать ]1970 – Основной ингибитор трипсина поджелудочной железы , или BPTI (файл PDB 2pti [25] ), представляет собой небольшой, очень стабильный белок, который стал высокопродуктивной модельной системой для изучения сверхплотного связывания, образования дисульфидных связей (SS), сворачивания белка , молекулярной стабильности за счет аминокислотных мутаций или обмена водород-дейтерий, а также быстрого локальная динамика методом ЯМР . Биологически BPTI связывает и ингибирует трипсин , пока он хранится в поджелудочной железе , позволяя активировать переваривание белка только после того, как трипсин высвобождается в желудок.
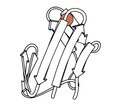
Рубредоксин
[ редактировать ]1970 - Рубредоксин (файл PDB 2rxn [26] ) была первой раскрытой окислительно-восстановительной структурой: минималистичный белок, в котором железо связано 4 боковыми цепями Cys из 2 петель на вершине β-шпильок. Он дифрагировал до 1,2 Å, что позволило впервые уточнить белок в обратном пространстве (4,5rxn [27] ). (Примечание: обратите внимание, что 4rxn был выполнен без ограничений геометрии.) Архейные рубредоксины составляют многие из небольших структур с самым высоким разрешением в PDB.


Инсулин
[ редактировать ]1971 – Инсулин (PDB-файл 1INS) [28] Это гормон, играющий центральную роль в метаболизме сахара и накоплении жира и играющий важную роль при таких заболеваниях человека, как ожирение и диабет . Биофизически он примечателен своим связыванием Zn, равновесием между состояниями мономера, димера и гексамера, способностью образовывать кристаллы in vivo и синтезом в виде более длинной «про» формы, которая затем расщепляется с образованием активной 2-формы. цепь, SS-связанный мономер. Инсулин стал успешным результатом программы НАСА по выращиванию кристаллов на космическом корабле «Шаттл» , производившей массовые препараты очень однородных крошечных кристаллов для контролируемой дозировки.
Стафилококковая нуклеаза
[ редактировать ]1971 – Стафилококковая нуклеаза .
Цитохром С
[ редактировать ]1971 – Цитохром С
Лизоцим фага Т4
[ редактировать ]1974 – лизоцим фага Т4.
Иммуноглобулины
[ редактировать ]1974 – Иммуноглобулины.
Супероксиддисмутаза
[ редактировать ]1975 – Супероксиддисмутаза Cu,Zn.
Транспортная РНК
[ редактировать ]1976 – Транспортная РНК

Триозофосфатизомераза
[ редактировать ]1976 – Триозофосфатизомераза.
Пепсиноподобные аспарагиновые протеазы
[ редактировать ]- 1976 – Ризопуспепсин.
- 1976 – Эндотиапепсин
- 1976 – Пенициллопепсин
Более поздние структуры (с 1978 г.)
[ редактировать ]- 1978 – Икосаэдрический вирус
- B-формы Дикерсона. ДНК 1981 - Додекамера
- 1981 – Крамбин
- 1985 – Кальмодулин
- 1985 – ДНК-полимераза.

- 1985 – Фотосинтетический реакционный центр : пары бактериохлорофиллов (зеленые) внутри мембраны захватывают энергию солнечного света, затем проходят множество этапов, чтобы стать доступными для гемовых групп (красные) в модуле цитохрома-С вверху. Это была первая раскрытая кристаллическая структура мембранного белка, что стало важной вехой, отмеченной Нобелевской премией Хартмута Мишеля, Ганса Дайзенхофера и Роберта Хубера.
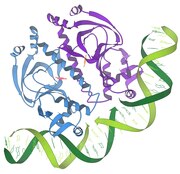
- 1986 – Взаимодействие репрессора и ДНК
- 1987 – Главный комплекс гистосовместимости .
- 1987 – Убикитин
- 1987 – РОП-белок
- 1989 – протеаза ВИЧ-1.
- 1990 – Бактериородопсин.
- 1991 – спиральная катушка GCN4.
- 1991 – обратная транскриптаза ВИЧ-1.
- 1993 – Бета-спираль Пектатлиазы.
- 1994 – Коллаген
- 1994 – Барнасе /комплекс «Барстар»
- 1994 – АТФаза F1
- 1995 – Гетеротримерные G-белки.
- 1996 – Зеленый флуоресцентный белок
- 1996 – ЦДК / циклиновый комплекс.

- 1996 – кинезин. Моторный белок
- 1997 – сопровождающий GroEL /ES
- 1997 – «Нуклеосома»
- 1998 - Самосплайсинговый интрон группы I.

- 1998 г. – ДНК-топоизомеразы выполняют биологически важную и необходимую работу по распутыванию нитей или спиралей ДНК, которые переплетаются друг с другом или слишком сильно скручиваются во время нормальных клеточных процессов, таких как транскрипция генетической информации.
- 1998 – тубулина . Альфа/бета-димер
- 1998 – Калийный канал
- 1998 – Холлидей-Джанкшн
- 2000 г. - Рибосомы являются центральной частью биологии и биофизики, структурно они впервые стали доступны в 2000 г.

- 2000 – ААА+ АТФаза
- 2002 – Анкирин повторяет
- 2003 г. – ТОП7 белковых дизайнов.
- 2004 – циркадных часов цианобактерий. Белки
- 2004 – «Рибопереключатель»
- 2006 – Экзосома человека


- 2009 – Частица свода – это новое интригующее открытие большой полой частицы, распространенной в клетках, с несколькими различными предположениями относительно ее возможной биологической функции. Кристаллические структуры (файлы PDB 2zuo, 2zv4, 2zv5 [29] и 4хл8 [30] ) показывают, что каждая половина хранилища состоит из 39 копий длинного 12-доменного белка, которые закручиваются вместе, образуя оболочку. Беспорядок в самом верхнем и нижнем торцах предполагает наличие отверстий для возможного доступа во внутреннюю часть хранилища.

Ссылки
[ редактировать ]- ^ Ричардсон Дж. С., Ричардсон, округ Колумбия (2014). «Биофизические моменты за 54 года макромолекулярной кристаллографии» . Биофизический журнал . 106 (3): 510–525. Бибкод : 2014BpJ...106..510R . дои : 10.1016/j.bpj.2014.01.001 . ПМЦ 3945011 . ПМИД 24507592 .
- ^ Кендрю Дж.К., Бодо Дж., Динцис Х.М., Пэрриш Р.Г., Вайкофф Х., Филлипс, округ Колумбия (1958). «Трехмерная модель молекулы миоглобина, полученная методом рентгеновского анализа». Природа . 181 (4610): 662–666. Бибкод : 1958Natur.181..662K . дои : 10.1038/181662a0 . ПМИД 13517261 .
- ^ Фрауэнфельдер Х., МакМахон Б.Х., Фенимор П.В. (2003). «Миоглобин: атом водорода в биологии и парадигма сложности» . Труды Национальной академии наук США . 100 (15): 8615–8617. Бибкод : 2003PNAS..100.8615F . дои : 10.1073/pnas.1633688100 . ПМК 166357 . ПМИД 12861080 .
- ^ Перуц М.Ф., Россманн М.Г., Каллис А.Ф., Мюрхед Х., Норт AC (1960). «Структура гемоглобина: трехмерный синтез Фурье с разрешением 5,5 Å, полученный с помощью рентгеновского анализа». Природа . 185 (4711): 416–422. Бибкод : 1960Natur.185..416P . дои : 10.1038/185416a0 . ПМИД 18990801 . S2CID 4208282 .
- ^ Перуц М.Ф. (1970). «Стереохимия кооперативных эффектов в гемоглобине: взаимодействие гема-гема и проблема аллостерии». Природа . 228 (5273): 726–734. Бибкод : 1970Natur.228..726P . дои : 10.1038/228726a0 . ПМИД 5528785 . S2CID 43624891 .
- ^ Jump up to: а б Эдвард Тайсон Райхерт и Амос Писли Браун (1909). Дифференциация и специфичность соответствующих белков и других жизненно важных веществ в отношении биологической классификации и органической эволюции: кристаллография гемоглобинов . Вашингтон, округ Колумбия: Институт Карнеги.
- ^ Бернал Дж.Д., Фанкюхен И., Перуц М. (1938). «Рентгенологическое исследование химотрипсина и гемоглобина». Природа . 141 (3568): 523–524. Бибкод : 1938Natur.141..523B . дои : 10.1038/141523a0 . S2CID 4063748 .
- ^ Блейк CC, Кениг Д.Ф., Майр Г.А., Норт AC, Филлипс, округ Колумбия, Сарма В.Р. (1965). «Структура лизоцима куриного яичного белка: трехмерный синтез Фурье с разрешением 2 Å». Природа . 206 (4986): 757–761. Бибкод : 1965Natur.206..757B . дои : 10.1038/206757a0 . ПМИД 5891407 . S2CID 4161467 .
- ^ Варшел А., Левитт М. (1976). «Теоретические исследования ферментативных реакций: Диэлектрическая, электростатическая и стерическая стабилизация иона карбония в реакции лизоцима». Дж Мол Биол . 103 (2): 227–49. дои : 10.1016/0022-2836(76)90311-9 . ПМИД 985660 .
- ^ Даймонд Р. (1974). «Реальное уточнение структуры лизоцима куриного белка». Журнал молекулярной биологии . 82 (3): 371–374. дои : 10.1016/0022-2836(74)90598-1 . ПМИД 4856347 .
- ^ Буте С., Ломб Л., Уильямс Г.Дж. и др. (2012). «Определение структуры белка с высоким разрешением с помощью серийной фемтосекундной кристаллографии» (PDF) . Наука . 337 (6092): 362–364. Бибкод : 2012Sci...337..362B . дои : 10.1126/science.1217737 . ПМЦ 3788707 . ПМИД 22653729 .
- ^ Ши Д., Нанненга Б.Л., Яденца М.Г., Гонен Т. (2013). «Трехмерная электронная кристаллография белковых микрокристаллов» . электронная жизнь . 2 : e01345. дои : 10.7554/elife.01345 . ПМК 3831942 . ПМИД 24252878 .
- ^ Карта Дж., Белло Дж., Харкер Д. (1967). «Третичная структура рибонуклеазы». Природа . 213 (5079): 862–865. Бибкод : 1967Natur.213..862K . дои : 10.1038/213862a0 . ПМИД 6043657 . S2CID 4183721 .
- ^ Вайкофф Х.В., Хардман К.Д., Аллевелл Н.М., Инагами Т., Джонсон Л.Н., Ричардс Ф.М. (1967). «Структура рибонуклеазы-S с разрешением 3,5 Å» . Журнал биологической химии . 242 (17): 3984–3988. дои : 10.1016/S0021-9258(18)95844-8 . ПМИД 6037556 .
- ^ Дошер М.С., Ричардс Ф.М. (1963). «Активность фермента в кристаллическом состоянии: Рибонуклеаза-С» . Журнал биологической химии . 238 (7): 2399–2406. дои : 10.1016/S0021-9258(19)67984-6 .
- ^ Дикерсон Р.Э., Гейс I (1969). Структура и действие белков . Нью-Йорк: Харпер.
- ^ Мэтьюз Б.В., Сиглер П.Б., Хендерсон Р., Блоу Д.М. (1967). «Трехмерная структура тозил-α-химотрипсина». Природа . 214 (5089): 652–656. Бибкод : 1967Natur.214..652M . дои : 10.1038/214652a0 . ПМИД 6049071 . S2CID 4273406 .
- ^ Фрир С.Т., Краут Дж., Робертус Дж.Д., Тонле Х., Райт Х.Т. (1970). «Химотрипсиноген: кристаллическая структура 2,5 Å, сравнение с α-химотрипсином и значение активации зимогена». Биохимия . 9 (9): 1997–2009. дои : 10.1021/bi00811a022 . ПМИД 5442169 .
- ^ Фельхаммер Х., Боде В. (1975). «Уточненная кристаллическая структура бычьего бета-трипсина с разрешением 1,8 Å, II. Кристаллографическое уточнение, сайт связывания кальция и активный центр при pH 7,0». Журнал молекулярной биологии . 98 (4): 693–697. дои : 10.1016/s0022-2836(75)80005-2 . ПМИД 512 .
- ^ Сойер Л., Шоттон Д.М., Кэмпбелл Дж.В., Ладнер Р.К. (1978). «Атомная структура кристаллической эластазы поджелудочной железы свиньи с разрешением 2,5 Å: сравнение со структурой альфа-химотрипсина». Журнал молекулярной биологии . 118 (2): 137–208. дои : 10.1016/0022-2836(78)90412-6 . ПМИД 628010 .
- ^ Липскомб WN; Харцук Дж.А.; Рике Г.Н.; Киочо ФА; Бетге, PH; Людвиф=г ML; Стейц Т.А.; Мюрхед Х; Коппола Дж. К. (1969). «Структура карбоксипептидазы A, VII. Исследования фермента и его комплекса с глицилтирозином с разрешением 2,0 Å и механистические выводы». Брукхейвенские симпозиумы по биологии . 21 (1): 24–90. ПМИД 5719196 .
- ^ Рис, округ Колумбия, Липскомб, В.Н. (1982). «Уточненная кристаллическая структура картофельного ингибиторного комплекса карбоксипептидазы А с разрешением 2,5 А». Журнал молекулярной биологии . 160 (3): 475–498. дои : 10.1016/0022-2836(82)90309-6 . ПМИД 7154070 .
- ^ Олден Р.А., Бирктофт Дж.Дж., Краут Дж., Робертус Дж.Д., Райт К.С. (1971). «Атомные координаты субтилизина БПН (или ново)». Биохимия Биофиз Рес Коммьюнити . 45 (2): 337–44. дои : 10.1016/0006-291X(71)90823-0 . ПМИД 5160720 .
- ^ Уэллс Дж., Эстелл Д. (1988). «Субтилизин - фермент, созданный для инженерии». Тенденции биохимической науки . 13 (8): 291–297. дои : 10.1016/0968-0004(88)90121-1 . ПМИД 3154281 .
- ^ Хубер Р., Кукла Д., Руманн А., Эпп О., Форманек Х. (1970). «Основной ингибитор трипсина поджелудочной железы крупного рогатого скота. I. Анализ структуры и конформации полипептидной цепи». Naturwissenschaften . 57 (5304): 389–392. Бибкод : 1971Natur.231..506B . дои : 10.1038/231506a0 . ПМИД 4932997 . S2CID 4158731 .
- ^ Херриотт-младший, Сикер Л.К., Дженсен Л.Х., Ловенберг В. (1970). «Структура рубредоксина: рентгеновское исследование с разрешением 2,5 Å». Журнал молекулярной биологии . 50 (2): 391–402. дои : 10.1016/0022-2836(70)90200-7 . ПМИД 5476919 .
- ^ Уотенпо К.Д., Сикер Л.К., Дженсен Л.Х. (1980). «Кристаллографическое уточнение рубредоксина при разрешении 1,2 Å». Журнал молекулярной биологии . 138 (3): 615–633. дои : 10.1016/s0022-2836(80)80020-9 . ПМИД 7411618 .
- ^ Бланделл Т.Л., Катфилд Дж.Ф., Катфилд С.М., Додсон Э.Дж., Додсон Г.Г., Ходжкин Д.С., Меркола Д.А., Виджаян М. (1971). «Положения атомов в ромбоэдрических кристаллах инсулина 2-цинка». Природа . 231 (5304): 506–511. Бибкод : 1971Natur.231..506B . дои : 10.1038/231506a0 . ПМИД 4932997 . S2CID 4158731 .
- ^ Танака Х, Като К, Ямасита Э, Сумидзава Т, Чжоу Ю, Яу М, Ивасаки К, Ёсимура М, Цукихара Т (2009). «Структура свода печени крысы при разрешении 3,5 ангстрем». Наука . 323 (5912): 384–388. Бибкод : 2009Sci...323..384T . дои : 10.1126/science.1164975 . ПМИД 19150846 . S2CID 2072790 .
- ^ Касанас А., Кероль-Ауди Дж., Герра П., Поус Дж., Танака Х., Цукихара Т., Вердагер Н., Фита I (2013). «Новые особенности архитектуры и динамики хранилища, выявленные благодаря новому усовершенствованию с использованием подхода деформируемой эластичной сети» (PDF) . Акта Кристаллографика . D69 (Часть 6): 1054–1061. дои : 10.1107/S0907444913004472 . hdl : 10261/88208 . ПМИД 23695250 .