Марганцевая пероксидаза
| пероксидаза марганца | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 1.11.1.13 | ||
| Номер CAS. | 114995-15-2 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
В энзимологии ( пероксидаза марганца КФ 1.11.1.13 ) — фермент химическую , катализирующий реакцию .
- 2 Мп(II) + 2 Н + + OH2O2 2 Mn(III) + 2 H 2 O
Тремя субстратами этого фермента являются Mn(II) , H + и H 2 O 2 , тогда как двумя его продуктами являются Mn(III) и H 2 O .
Этот фермент принадлежит к семейству оксидоредуктаз , а именно тех, которые действуют на пероксид в качестве акцептора (пероксидазы). Систематическое название этого класса ферментов — Mn(II): оксидоредуктаза перекиси водорода . Другие широко используемые названия включают пероксидазу-М2 и Mn-зависимую (НАДН-окисляющую) пероксидазу . Он использует один кофактор , гем . Этот фермент нуждается в Ca 2+ для активности.
Грибы белой гнили выделяют этот фермент, способствующий разложению лигнина .
Открытие и характеристика
[ редактировать ]Марганцевая пероксидаза (обычно называемая MnP) была открыта в 1985 году одновременно исследовательскими группами Майкла Х. Голда. [ 1 ] и Рональд Кроуфорд [ 2 ] у гриба Phanerochaete chrysosporium . Белок в 1989 году был генетически секвенирован у P. chrysoporium . [ 3 ] Считается, что этот фермент уникален для Basidiomycota, поскольку бактерий , дрожжей или плесени до сих пор не обнаружено , которые естественным образом продуцируют его.
Механизм реакции
[ редактировать ]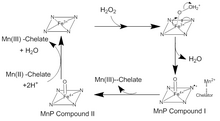
Катализ MnP происходит в серии необратимых окислительно-восстановительных ( окислительно-восстановительных ) реакций, которые следуют механизму пинг-понга с кинетикой второго порядка . [ 4 ] На первой стадии каталитического цикла H 2 O 2 или органический пероксид попадает в активный центр MnP. Там кислород в H 2 O 2 связывается с ионом Fe(III) в кофакторе гема с образованием комплекса пероксида железа. Два электрона передаются от Fe 3+ перекиси, разрывая связь кислород-пероксид с образованием H 2 комплекса Fe(IV) O и оксопорфиринового радикального . Это окисленное промежуточное соединение известно как Соединение I MnP. Соединение I MnP затем связывается с монохелатным ионом Mn(II), который отдает электрон для гашения радикала и образует Mn(III) и Соединение II MnP, оксо- Fe(IV) порфириновый комплекс. Соединение II MnP окисляет другой ион Mn(II) до Mn(III) и восстанавливается в результате реакции двух ионов H+ и связанного железом кислорода. При этом ион Fe(III) преобразуется в гем и высвобождается вторая молекула воды. [ 5 ] Существует множество отклонений от этого традиционного каталитического цикла. Соединение MnP I можно использовать для окисления свободного Mn(II), ферроцианида , а также фенольных соединений и других ароматических соединений . [ 6 ]
Хелаторы
[ редактировать ]Mn(III) неустойчив в водных средах, поэтому MnP выделяет его в виде хелата Mn(III) -карбоновой кислоты . Существует множество хелаторов карбоновых кислот, включая оксалат , малонат , тартрат и лактат , однако наиболее распространенным является оксалат. Структура пероксидазы отдает предпочтение хелатам Mn(III) по сравнению со свободными ионами Mn(III). Хелат Mn(III) взаимодействует с активным центром, облегчая высвобождение продукта из фермента. [ 7 ] Хелатор может влиять на кинетическую скорость и даже на катализируемую реакцию. Если субстрат Mn(II) хелатирован лактатом, MnP вместо этого катализирует выделение O 2 . Однако эта побочная реакция мало влияет на ферментативную активность, поскольку она следует более медленной кинетике третьего порядка. [ 4 ]
Структурные исследования
[ редактировать ]
По состоянию на конец 2007 года 6 структур для этого класса ферментов было решено PDB с кодами доступа 1MN1 , 1MN2 , 1YYD , 1YYG , 1YZP и 1YZR .
Хотя MnP, как и другие лигнинпероксидазы класса II , является пероксидазой , он имеет третичную структуру, аналогичную прокариотическим пероксидазам класса I, но содержит дисульфидные мостики, как пероксидазы класса III в растениях. [ 8 ] МнП имеет глобулярную структуру, содержащую 11-12 α-спиралей, в зависимости от вида, у которого он образуется. Он стабилизирован 10 остатками цистина аминокислотными , образующими 5 дисульфидных мостиков, один из которых находится вблизи С-концевой области. Активный центр содержит кофактор гема, который связан двумя Ca 2+ ионы, один выше и один ниже гема. Рядом с внутренним пропионатом гема находятся три кислотных остатка, которые используются для стабилизации Mn(II) или Mn(III), когда он связан с ферментом. Конкретные остатки различаются у разных видов, но их количество и относительное расположение в свернутом белке сохраняются. имеется 357 аминокислотных остатков Всего в MnP P. chryssoporium , и такое же количество — в ферментах, продуцируемых другими базидиомицетами. [ 9 ]
Биохимическое значение
[ редактировать ]Основная функция ионов Mn(III), образующихся под действием MnP, — окисление и деградация лигнина. [ 10 ] Для этой цели базидиомицеты секретируют MnP, а не Mn(III), и фермент функционирует вне грибковой клетки. Ионы Mn(III) из MnP могут напрямую окислять фенольные соединения в лигнине, но они также могут окислять некоторые органические соединения серы и ненасыщенные жирные кислоты . При этом окислении образуются тиильные и пероксильные радикалы, которые в присутствии О 2 могут окислять лигнин или вступать в реакцию с водой с образованием Н 2 О 2 . [ 11 ] [ 12 ] Мн 3+ Сам ион может разлагать лигнин, катализируя расщепление алкил - арила и окисление α-углерода в фенолах. [ 13 ]
Регулирование
[ редактировать ]Активность MnP контролируется посредством регуляции транскрипции . MnP активируется за счет увеличения внеклеточного Mn(II) [ 14 ] и H 2 O 2 концентрации . Было обнаружено, что повышенная концентрация O 2 и тепловой стресс также активируют MnP. [ 15 ]
Ссылки
[ редактировать ]- ^ Гленн Дж. К., Gold MH (ноябрь 1985 г.). «Очистка и характеристика внеклеточной Mn (II)-зависимой пероксидазы из разлагающего лигнин базидиомицета Phanerochaete chrysosporium». Арх. Биохим. Биофиз . 242 (2): 329–41. дои : 10.1016/0003-9861(85)90217-6 . ПМИД 4062285 .
- ^ Пащинский А., Хюнь В.Б., Кроуфорд Р. (август 1985 г.). «Ферментативная активность внеклеточной марганец-зависимой пероксидазы Phanerochaete chrysosporium » . ФЭМС Микробиол. Летт . 29 (1–2): 37–41. дои : 10.1111/j.1574-6968.1985.tb00831.x .
- ^ Прибнов Д., Мэйфилд М.Б., Ниппер В.Дж., Браун Дж.А., Голд М.Х. (март 1989 г.). «Характеристика кДНК, кодирующей пероксидазу марганца, из разлагающего лигнин базидиомицета Phanerochaete chrysosporium» . Ж. Биол. Хим . 264 (9): 5036–40. ПМИД 2925681 .
- ^ Jump up to: а б Варииси Х., Валли К., Голд М.Х. (ноябрь 1992 г.). «Окисление марганца (II) пероксидазой марганца базидиомицета Phanerochaete chrysosporium . Кинетический механизм и роль хелаторов» . Ж. Биол. Хим . 267 (33): 23688–95. ПМИД 1429709 .
- ^ Хофрихтер М. (апрель 2002 г.). « Обзор: преобразование лигнина пероксидазой марганца (MnP) ». Ферментные и микробные технологии . 30 (4): 454–66. дои : 10.1016/S0141-0229(01)00528-2 .
- ^ Хейнфлинг А., Руис-Дуэньяс Ф.Дж., Мартинес М.Дж., Бергбауэр М., Шевчик У., Мартинес А.Т. (май 1998 г.). «Исследование по восстановлению субстратов марганец-окисляющих пероксидаз Pleurotus eryngii и Bjerkandera adusta» . ФЭБС Летт . 428 (3): 141–6. дои : 10.1016/s0014-5793(98)00512-2 . ПМИД 9654123 . S2CID 39842460 .
- ^ Банки Л., Бертини И., Даль Поццо Л., Дель Конте Р., Тьен М. (июнь 1998 г.). «Мониторинг роли оксалата в пероксидазе марганца». Биохимия . 37 (25): 9009–15. дои : 10.1021/bi972879+ . ПМИД 9636044 .
- ^ Велиндер К.Г. (июнь 1992 г.). « Суперсемейство растительных, грибковых и бактериальных пероксидаз ». Современное мнение в области структурной биологии . 2 (3): 388–93. дои : 10.1016/0959-440X(92)90230-5 .
- ^ Мартинес А. (апрель 2002 г.). « Молекулярная биология и структурно-функция лигнин-деградирующих гемопероксидаз ». Ферментные и микробные технологии . 30 (4): 425–444. дои : 10.1016/S0141-0229(01)00521-X .
- ^ Forrester IT, Grabski AC, Burgess RR, Leatham GF (декабрь 1988 г.). «Марганец, Mn-зависимые пероксидазы и биоразложение лигнина». Биохим. Биофиз. Рез. Коммун . 157 (3): 992–9. дои : 10.1016/S0006-291X(88)80972-0 . ПМИД 3207431 .
- ^ Вариси Х., Валли К., Ренганатан В., Голд М.Х. (август 1989 г.). «Тиол-опосредованное окисление нефенольных модельных соединений лигнина марганцевой пероксидазой Phanerochaete chrysosporium» . Ж. Биол. Хим . 264 (24): 14185–91. ПМИД 2760063 .
- ^ Капич А.Н., Йенсен К.А., Хаммель К.Е. (ноябрь 1999 г.). «Пероксильные радикалы являются потенциальными агентами биодеградации лигнина» . ФЭБС Летт . 461 (1–2): 115–9. дои : 10.1016/s0014-5793(99)01432-5 . ПМИД 10561507 . S2CID 25335594 .
- ^ Туор У, Варииси Х., Шумейкер Х.Э., Голд М.Х. (июнь 1992 г.). «Окисление модельных соединений фенольного арилглицерина, бета-арилового эфира лигнина марганцевой пероксидазой из Phanerochaete chrysosporium : окислительное расщепление модельного соединения альфа-карбонила». Биохимия . 31 (21): 4986–95. дои : 10.1021/bi00136a011 . ПМИД 1599925 .
- ^ Браун Дж.А., Алик М., Голд М.Х. (июль 1991 г.). «Транскрипция гена марганцевой пероксидазы у Phanerochaete chrysosporium: активация марганцем» . Дж. Бактериол . 173 (13): 4101–6. дои : 10.1128/jb.173.13.4101-4106.1991 . ПМК 208059 . ПМИД 2061289 .
- ^ Ли Д., Алик М., Браун Дж.А., Голд М.Х. (январь 1995 г.). «Регуляция транскрипции гена пероксидазы марганца с помощью перекиси водорода, химического стресса и молекулярного кислорода» . Прил. Окружающая среда. Микробиол . 61 (1): 341–5. дои : 10.1128/АЕМ.61.1.341-345.1995 . ПМК 167287 . ПМИД 7887613 .
Дальнейшее чтение
[ редактировать ]- Гленн Дж.К., Акилесваран Л., Голд М.Х. (1986). «Окисление Mn (II) является основной функцией внеклеточной Mn-пероксидазы Phanerochaete chrysosporium». Арх. Биохим. Биофиз . 251 (2): 688–96. дои : 10.1016/0003-9861(86)90378-4 . ПМИД 3800395 .
- Пащинский А., Хюнь В.Б., Кроуфорд Р. (1986). «Сравнение лигниназы-I и пероксидазы-М2 гриба белой гнили Phanerochaete chrysosporium». Арх. Биохим. Биофиз . 244 (2): 750–65. дои : 10.1016/0003-9861(86)90644-2 . ПМИД 3080953 .
- Вариси Х., Акилесваран Л., Голд М.Х. (1988). «Марганцевая пероксидаза из базидиомицета Phanerochaete chrysosporium: спектральная характеристика окисленных состояний и каталитического цикла». Биохимия . 27 (14): 5365–5370. дои : 10.1021/bi00414a061 . ПМИД 3167051 .
