Эволюция ионов металлов в биологических системах
Эволюция ионов металлов в биологических системах относится к включению ионов металлов в живые организмы и к тому, как оно изменилось с течением времени. Ионы металлов были связаны с биологическими системами на протяжении миллиардов лет, но только в прошлом веке ученые начали по-настоящему оценивать масштаб их влияния. Ионы основных ( железо , марганец , магний и цинк ) и второстепенных ( медь , кобальт , никель , молибден , вольфрам ) металлов стали ассоциироваться с живыми организмами в результате взаимодействия биогеохимического выветривания и метаболических путей , включающих продукты этого выветривания. Сопутствующие комплексы развивались с течением времени.
Естественное развитие химических веществ и элементов заставило организмы адаптироваться или умереть. Нынешним организмам необходимы окислительно-восстановительные реакции, чтобы стимулировать метаболизм и другие жизненные процессы. Металлы имеют тенденцию терять электроны и важны для окислительно-восстановительных реакций.
Металлы стали настолько важными для клеточных функций, что совокупность металлосвязывающих белков (называемых металломами ) составляет более 30% всех белков в клетке. Известно, что металлы участвуют более чем в 40% ферментативных реакций, а металлсвязывающие белки выполняют хотя бы одну стадию практически во всех биологических путях . [ 1 ]
Металлы также токсичны, поэтому необходимо соблюдать баланс, чтобы регулировать, где металлы находятся в организме и в каких количествах. Многие организмы имеют гибкие системы, в которых они могут обменивать один металл на другой, если его не хватает. Металлы, о которых идет речь в этом обсуждении, представляют собой встречающиеся в природе элементы, которые имеют тенденцию подвергаться окислению . Ванадий, молибден, кобальт, медь, хром, железо, марганец, никель и цинк считаются незаменимыми, поскольку без них биологические функции нарушаются.
Происхождение
[ редактировать ]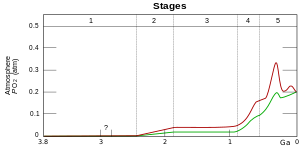
Земля возникла как железный водный мир с низким содержанием кислорода. Великое событие оксигенации произошло примерно 2,4 млрд лет назад (миллиарды лет назад), когда цианобактерии и фотосинтетическая жизнь вызвали присутствие дикислорода в атмосфере планеты. Железо стало нерастворимым (как и другие металлы) и дефицитным, в то время как другие металлы стали растворимыми. Сера была очень важным элементом в то время. Как только кислород был выпущен в окружающую среду, сульфаты сделали металлы более растворимыми и высвободили эти металлы в окружающую среду; особенно в воду. [ 1 ] Включение металлов, возможно, боролось с окислительным стрессом.
Центральная химия всех этих клеток должна быть восстановительной , чтобы был возможен синтез необходимых химических веществ, особенно биополимеров . Различные анаэробные , автокаталитические , восстановительные метаболические пути, наблюдаемые в самых ранних известных клетках, развивались в отдельных заряженных везикулах, протоклетках , где они вырабатывались совместно с определенными основаниями нуклеиновых кислот. [ 2 ]
Гипотезы, объясняющие, как элементы стали незаменимыми, заключаются в их относительном количестве в окружающей среде при формировании жизни. Это привело к исследованию происхождения жизни; например, Оргель и Крик выдвинули гипотезу о том, что жизнь была внеземной из-за предполагаемого низкого содержания молибдена на ранней Земле (теперь подозревается, что его количество было больше, чем считалось ранее). [ нужна ссылка ] ). Другой пример — формирование жизни вокруг термальных источников, основанное на наличии цинка и серы. [ 1 ] В сочетании с этой теорией можно предположить, что жизнь развивалась как хемоавтотрофы . Следовательно, жизнь возникла вокруг металлов, а не в ответ на их присутствие. Некоторым доказательством этой теории является то, что неорганическая материя обладает самостоятельными атрибутами, которые приняла жизнь, о чем свидетельствует ее разделение на части. [ 2 ] Другие доказательства включают легкое связывание металлов искусственными белками без эволюционной истории. [ 3 ]
Значение ионов металлов в эволюции
[ редактировать ]Катализ
[ редактировать ]окислительно-восстановительные катализаторы
[ редактировать ]Пребиотическая химия жизни должна была быть восстановительной , чтобы получать, например, окись углерода (CO) и цианистый водород (HCN) из существующих CO 2 и N 2 в атмосфере. CO и HCN были молекулами-предшественниками основных биомолекул , белков , липидов , нуклеотидов и сахаров . [ 4 ] Однако уровень кислорода в атмосфере значительно увеличился, и тогда клеткам стало необходимо контролировать восстановление и окисление таких небольших молекул, чтобы при необходимости строить и разрушать клетки без неизбежного окисления (разрушения) всего. Ионы переходных металлов из-за их множественных степеней окисления были единственными элементами, способными контролировать состояния окисления таких молекул, и поэтому были выбраны для них. [ 5 ]
Конденсация и гидролиз
[ редактировать ]О-доноры [ необходимо определение ] например, ГПО 2−
4 были в изобилии в пребиотической атмосфере. [ 6 ] Связывание ионов металлов с такими O-донорами было необходимо для построения биологических полимеров, поскольку связь, как правило, слабая, она может катализировать необходимую реакцию и диссоциировать после (т.е. Mg 2+ в синтезе ДНК ).
Содержание металлов в морской воде
[ редактировать ]| Элемент | Пребиотические условия (М) [ 6 ] | Аэробные условия (М) [ 6 ] |
|---|---|---|
| мг 2+ | ~ 10 −2 | ~ 10 −2 |
| Мин. 2+ | ~ 10 −6 | ~ 10 −8 |
| Фе | ~ 10 −7 [Fe(II)] | ~ 10 −19 [Fe(III)] |
| Ко 2+ | ~ 10 −9 | ~ 10 −9 |
| В 2+ | < 10 −9 | < 10 −9 |
| С | < 10 −20 (очень низкий) [Cu(I)] | < 10 −10 [Си(II)] |
| Зн 2+ | < 10 −12 (очень низкий) | ~ 10 −8 |
| Мо | ~ 10 −9 (МоС 2− 4 , Мо(ОН) 6 ) |
10 −8 (МО 2− 4 ) |
| В | WS 2− 4 |
10 −9 (ГДЕ 2− 4 ) |
| ЧАС + | низкий pH (5,5?) | рН 8,5 |
| Ч 2 С | 10 −2 (Высокий) | низкий [ТАК 2− 4 (10 −2 )] |
| О 2 | < 10 −6 банкомат | ~ 10 −1 банкомат (21%) |
Пребиотические (анаэробные) условия
[ редактировать ]Около 4 млрд лет назад кислая морская вода содержала большое количество H 2 S и, таким образом, создавала восстановительную среду с потенциалом около -0,2 В. [ 6 ] Таким образом, любой элемент, который имел большое отрицательное значение по отношению к восстановительному потенциалу окружающей среды, был доступен в свободной ионной форме и впоследствии мог быть включен в клетки, т.е. Mg 2+ имеет восстановительный потенциал -2,372 В и в то время был доступен в ионной форме.
Аэробные условия
[ редактировать ]Около 2 млрд лет назад произошло повышение уровня кислорода в атмосфере , что вызвало окисление H 2 S в окружающей среде и повышение pH морской воды. Образовавшаяся среда стала более окислительной и, таким образом, позволила позднее включить более тяжелые металлы, такие как медь и цинк . [ 7 ]
Серия Ирвинга – Уильямса
[ редактировать ]Другим фактором, влияющим на доступность ионов металлов, была их растворимость H 2 S. в Сероводород был в изобилии в раннем море, что привело к образованию H 2 S в пребиотических кислых условиях и HS. − в нейтральных ( рН = 7,0) условиях. В ряду сульфидов металлов нерастворимость увеличивается при нейтральном pH по ряду Ирвинга-Вильямса :
- Mn(II) < Fe(II) < Co(II) ≤ Ni(II) < Cu(II) > Zn(II)
Таким образом, в больших количествах H 2 S , который был пребиотическим состоянием, только Fe было наиболее доступно в ионной форме из-за его низкой нерастворимости в сульфидах . Возрастающее окисление H 2 S в SO 2−
4 приводит к более позднему выпуску Co. +2 , Является +2 , С +2 , и Zn +2 поскольку все их сульфаты растворимы.
Ионы металлов
[ редактировать ]Магний
[ редактировать ]Магний является восьмым по распространенности элементом на Земле. Это четвертый по распространенности элемент у позвоночных и самый распространенный двухвалентный катион в клетках. Самая доступная форма магния (Mg 2+ ) для живых организмов можно найти в гидросфере. Концентрация Mg 2+ в морской воде составляет около 55 мМ. мг 2+ легко доступен клеткам на ранних этапах эволюции из-за его высокой растворимости в воде. Другие переходные металлы, такие как кальций, выпадают в осадок из водных растворов в гораздо более низких концентрациях, чем соответствующий Mg. 2+ соли. [ 8 ]
Поскольку магний был легко доступен на ранних стадиях эволюции, его можно найти в каждом клеточном живом организме. Магний у анаэробных прокариот содержится в MgATP . Магний также выполняет множество функций у прокариот, таких как гликолиз , все киназы, реакция NTP, передача сигналов, структуры ДНК/РНК и захват света. У аэробных эукариот магний содержится в цитоплазме и хлоропластах . Реакции в этих клеточных компартментах включают гликолиз, фотофосфорилирование и ассимиляцию углерода .
АТФ, основной источник энергии почти во всех живых организмах, должен связываться с ионами металлов, таких как Mg. 2+ или Ca 2+ функционировать. Исследование клеток с ограниченным запасом магния показало, что недостаток магния может вызвать снижение АТФ. [ 9 ] Магний при гидролизе АТФ действует как кофактор, стабилизирующий переходное состояние с высоким отрицательным зарядом . [ 10 ] MgATP можно найти как в клетках прокариот, так и в клетках эукариот. Однако большая часть АТФ в клетках представляет собой MgATP. Согласно ряду Ирвинга-Вильямса , магний имеет более высокую константу связывания, чем Ca. 2+ . Следовательно, доминирующим АТФ в живых организмах является MgАТФ. Более высокая константа связывания также дает магнию преимущество как лучшего катализатора перед другими конкурирующими переходными металлами.
Марганец
[ редактировать ]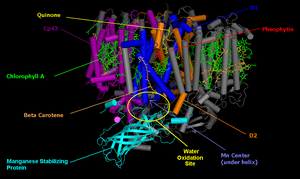
Имеющиеся данные свидетельствуют о том, что марганец (Mn) впервые был включен в биологические системы примерно 3,2–2,8 миллиарда лет назад, в архейский период . Вместе с кальцием он образовал комплекс оксида марганца и кальция (определенный методом рентгеновской дифракции ), который состоял из кластера марганца, по существу, неорганической кубанской (кубической) структуры. Включение марганцевого центра в фотосистему II имело большое значение, поскольку позволяло фотосинтетически растениям ( ОЕС выделять кислород. Кислородвыделяющий комплекс ) является важнейшим компонентом фотосистемы II, содержащейся в тилакоидных мембранах хлоропластов; он отвечает за терминальное фотоокисление воды во время световых реакций . [ 11 ]
Включение Mn в белки позволило комплексам восстановить способность активных форм кислорода в Mn- супероксиддисмутазе (MnSOD) и каталазе , в катализе, зависимом от переноса электрона (например, в некоторых рибонуклеотидредуктазах класса I ), и в окислении воды фотосистема II (PSII), в которой снижается выработка веществ, реагирующих с тиобарбитуровой кислотой. Это связано со способностью марганца восстанавливать супероксид-анион и гидроксильные радикалы , а также его способностью разрывать цепи. [ 12 ]
Железо
[ редактировать ]Железо (Fe) — самый распространенный элемент на Земле и четвертый по распространенности элемент в земной коре, его доля составляет примерно 5 процентов по массе. Из-за обилия железа и его роли в биологических системах переходные и минералогические стадии железа сыграли ключевую роль в системах поверхности Земли. Большую роль в геологическом прошлом он сыграл в морской геохимии , о чем свидетельствуют отложения докембрийских богатых железом отложений. Окислительно -восстановительное превращение Fe(II) в Fe(III) или наоборот жизненно важно для ряда биологических процессов и процессов круговорота элементов. Fe восстановление Видно, что (III) приводит к окислению серы (от H 2 S до SO 4 −2 ), который является центральным процессом в морских отложениях. Многие из первых металлопротеинов состояли из железо-серных комплексов, образующихся в процессе фотосинтеза . [ 13 ] Железо является основным окислительно-восстановительным металлом в биологических системах. В белках он обнаруживается в различных сайтах и кофакторах, включая, например, гем-группы , сайты Fe-O-Fe и кластеры железо-сера.
Преобладание железа, по-видимому, связано с большой доступностью Fe(II) в начальной эволюции живых организмов, до возникновения фотосинтеза и увеличения уровня кислорода в атмосфере, что привело к осаждению железа в окружающей среде в виде Fe(OH). ) 3 . Он обладает гибкими окислительно-восстановительными свойствами, поскольку такие свойства чувствительны к координации лигандов , включая геометрию. Железо также можно использовать в ферментах благодаря его свойствам кислоты Льюиса , например, в нитрилгидратазе. Железо часто обнаруживается в моноядерных центрах в восстановленной форме Fe(II) и участвует в активации дикислорода; эта функция используется в качестве основного механизма, используемого живыми организмами, чтобы избежать кинетического барьера, препятствующего трансформации органических соединений под действием O 2 . [ 14 ] Железо может избирательно усваиваться в виде ферредоксинов, Fe-O-Fe (гемеритрин и рибонуклеотидредуктаза), Fe (многие оксидазы), кроме железопорфирина. Вариации родственных белков с любой из этих химических форм железа привели к образованию широкого спектра ферментов. Все эти механизмы модифицированы, чтобы функционировать как с точки зрения реактивности, так и с точки зрения позиционирования белка в клетке. Железо может иметь различные окислительно-восстановительные и спиновые состояния и может присутствовать во многих стереохимических процессах. [ 15 ]
Никель и кобальт
[ редактировать ]
Около 4–3 млрд лет назад анаэробные прокариоты начали вырабатывать металлические и органические кофакторы для поглощения света. В конечном итоге они начали производить хлорофилл из Mg(II), который содержится в цианобактериях и растениях, что привело к современному фотосинтезу . Однако синтез хлорофилла требует множества этапов. Процесс начинается с уропорфирина, примитивного предшественника порфиринового кольца, который может быть биотического или абиотического происхождения, который затем по-разному модифицируется в клетках с образованием комплексов Mg , Fe , никеля (Ni) и кобальта (Co) . Центры этих колец не являются селективными, что позволяет включать различные ионы металлов. Порфирин Mg дает начало хлорофиллу, порфирин Fe — гемобелкам , порфирин Ni дает фактор F-430 , а порфирин Co — коэнзиму B12 . [ 16 ]
Медь
[ редактировать ]До Великого события оксигенации медь не была доступна живым организмам. Самой ранней медью была Cu. + и Ку. Эта степень окисления меди плохо растворяется в воде. Миллиард лет назад, после великого события окисления, давление кислорода возросло настолько, что окислилось Cu. + в Cu 2+ , увеличивая его растворимость в воде. В результате медь стала гораздо более доступной для живых организмов.
Большинство медьсодержащих белков и ферментов можно найти у эукариот . Лишь немногие прокариоты , такие как аэробные бактерии и цианобактерии, содержат ферменты или белки меди. так и в прокариотах Медь можно найти как в ферменте супероксиддисмутазе (СОД), . Существует три различных типа СОД, содержащие Mn, Fe и Cu соответственно. Mn-СОД и Fe-СОД обнаружены в большинстве прокариот и митохондриях эукариотической клетки. Cu-СОД можно обнаружить в цитоплазматической фракции эукариотических клеток. Три элемента — медь, железо и марганец — могут катализировать супероксид до обычного молекулярного кислорода или перекиси водорода. Однако Cu-SOD более эффективен, чем Fe-SOD и Mn-SOD. Большинство прокариот используют только Fe-SOD или Mn-SOD из-за отсутствия меди в окружающей среде. Некоторые организмы не развили Cu-SOD из-за отсутствия генофонда для принятия Cu-SOD. [ 17 ]
Цинк
[ редактировать ]Цинк (Zn) внедрялся в живые клетки двумя волнами. Возникли четыре-три Ga анаэробных прокариотов, а атмосфера была полна H 2 S и имела высокую восстановительную способность. Таким образом, большая часть цинка находилась в форме нерастворимого ZnS . Однако, поскольку морская вода в то время была слегка кислой, некоторая часть Zn(II) была доступна в ионной форме и стала частью внешних протеаз ранних анаэробных прокариот , внешних нуклеаз , внутренних синтетаз и дегидрогеназ . [ 7 ]
Во время второй волны, когда произошло Великое событие оксигенации, в морской воде стало больше ионов Zn(II). Это позволило ему внедриться в одноклеточные эукариоты, возникшие в то время. Считается, что более позднее добавление таких ионов, как цинк и медь, позволило им вытеснить железо и марганец из фермента супероксиддисмутазы (СОД). Комплексы Fe и Mn легко диссоциируют (ряд Ирвинга–Вильямса), а Zn и Cu — нет. Вот почему эукариотическая СОД содержит Cu или Zn, а ее прокариотический аналог — Fe или Mn. [ 7 ]
Zn(II) не представляет угрозы окисления цитоплазмы . Это позволило ему стать основным цитоплазматическим элементом эукариот. Он стал ассоциироваться с новой группой транскрипционных белков — цинковыми пальцами . Это могло произойти только из-за долгой жизни эукариот, которая дала цинку время для обмена и, следовательно, стал внутренним посланником, координирующим действие других факторов транскрипции во время роста. [ 7 ]
Молибден
[ редактировать ]Молибден (Мо) является наиболее распространенным переходным элементом в растворах в море (в основном в виде дианионного иона молибдата) и в живых организмах, его содержание в земной коре довольно низкое. Поэтому использование Мо живыми организмами на первый взгляд кажется удивительным. Археи , бактерии, грибы, растения и животные, включая человека, нуждаются в молибдене. Он также содержится в более чем 50 различных ферментах . Его гидролиз до водорастворимых оксо-анионных частиц делает Мо легко доступным. Мо обнаружен в активных центрах металлоферментов , осуществляющих ключевые превращения в метаболизме соединений углерода, азота, мышьяка, селена, серы и хлора. Мононуклеарные ферменты Мо широко распространены в биосфере; они катализируют многие важные реакции метаболизма азотсодержащих и серосодержащих соединений, а также различных карбонильных соединений (например, альдегидов, СО и СО 2 ). Ферменты нитратредуктазы важны для азотистого цикла. Они относятся к классу ферментов с моноядерным Мо-центром и катализируют реакции обмена С, N, S и др. у бактерий, растений, животных и человека. [ 18 ] Благодаря окислению сульфидов первым значительным достижением стало появление аэробных бактерий , которые теперь могли утилизировать Мо. [ 11 ] По мере того как в атмосфере и океанах начал накапливаться кислород, усилилась и реакция MoS 2 на МоО 4 . Эта реакция сделала хорошо растворимый ион молибдата доступным для включения в критические металлоферменты и, таким образом, возможно, позволила процветать жизни. Это позволило организмам занять новые экологические ниши. Мо играет важную роль в восстановлении диазота до аммиака , которое происходит в одном типе нитрогеназ . Эти ферменты используются бактериями, которые обычно живут в симбиотических отношениях с растениями; их роль — фиксация азота , что жизненно важно для поддержания жизни на Земле. Ферменты Мо также играют важную роль в метаболизме серы у организмов, от бактерий до человека. [ 18 ]
вольфрам
[ редактировать ]
Вольфрам — один из старейших ионов металлов, включенных в биологические системы еще до Великого события оксигенации. До обилия кислорода в атмосфере Земли океаны изобиловали серой и вольфрамом, а молибден, металл, очень похожий по химическому составу, был недоступен в твердой форме. Обилие вольфрама и недостаток свободного молибдена, вероятно, объясняют, почему ранние морские организмы использовали первый вместо второго. Однако, когда цианобактерии начали наполнять атмосферу кислородом, молибден стал доступен (молибден становится растворимым при воздействии кислорода), и молибден начал заменять вольфрам в большинстве метаболических процессов , что и наблюдается сегодня, поскольку вольфрам присутствует только в биологических процессах. комплексы прокариот (метаногены, грамположительные бактерии, грамотрицательные аэробы и анаэробы) и обязателен только у гипертермофильных архей, таких как P. Furiosus . [ 19 ]
Хотя исследования специфических ферментных комплексов, в которые входит вольфрам, проводились относительно недавно (1970-е годы), природные вольфрамовые ферменты в изобилии обнаруживаются у большого числа прокариотических микроорганизмов. К ним относятся формиатдегидрогеназа, формилметануфурандегидрогеназа, ацетиленгидратаза и класс филогенетически родственных оксидоредуктаз, которые катализируют обратимое окисление альдегидов. Первая кристаллическая структура вольфрам- или птерин -содержащего фермента, альдегид- ферредоксин- оксидоредуктазы из P. Furiosus, выявила каталитический сайт с одним атомом W, координированным с двумя молекулами птерина, которые сами связаны ионом магния. [ 18 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с Моноссон, Эмили (2012). Эволюция в токсичном мире . Спрингер. дои : 10.5822/978-1-61091-221-1 . ISBN 978-1-59726-341-2 . S2CID 83040488 .
- ^ Jump up to: а б Рассел, MJ; Уильям, М. (2003). «О происхождении клеток: гипотеза эволюционных переходов от абиотической геохимии к хемоавтотрофным прокариотам и от прокариотов к ядросодержащим клеткам» . Философские труды Лондонского королевского общества B: Биологические науки . 358 (1429): 59–85. дои : 10.1098/rstb.2002.1183 . ПМК 1693102 . ПМИД 12594918 .
- ^ Ван, М.С.; Хёглер, К.Х.; Хехт, М (2019). «Неразвитые белки De Novo обладают врожденной склонностью связывать переходные металлы» . Жизнь . 9 (8): 8. дои : 10.3390/life9010008 . ПМК 6463171 . ПМИД 30634485 .
- ^ Гонсалес, Р.Н.; Поннамперума, К. (1995). «Роль ионов микроэлементов в химической эволюции. Случай свободнорадикальных реакций». Достижения в космических исследованиях . 15 (3): 357–364. Бибкод : 1995AdSpR..15..357N . дои : 10.1016/s0273-1177(99)80107-0 . ПМИД 11539250 .
- ^ Клечковский, М; Гарнцарц, М (2012). «Роль ионов металлов в биологическом окислении – прошлое и настоящее» . Польский журнал ветеринарных наук . 15 (1): 165–173. дои : 10.2478/v10181-011-0130-8 . ПМИД 22708374 .
- ^ Jump up to: а б с д Уильямс, RJP; Фраусто да Силва, JJR (2006). Химия эволюции . Амстердам: Эльзевир. ISBN 9780080460529 .
- ^ Jump up to: а б с д Уильямс, RJP (2012). «Цинк в эволюции». Журнал неорганической биохимии . 111 : 104–109. дои : 10.1016/j.jinorgbio.2012.01.004 . ПМИД 22855949 .
- ^ Магуайр, Майкл Э.; Коуэн, Джеймс А. (2002). «Химия и биохимия магния». Биометаллы . 15 (3): 203–210. дои : 10.1023/а:1016058229972 . ПМИД 12206387 . S2CID 31622669 .
- ^ Подагра, Элизабет; Ребей, Фабрис; Дус, Роланд ; Блиньи, Ричард (13 октября 2014 г.). «Взаимодействие Мг. 2+ , АДФ и АТФ в цитозоле и митохондриях: раскрытие роли магния 2+ в клеточном дыхании» . Proceedings of the National Academy of Sciences . 111 : E4560–E4567. Bibcode : 2014PNAS..111E4560G . doi : 10.1073/pnas.1406251111 . PMC 4217410. (43 ) PMID 25313036 .
- ^ Уильямс, Николас Х. (2000). «Гидролиз АТФ, катализируемый ионами магния». Журнал Американского химического общества . 122 (48): 12023–12024. дои : 10.1021/ja0013374 .
- ^ Jump up to: а б Уильямс, RJP (2007). «Системная биология эволюции: участие ионов металлов». Биометаллы . 20 (2): 107–112. дои : 10.1007/s10534-007-9087-6 . ПМИД 17295048 . S2CID 29462278 .
- ^ Саломон, Этиан; Керен, Нир (2011). «Марганец в биологических системах: транспорт и функция». Химия функциональных групп Патаи . дои : 10.1002/9780470682531.pat0540 . ISBN 9780470682531 .
- ^ Тейлор, КГ; Конхаузер, КО (2011). «Железо в системах поверхности Земли: основной игрок в химических и биологических процессах». Элементы . 7 (2): 83–88. дои : 10.2113/gselements.7.2.83 .
- ^ Андреини, К.; Бертини, И.; Кавалларо, Дж.; Холлидей, GL; Торнтон, Дж. М. (2008). «Ионы металлов в биологическом катализе: от баз данных ферментов к общим принципам». Журнал биологической неорганической химии . 13 (8): 1205–1218. дои : 10.1007/s00775-008-0404-5 . ПМИД 18604568 . S2CID 22862135 .
- ^ Уильямс, RJP (1985). «Симбиоз функций металла и белка» . Европейский журнал биохимии . 150 (2): 231–248. дои : 10.1111/j.1432-1033.1985.tb09013.x . ПМИД 2990929 .
- ^ Франк, С.; Бриндли, А.А.; Дири, Э.; Хиткот, П.; Лоуренс, AD; Лич, Гонконг; Пикерсгилл, RW; Уоррен, MJ (2005). «Анаэробный синтез витамина B 12 : характеристика ранних этапов пути». Труды Биохимического общества . 33 (4): 811–814. дои : 10.1042/BST0330811 . ПМИД 16042604 .
- ^ Отиай, Эй-Ичиро (1983). «Медь и биологическая эволюция». Биосистемы . 16 (2): 81–86. дои : 10.1016/0303-2647(83)90029-1 . ПМИД 6640084 .
- ^ Jump up to: а б с Сигел, А.; Сигел, Х., ред. (2002). Ионы металлов в биологических системах: молибден и вольфрам: их роль в биологических процессах . Том. 39. Тейлор и Фрэнсис.
- ^ Клецин, Арнульф; Адамс, Майкл В. (1996). «Вольфрам в биологических системах» . Обзоры микробиологии FEMS . 18 (1): 5–63. дои : 10.1111/j.1574-6976.1996.tb00226.x . ПМИД 8672295 .