Признаки старения
Старение характеризуется прогрессирующей потерей физиологической целостности, что приводит к нарушению функций и повышению уязвимости к смерти. Признаками старения являются типы биохимических изменений, которые происходят во всех организмах, испытывающих биологическое старение , и приводят к прогрессирующей потере физиологической целостности, нарушению функций и, в конечном итоге, к смерти . Впервые они были перечислены в знаковом документе в 2013 году. [ 1 ] концептуализировать сущность биологического старения и лежащие в его основе механизмы.
Были предложены следующие три помещения для взаимосвязанных клеймов: [ 2 ]
- «их возрастное проявление»
- «ускорение старения путем их экспериментального акцентирования»
- «возможность замедлить, остановить или обратить вспять старение путем терапевтического воздействия на них»
Обзор
[ редактировать ]
Со временем почти все живые организмы испытывают постепенное и необратимое старение и связанную с этим утрату надлежащих функций систем организма. Поскольку старение является основным фактором риска развития основных заболеваний человека, включая рак , диабет , сердечно-сосудистые заболевания и нейродегенеративные заболевания , важно описать и классифицировать типы изменений, которые оно влечет за собой.
Спустя десятилетие авторы широко цитируемой оригинальной статьи обновили набор предлагаемых клейм в январе 2023 года. [ 3 ] [ 2 ] В новый платный обзор были добавлены три новых признака (не включенных и не классифицированных ниже): отключенная макроаутофагия , хроническое воспаление и дисбиоз , всего 12 предложенных признаков. [ 2 ]
Девять признаков старения оригинальной бумаги сгруппированы в три категории, как показано ниже: [ 1 ]
Первичные признаки (причины повреждения)
- Нестабильность генома
- Укорочение теломер (или [ 2 ] истощение теломер)
- Эпигенетические изменения
- Потеря протеостаза
Антагонистические признаки (реакция на повреждение)
- Дерегулированное восприятие питательных веществ
- Митохондриальная дисфункция
- Клеточное старение
Интегративные признаки (виновники фенотипа)
- стволовых клеток Истощение
- Измененная межклеточная связь
Первичные признаки – это основные причины повреждения клеток. Антагонистические признаки — это антагонистические или компенсаторные реакции на проявление первичных признаков. Интегративные признаки являются функциональным результатом двух предыдущих групп признаков, которые приводят к дальнейшему ухудшению эксплуатации, связанному со старением. [ 1 ]
Также предлагаются дополнительные признаки или основные механизмы, которые определяют множество из этих признаков.
Отличительные черты
[ редактировать ]Каждый знак был выбран с учетом следующих критериев: [ 1 ]
- проявляется при нормальном старении;
- экспериментальное увеличение его ускоряет старение;
- экспериментальное внесение в него изменений замедляет нормальный процесс старения и увеличивает продолжительность здоровой жизни.
Этим условиям в разной степени соответствует каждый из этих признаков. Последний критерий отсутствует во многих признаках, поскольку наука еще не нашла реальных способов решения этих проблем в живых организмах.
Нестабильность генома
[ редактировать ]Правильное функционирование генома является одной из важнейших предпосылок бесперебойного функционирования клетки и организма в целом. Изменения в генетическом коде уже давно считаются одним из основных причинных факторов старения. [ 4 ] [ 5 ] У многоклеточных организмов нестабильность генома играет центральную роль в канцерогенезе . [ 6 ] а у людей он также является фактором некоторых нейродегенеративных заболеваний, таких как боковой амиотрофический склероз или нервно-мышечное заболевание миотоническая дистрофия .
Аномальные химические структуры ДНК окислительного формируются главным образом в результате стресса и факторов окружающей среды. [ 7 ] Ряд молекулярных процессов непрерывно работают над устранением этого повреждения . [ 8 ] К сожалению, результаты не идеальны, и поэтому со временем ущерб накапливается. [ 4 ] Несколько обзорных статей показали, что недостаточная репарация ДНК , приводящая к большему накоплению повреждений ДНК , вызывает преждевременное старение ; и что усиленная репарация ДНК способствует увеличению продолжительности жизни. [ 9 ]
Укорочение теломер
[ редактировать ]
Теломеры — это участки повторяющихся нуклеотидных последовательностей, связанных со специализированными белками на концах линейных хромосом . Они защищают концевые области хромосомной ДНК от прогрессирующей деградации и обеспечивают целостность линейных хромосом, не позволяя системам репарации ДНК ошибочно принимать концы цепи ДНК за двухцепочечный разрыв .
Укорочение теломер связано со старением, смертностью и болезнями, связанными со старением . Нормальное старение связано с укорочением теломер как у людей, так и у мышей, а исследования на моделях генетически модифицированных животных предполагают причинно-следственную связь между эрозией теломер и старением. [ 10 ] Леонард Хейфлик продемонстрировал, что нормальная клеток человека популяция эмбриональных делится в культуре клеток от 40 до 60 раз, прежде чем вступить в фазу старения . Каждый раз, когда клетка подвергается митозу , теломеры на концах каждой хромосомы слегка укорачиваются. Деление клеток прекратится, как только теломеры сократятся до критической длины. [ 11 ] Это полезно, когда неконтролируемое размножение клеток необходимо остановить (например, при раке), но вредно, когда нормально функционирующие клетки не могут делиться при необходимости.
Фермент теломераза удлиняет теломеры в гаметах и стволовых клетках . [ 12 ] Дефицит теломеразы у людей связан с рядом возрастных заболеваний, связанных с потерей регенеративной способности тканей. [ 13 ] Также было показано, что преждевременное старение у мышей с дефицитом теломеразы обращается вспять при реактивации теломеразы. [ 14 ] Белковый комплекс шелтерина регулирует активность теломеразы в дополнение к защите теломер от восстановления ДНК у эукариот .
Эпигеномные изменения
[ редактировать ]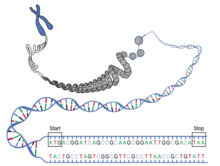
Из всех генов, составляющих геном, экспрессируется в любой момент времени только часть. Функционирование генома зависит как от конкретного порядка его нуклеотидов (геномные факторы), так и от того, какие участки цепи ДНК намотаны на гистоны и, таким образом, становятся недоступными, а какие размотаны и доступны для транскрипции ( эпигенные факторы). ). В зависимости от потребностей конкретного типа ткани и окружающей среды, в которой находится данная клетка, гистоны могут быть модифицированы для включения или выключения определенных генов по мере необходимости. [ 15 ] Профиль того, где, когда и в какой степени происходят эти модификации (эпигенетический профиль) меняется с возрастом, отключая полезные гены и включая ненужные, нарушая нормальное функционирование клетки. [ 16 ]
Например, сиртуины представляют собой тип белковых деацетилаз , которые способствуют связыванию ДНК с гистонами и, таким образом, отключают ненужные гены. [ 17 ] Эти ферменты используют НАД в качестве кофактора . С возрастом уровень НАД в клетках снижается, а вместе с ним и способность сиртуинов отключать ненужные гены в нужный момент. Снижение активности сиртуинов связано с ускоренным старением, а повышение их активности предотвращает некоторые возрастные заболевания. [ 18 ] [ 19 ]
Потеря протеостаза
[ редактировать ]Протеостаз – это гомеостатический процесс поддержания всех белков, необходимых для функционирования клетки, в их правильной форме, структуре и количестве. [ 20 ] Неправильное сворачивание белков, окисление, аномальное расщепление или нежелательная посттрансляционная модификация могут привести к созданию дисфункциональных или даже токсичных белков или белковых агрегатов, которые препятствуют нормальному функционированию клетки. [ 21 ] Хотя эти белки постоянно удаляются и перерабатываются, образование поврежденных или агрегированных белков увеличивается с возрастом, что приводит к постепенной утрате протеостаза. [ 22 ] Это можно замедлить или подавить ограничением калорий. [ 23 ] или путем введения рапамицина , оба путем ингибирования пути mTOR . [ 24 ]
Дерегулированное восприятие питательных веществ
[ редактировать ]Чувствительность к питательным веществам — это способность клетки распознавать и реагировать на изменения концентрации макронутриентов, таких как глюкоза , жирные кислоты и аминокислоты . Во времена изобилия анаболизм индуцируется различными путями , наиболее хорошо изученным из них является путь mTOR . [ 25 ] Когда энергии и питательных веществ не хватает, рецептор AMPK чувствует это и отключает mTOR для экономии ресурсов. [ 26 ]
В растущем организме важны рост и пролиферация клеток, и, таким образом, mTOR активируется . В зрелом организме количество сигналов, активирующих mTOR, естественным образом снижается с возрастом. [ 27 ] Было обнаружено, что насильственная чрезмерная активация этих путей у взрослых мышей приводит к ускорению старения и увеличению заболеваемости раком. [ 28 ] методы ингибирования mTOR, такие как диетическое ограничение или введение рапамицина, являются одним из наиболее надежных методов увеличения продолжительности жизни червей, мух и мышей. Было показано, что [ 29 ] [ 30 ]
Митохондриальная дисфункция
[ редактировать ]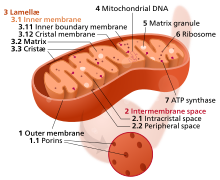
Митохондрия – это электростанция клетки. Различные клетки человека содержат от нескольких до 2500 митохондрий, [ 31 ] каждый из них преобразует углерод (в форме ацетил-КоА ) и кислород в энергию (в форме АТФ ) и углекислый газ .
С возрастом эффективность митохондрий имеет тенденцию к снижению. Причины этого до сих пор совершенно неясны, но предполагается несколько механизмов: снижение биогенеза , [ 32 ] накопление повреждений и мутаций в митохондриальной ДНК , окисление митохондриальных белков и дефектный контроль качества с помощью митофагии . [ 33 ]
Дисфункциональные митохондрии способствуют старению, нарушая внутриклеточную передачу сигналов. [ 34 ] [ 35 ] и вызывают воспалительные реакции. [ 36 ]
Клеточное старение
[ редактировать ]При определенных условиях клетка выходит из клеточного цикла , не умирая, а переходит в состояние покоя и прекращает свою нормальную функцию. Это называется клеточным старением. Старение может быть вызвано несколькими факторами, включая укорочение теломер, [ 37 ] повреждение ДНК [ 38 ] и стресс. Поскольку иммунная система запрограммирована на поиск и уничтожение стареющих клеток, [ 39 ] возможно, старение — это один из способов организма избавиться от клеток, поврежденных и не подлежащих восстановлению.
Связей между старением клеток и старением несколько:
- Доля стареющих клеток увеличивается с возрастом. [ 40 ]
- Стареющие клетки выделяют маркеры воспаления , которые могут способствовать старению. [ 41 ]
- Было обнаружено, что удаление стареющих клеток задерживает возникновение возрастных нарушений. [ 42 ]
Истощение стволовых клеток
[ редактировать ]Стволовые клетки — это недифференцированные или частично дифференцированные клетки, обладающие уникальной способностью самообновляться и дифференцироваться в специализированные типы клеток. В первые несколько дней после оплодотворения эмбрион почти полностью состоит из стволовых клеток. По мере роста плода клетки размножаются, дифференцируются и принимают на себя соответствующие функции в организме. У взрослых стволовые клетки в основном расположены в областях, которые подвергаются постепенному изнашиванию ( кишечник , легкие , слизистая оболочка , кожа ) или нуждаются в постоянном пополнении ( эритроциты , иммунные клетки , сперматозоиды , волосяные фолликулы ).
Потеря регенеративной способности является одним из наиболее очевидных последствий старения. Во многом это связано с тем, что доля стволовых клеток и скорость их деления со временем постепенно снижаются. [ 43 ] Было обнаружено, что омоложение стволовыми клетками может обратить вспять некоторые последствия старения на уровне организма. [ 44 ]
Измененная межклеточная связь
[ редактировать ]Различные ткани и клетки, из которых они состоят, должны четко организовать свою работу, чтобы организм в целом мог функционировать. Один из основных способов достижения этого — выделение сигнальных молекул в кровь, откуда они попадают в другие ткани, влияя на их поведение. [ 45 ] [ 46 ] Профиль этих молекул меняется с возрастом.
Одним из наиболее заметных изменений клеточных сигнальных биомаркеров является « воспаление », развитие хронического вялотекущего воспаления по всему организму с возрастом. [ 47 ] организма Обычная роль воспаления заключается в задействовании иммунной системы и механизмов восстановления в конкретной поврежденной области до тех пор, пока существует повреждение и угроза. Постоянное присутствие маркеров воспаления по всему организму изнашивает иммунную систему и повреждает здоровые ткани. [ 48 ]
Также было обнаружено, что стареющие клетки выделяют определенный набор молекул, называемый SASP (секреторный фенотип, связанный со старением), которые вызывают старение соседних клеток. [ 49 ] И наоборот, манипуляции, продлевающие продолжительность жизни, направленные на одну ткань, могут замедлить процесс старения и в других тканях. [ 50 ]
Дополнительные отличительные черты
[ редактировать ]Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( март 2023 г. ) |
Они могут представлять собой дополнительные признаки или основополагающие механизмы, которые определяют множество этих признаков.
- Возрождение эндогенных ретровирусов может быть «признаком и движущей силой клеточного старения и старения тканей», поскольку ретровирусы в геномах человека могут пробуждаться из спящих состояний и способствовать старению, которое можно блокировать нейтрализующими антителами . [ 51 ] [ 52 ]
Альтернативные концептуальные модели
[ редактировать ]
В 2014 году другие ученые разработали несколько иную концептуальную модель старения, получившую название «Семь столпов старения», в которую включены только три «признака старения» (стволовые клетки и регенерация, протеостаз, эпигенетика). [ 53 ] Модель семи столпов подчеркивает взаимосвязь между всеми семью столпами, которая не подчеркивается в девяти признаках модели старения. [ 54 ]
Связи с другими заболеваниями или признаками
[ редактировать ]Авторы оригинальной статьи объединили или связали различные признаки рака с признаками старения. [ 55 ]
Авторы также пришли к выводу, что признаки связаны не только между собой, но и «с недавно предложенными признаками здоровья , которые включают организационные особенности пространственной компартментализации, поддержание гомеостаза и адекватные реакции на стресс». [ 2 ] [ 56 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д Лопес-Отин, Карлос; Бласко, Мария А.; Партридж, Линда; Серрано, Мануэль; Кремер, Гвидо (6 июня 2013 г.). «Признаки старения» . Клетка . 153 (6): 1194–1217. дои : 10.1016/j.cell.2013.05.039 . ISSN 0092-8674 . ПМЦ 3836174 . ПМИД 23746838 .
- ^ Jump up to: а б с д и Лопес-Отин, Карлос; Бласко, Мария А.; Партридж, Линда; СЕРРАНО, Маноэль; Кремер, Гвидо (19 января 2023 г.). «Следы старения: расширяющаяся Вселенная» . Клетка . 186 (2): 243–278. дои : 10.1016/j.cell.2022.11.001 . ISSN 0092-8674 . ПМИД 36599349 . S2CID 255394876 . Архивировано из оригинала 17 февраля 2023 года . Проверено 17 февраля 2023 г.
- ^ «Новое исследование тщательно изучает 12 отличительных признаков старения» . Новости-Medical.net . 5 января 2023 года. Архивировано из оригинала 17 февраля 2023 года . Проверено 17 февраля 2023 г.
- ^ Jump up to: а б Вийг, Ян; Су, Юсин (10 февраля 2013 г.). «Нестабильность генома и старение» . Ежегодный обзор физиологии . 75 (1): 645–668. doi : 10.1146/annurev-psyol-030212-183715 . ISSN 0066-4278 . ПМИД 23398157 .
- ^ Москалев Алексей; Шапошников Михаил; Плюснина, Екатерина; Жаворонков, Алексей; Будовский, Арье; Янаи, Хагай; Фрайфельд, Вадим (март 2013 г.). «Роль повреждения и восстановления ДНК в старении через призму критериев Коха». Обзоры исследований старения . 12 (2): 661–684. дои : 10.1016/J.arr.2012.02.001 . ПМИД 22353384 . S2CID 26339878 .
- ^ Шмитт, Майкл В.; Приндл, Марк Дж.; Леб, Лоуренс А. (6 сентября 2012 г.). «Последствия генетической гетерогенности при раке: Шмитт и др.» . Анналы Нью-Йоркской академии наук . 1267 (1): 110–116. дои : 10.1111/j.1749-6632.2012.06590.x . ПМЦ 3674777 . ПМИД 22954224 .
- ^ Де Бонт, Р. (1 мая 2004 г.). «Эндогенные повреждения ДНК у человека: обзор количественных данных» . Мутагенез . 19 (3): 169–185. дои : 10.1093/mutage/geh025 . ISSN 1464-3804 . ПМИД 15123782 .
- ^ де Дюв, Кристиан (9 февраля 2005 г.). «Начало отбора» . Природа . 433 (7026): 581–582. Бибкод : 2005Natur.433..581D . дои : 10.1038/433581a . ISSN 0028-0836 . ПМИД 15703726 . S2CID 4355530 .
- ^ Хоймейкерс, Ян Х.Дж. (08 октября 2009 г.). «Повреждение ДНК, старение и рак» . Медицинский журнал Новой Англии . 361 (15): 1475–1485. дои : 10.1056/NEJMra0804615 . ISSN 0028-4793 . ПМИД 19812404 .
- ^ Чакраварти, Дипавали; ЛаБелла, Кайл А.; ДеПиньо, Рональд А. (14 января 2021 г.). «Теломеры: история, здоровье и признаки старения» . Клетка . 184 (2): 306–322. дои : 10.1016/j.cell.2020.12.028 . ПМК 8081271 . ПМИД 33450206 . S2CID 231607042 .
- ^ Хейфлик, Л.; Мурхед, PS (15 мая 1961 г.). «Серийное культивирование штаммов диплоидных клеток человека» . Экспериментальные исследования клеток . 25 (3): 585–621. дои : 10.1016/0014-4827(61)90192-6 . ПМИД 13905658 .
- ^ Бласко, Мария А. (1 августа 2005 г.). «Теломеры и болезни человека: старение, рак и не только» . Обзоры природы Генетика . 6 (8): 611–622. дои : 10.1038/nrg1656 . ISSN 1471-0064 . ПМИД 16136653 . S2CID 14828121 .
- ^ Арманиос, Мэри; Олдер, Джонатан К.; Парри, Эрин М.; Карим, Бактиар; Стронг, Маргарет А.; Грейдер, Кэрол В. (25 ноября 2009 г.). «Коротких теломер достаточно, чтобы вызвать дегенеративные дефекты, связанные со старением» . Американский журнал генетики человека . 85 (6): 823–832. дои : 10.1016/j.ajhg.2009.10.028 . ПМК 2790562 . ПМИД 19944403 .
- ^ Яскелев, Мариэла; Мюллер, Флориан Л.; Пайк, Джи-Хе; Томас, Эмили; Цзян, Шан; Адамс, Эндрю С.; Шахин, Эргун; Кост-Алимова Мария; Протопопов Алексей; Кадиньянос, Хуан; Хорнер, Джеймс В. (28 ноября 2010 г.). «Реактивация теломеразы обращает вспять дегенерацию тканей у старых мышей с дефицитом теломеразы» . Природа . 469 (7328): 102–106. дои : 10.1038/nature09603 . ISSN 1476-4687 . ПМК 3057569 . ПМИД 21113150 .
- ^ Кузаридес, Тони (23 февраля 2007 г.). «Модификации хроматина и их функции» . Клетка . 128 (4): 693–705. дои : 10.1016/j.cell.2007.02.005 . ISSN 0092-8674 . ПМИД 17320507 . S2CID 11691263 .
- ^ Сиаметис, Афанасий; Ниотис, Джордж; Гаринис, Джордж А. (01 апреля 2021 г.). «Повреждение ДНК и стареющий эпигеном» . Журнал исследовательской дерматологии . 141 (4): 961–967. дои : 10.1016/j.jid.2020.10.006 . ISSN 0022-202X . ПМИД 33494932 . S2CID 231711205 .
- ^ Гуаренте, Л. (1 января 2011 г.). «Сиртуины, старение и обмен веществ» . Симпозиумы Колд-Спринг-Харбор по количественной биологии . 76 : 81–90. дои : 10.1101/sqb.2011.76.010629 . ISSN 0091-7451 . ПМИД 22114328 .
- ^ Хейгис, Марсия К.; Синклер, Дэвид А. (1 января 2010 г.). «Сиртуины млекопитающих: биологические данные и актуальность болезней» . Ежегодный обзор патологии: механизмы заболевания . 5 (1): 253–295. doi : 10.1146/annurev.pathol.4.110807.092250 . ISSN 1553-4006 . ПМК 2866163 . ПМИД 20078221 .
- ^ Коваррубиас, Энтони Дж.; Перроне, Розальба; Грозио, Алессия; Вердин, Эрик (22 декабря 2020 г.). «Метаболизм НАД+ и его роль в клеточных процессах при старении» . Nature Reviews Молекулярно-клеточная биология . 22 (2): 119–141. дои : 10.1038/s41580-020-00313-x . ПМЦ 7963035 . ПМИД 33353981 .
- ^ Оттенс, Франциска; Франц, Андре; Хоппе, Торстен (4 февраля 2021 г.). «Наращивание и разрушение: влияние метаболизма на протеостаз и старение» . Смерть клеток и дифференциация . 28 (2): 505–521. дои : 10.1038/s41418-020-00682-y . ISSN 1476-5403 . ПМЦ 7862225 . ПМИД 33398091 .
- ^ Кирана, АН; Прафиантини, Э.; Хардиани, Н.С. (22 февраля 2021 г.). «Потребление белка и потеря протеостаза у пожилых людей [так в оригинале]» . Украинский биохимический журнал . 93 (1): 30–39. дои : 10.15407/ubj93.01.030 .
- ^ Клайпс, Кортни Л.; Джаярадж, Гопал Гунанатхан; Хартл, Ф. Ульрих (10 ноября 2017 г.). «Пути клеточного протеостаза при старении и заболеваниях» . Журнал клеточной биологии . 217 (1): 51–63. дои : 10.1083/jcb.201709072 . ISSN 0021-9525 . ПМЦ 5748993 . ПМИД 29127110 .
- ^ Ян, Линг; Ликастро, Данило; Кава, Эдда; Веронезе, Никола; Спелта, Франческо; Рицца, Ванда; Бертоцци, Беатрис; Вильярреал, DT; Хотамислигил, Г.С.; Холлоши, Дж. О.; Фонтана, Луиджи (07 января 2016 г.). «Долгосрочное ограничение калорий усиливает процессы контроля качества клеток в скелетных мышцах человека» . Отчеты по ячейкам . 14 (3): 422–428. дои : 10.1016/j.celrep.2015.12.042 . hdl : 10447/462955 . ПМИД 26774472 . S2CID 18786539 .
- ^ Благосклонный, Михаил В. (15 декабря 2013 г.). «Старение не запрограммировано» . Клеточный цикл . 12 (24): 3736–3742. дои : 10.4161/cc.27188 . ISSN 1538-4101 . ПМК 3905065 . ПМИД 24240128 .
- ^ Лаплант, Матье; Сабатини, DM (13 апреля 2012 г.). «Сигнализация mTOR в контроле роста и заболеваниях» . Клетка . 149 (2): 274–293. дои : 10.1016/j.cell.2012.03.017 . ПМЦ 3331679 . ПМИД 22500797 .
- ^ Алерс, С.; Лоффлер, А.С.; Вессельборг, С.; Сторк, Б. (1 января 2012 г.). «Роль AMPK-mTOR-Ulk1/2 в регуляции аутофагии: перекрестные помехи, ярлыки и обратная связь» . Молекулярная и клеточная биология . 32 (1): 2–11. дои : 10.1128/MCB.06159-11 . ISSN 0270-7306 . ПМК 3255710 . ПМИД 22025673 .
- ^ Шумахер, Бьёрн; ван дер Плюйм, Ингрид; Мурхаус, Майкл Дж.; Костеас, Теодор; Робинсон, Андрия Расиле; Эх, Юсин; Брейт, Тимо М.; ван Стиг, Гарри; Нидернхофер, Лаура Дж.; ван Эйкен, Уилфред; Бартке, Анджей (15 августа 2008 г.). Ким, Стюарт К. (ред.). «Отсроченное и ускоренное старение имеют общие механизмы обеспечения долголетия» . ПЛОС Генетика . 4 (8): e1000161. дои : 10.1371/journal.pgen.1000161 . ISSN 1553-7404 . ПМК 2493043 . ПМИД 18704162 .
- ^ Пападополи, Дэвид; Буле, Карин; Казак, Лоуренс; Поллак, Майкл; Маллетт, Фредерик; Тописирович, Иван; Хулеа, Лаура (2 июля 2019 г.). «mTOR как центральный регулятор продолжительности жизни и старения» . F1000Исследования . 8 : 998. дои : 10.12688/f1000research.17196.1 . ISSN 2046-1402 . ПМК 6611156 . ПМИД 31316753 .
- ^ Фонтана, Л.; Партридж, Л.; Лонго, В.Д. (16 апреля 2010 г.). «Продление здоровой жизни – от дрожжей к людям» . Наука . 328 (5976): 321–326. Бибкод : 2010Sci...328..321F . дои : 10.1126/science.1172539 . ISSN 0036-8075 . ПМЦ 3607354 . ПМИД 20395504 .
- ^ Харрисон, Дэвид Э.; Сильный, Рэнди; Шарп, Зелтон Дэйв; Нельсон, Джеймс Ф.; Астл, Клинтон М.; Фларки, Кевин; Надон, Нэнси Л.; Уилкинсон, Дж. Эрби; Френкель, Кристина; Картер, Кристи С.; Пахор, Марко (16 июля 2009 г.). «Рапамицин, вводимый в позднем возрасте, продлевает продолжительность жизни генетически гетерогенных мышей» . Природа . 460 (7253): 392–395. Бибкод : 2009Natur.460..392H . дои : 10.1038/nature08221 . ISSN 0028-0836 . ПМК 2786175 . ПМИД 19587680 .
- ^ "Строение клетки" [Scientific Digital Library: Cell structure]. Научная электронная библиотека (in Russian) . Retrieved 23 March 2023 .
- ^ Шахин, Эргюн; ДеПиньо, Рональд А. (июнь 2012 г.). «Ось старения: теломеры, р53 и митохондрии» . Nature Reviews Молекулярно-клеточная биология . 13 (6): 397–404. дои : 10.1038/nrm3352 . ISSN 1471-0072 . ПМЦ 3718675 . ПМИД 22588366 .
- ^ Ван, Кэ; Клионски, Дэниел Дж (март 2011 г.). «Удаление митохондрий методом аутофагии» . Аутофагия . 7 (3): 297–300. дои : 10.4161/auto.7.3.14502 . ISSN 1554-8627 . ПМЦ 3359476 . ПМИД 21252623 .
- ^ Кремер, Гвидо; Галлуцци, Лоренцо; Бреннер, Кэтрин (январь 2007 г.). «Пермеабилизация митохондриальных мембран при гибели клеток» . Физиологические обзоры . 87 (1): 99–163. doi : 10.1152/physrev.00013.2006 . ISSN 0031-9333 . ПМИД 17237344 .
- ^ Рафаэлло, Анна; Риццуто, Розарий (январь 2011 г.). «Пути митохондриального долголетия» . Биохимия и биофизика Acta (BBA) - Исследования молекулярных клеток . 1813 (1): 260–268. дои : 10.1016/j.bbamcr.2010.10.007 . ПМИД 20950653 .
- ^ Грин, Дуглас Р.; Галлуцци, Лоренцо; Кремер, Гвидо (26 августа 2011 г.). «Митохондрии и ось аутофагия-воспаление-смерть клеток при старении организма» . Наука . 333 (6046): 1109–1112. Бибкод : 2011Sci...333.1109G . дои : 10.1126/science.1201940 . ISSN 0036-8075 . ПМК 3405151 . ПМИД 21868666 .
- ^ Боднар, Андреа Г.; Уэллетт, Мишель; Фролкис, Мария; Холт, Шон Э.; Чиу, Чой-Пик; Морин, Грегг Б.; Харли, Кэлвин Б.; Шей, Джерри В.; Лихтштейнер, Серж; Райт, Вудринг Э. (16 января 1998 г.). «Продление продолжительности жизни путем введения теломеразы в нормальные клетки человека» . Наука . 279 (5349): 349–352. Бибкод : 1998Sci...279..349B . дои : 10.1126/science.279.5349.349 . ISSN 0036-8075 . ПМИД 9454332 .
- ^ Кольядо, Мануэль; Бласко, Мария А.; Серрано, Мануэль (27 июля 2007 г.). «Клеточное старение при раке и старении» . Клетка . 130 (2): 223–233. дои : 10.1016/j.cell.2007.07.003 . ISSN 0092-8674 . ПМИД 17662938 . S2CID 18689141 .
- ^ Сагив, Ади; Крижановский, Валерий (01 декабря 2013 г.). «Иммунонадзор за стареющими клетками: светлая сторона программы старения». Биогеронтология . 14 (6): 617–628. дои : 10.1007/s10522-013-9473-0 . ISSN 1573-6768 . ПМИД 24114507 . S2CID 2775067 .
- ^ Ван, Чуньфан; Юрк, Диана; Мэддик, Мэнди; Нельсон, Глин; Мартин-Руис, Кармен; Зглиницкий, Томас Фон (2009). «Реакция на повреждение ДНК и клеточное старение в тканях стареющих мышей» . Стареющая клетка . 8 (3): 311–323. дои : 10.1111/j.1474-9726.2009.00481.x . ISSN 1474-9726 . ПМИД 19627270 . S2CID 9192359 .
- ^ Малакин, Николас; Мартинес, Орели; Родье, Фрэнсис (01 сентября 2016 г.). «Держать секретом старения под контролем: молекулярные рычаги секреторного фенотипа, связанного со старением». Экспериментальная геронтология . 82 : 39–49. дои : 10.1016/j.exger.2016.05.010 . ISSN 0531-5565 . ПМИД 27235851 . S2CID 207584394 .
- ^ Бейкер, Даррен Дж.; Виджшейк, Тобиас; Чкония, Тамар; ЛеБрассер, Натан К.; Чайлдс, Беннетт Г.; ван де Слейс, Барт; Киркланд, Джеймс Л.; ван Дёрсен, Ян М. (2 ноября 2011 г.). «Очистка p16 Ink4a-положительных стареющих клеток замедляет нарушения, связанные со старением» . Природа . 479 (7372): 232–236. Бибкод : 2011Natur.479..232B . дои : 10.1038/nature10600 . ISSN 1476-4687 . ПМЦ 3468323 . ПМИД 22048312 .
- ^ Беренс, Аксель; ван Дёрсен, Ян М.; Рудольф, К. Ленхард; Шумахер, Бьёрн (март 2014 г.). «Влияние геномного повреждения и старения на функцию стволовых клеток» . Природная клеточная биология . 16 (3): 201–207. дои : 10.1038/ncb2928 . ISSN 1476-4679 . ПМК 4214082 . ПМИД 24576896 .
- ^ Рандо, штат Калифорния; Чанг, Хай (20 января 2012 г.). «Старение, омоложение и эпигенетическое перепрограммирование: сброс часов старения» . Клетка . 148 (1–2): 46–57. дои : 10.1016/j.cell.2012.01.003 . ISSN 0092-8674 . ПМК 3336960 . ПМИД 22265401 .
- ^ Вильеда, Саул А.; Ло, Цзянь; Мошер, Кира И.; Цзоу, Бенде; Бричги, Маркус; и др. (31 августа 2011 г.). «Старение системной среды негативно регулирует нейрогенез и когнитивные функции» . Природа . 477 (7362): 90–94. Бибкод : 2011Природа.477...90В . дои : 10.1038/nature10357 . ПМК 3170097 . ПМИД 21886162 .
- ^ Лоффредо, Франческо С.; Штайнхаузер, Мэтью Л.; Джей, Стивен М.; Ганнон, Джозеф; Панкост, Джеймс Р.; и др. (9 мая 2013 г.). «Фактор дифференциации роста 11 — это фактор циркуляции, который обращает вспять возрастную гипертрофию сердца» . Клетка . 153 (4): 828–39. дои : 10.1016/j.cell.2013.04.015 . ПМЦ 3677132 . ПМИД 23663781 .
- ^ Панда, Александр; Архона, Альваро; Сапей, Элизабет; Бай, Фэнвэй; Фикриг, Эрол; Монтгомери, Рут Р.; Лорд, Джанет М.; Шоу, Альберт К. (22 июня 2009 г.). «Врожденное иммуностарение человека: причины и последствия для иммунитета в пожилом возрасте» . Тенденции в иммунологии . 30 (7): 325–333. дои : 10.1016/j.it.2009.05.004 . ISSN 1471-4906 . ПМК 4067971 . ПМИД 19541535 .
- ^ Франчески, Клаудио; Бонафе, Массимилиано; Валенсен, Сильвана; Оливьери, Фабиола; Лука, Мария Де; Оттавиани, Энцо; Бенедиктис, Джованна Де (2000). «Воспаление старения: эволюционный взгляд на иммуностарение». Анналы Нью-Йоркской академии наук . 908 (1): 244–254. Бибкод : 2000NYASA.908..244F . дои : 10.1111/j.1749-6632.2000.tb06651.x . ISSN 1749-6632 . ПМИД 10911963 . S2CID 1843716 .
- ^ Нельсон, Глин; Вордсворт, Джеймс; Ван, Чуньфан; Юрк, Диана; Лоулесс, Конор; Мартин-Руис, Кармен; Зглиницкий, Томас фон (2012). «Эффект свидетеля стареющих клеток: старение, вызванное старением» . Стареющая клетка . 11 (2): 345–349. дои : 10.1111/j.1474-9726.2012.00795.x . ISSN 1474-9726 . ПМЦ 3488292 . ПМИД 22321662 .
- ^ Лавасани, Митра; Робинсон, Андрия Р.; Лу, Айпин; Сон, Минджунг; Федуска, Джозеф М.; Ахани, Бахар; Тилстра, Джереми С.; Фельдман, Челси Х.; Роббинс, Пол Д.; Нидернхофер, Лаура Дж.; Хуард, Джонни (3 января 2012 г.). «Дисфункция стволовых клеток/клеток-предшественников мышечного происхождения ограничивает продолжительность здоровья и продолжительность жизни на мышиной модели прогерии» . Природные коммуникации . 3 (1): 608. Бибкод : 2012NatCo...3..608L . дои : 10.1038/ncomms1611 . ISSN 2041-1723 . ПМЦ 3272577 . ПМИД 22215083 .
- ^ «Старение и ретровирусы» . Наука . 23 января 2023 года. Архивировано из оригинала 17 февраля 2023 года . Проверено 17 февраля 2023 г.
- ^ Лю, Цзюньпэн; Жэнь, Цзе; Сунь, Лян, Ган; Чжан, Цзи, Цяньчжао; Цяорань, Чжэцзюнь; Ли, Эстебан, Консепсьон Родригес; Цай, Юшэн; Чжэн, Юн Э.; , Моши; Тан, Фучоу; Чжоу, Ци; Бельмонте, Чжан, Цюй; Лю, Гуан-Хуэй (19 января 2023 г.) . старение усиливает старение» . Cell . 186 (2): 287–304.e26. : 10.1016 /j.cell.2022.12.017 . ISSN 0092-8674 . PMID 36610399. . S2CID 232060038 doi
- ^ Кеннеди, Брайан; Бергер, Шелли (6 ноября 2014 г.). «Геронаука: связь старения с хроническими заболеваниями» . Клетка . 159 (4): 709–713. дои : 10.1016/j.cell.2014.10.039 . ISSN 1097-4172 . ПМЦ 4852871 . ПМИД 25417146 .
- ^ Джемс, Дэвид; де Магальяйнс, Жоау Педро (13 июля 2021 г.). «Муха-журчалка и оса: критика признаков старения как парадигмы» . Обзоры исследований старения . 70 : 101407. doi : 10.1016/j.arr.2021.101407 . ISSN 1568-1637 . ПМЦ 7611451 . ПМИД 34271186 .
- ^ Лопес-Отин, Чарльз; Пьетрокола, Фредерик; Ройз-Вэлли, Дэвид; Галлуцци, Лоренцо; Кремер, Гвидо (3 января 2023 г.). «Метапризнаки старения и рака » Клеточный метаболизм . 35 (1): 12–3 дои : 10.1016/j.cmet.2022.11.001 . ISSN 1550-4131 . ПМИД 36599298 . S2CID 255465457 . Архивировано 17 февраля. из оригинала Получено 17 февраля.
- ^ Лопес-Отин, Карлос; Кремер, Гвидо (7 января 2021 г.). «Признаки здоровья» . Клетка . 184 (1): 33–63. дои : 10.1016/j.cell.2020.11.034 . ISSN 0092-8674 . ПМИД 33340459 . S2CID 229321394 .