Фикоцианин
| Белок фикобилисомы | |||
|---|---|---|---|
 Аллофикоцианин 12-мер PDB 1all | |||
| Идентификаторы | |||
| Символ | Фикобилисома | ||
| Пфам | PF00502 | ||
| ИнтерПро | ИПР001659 | ||
| СКОП2 | 1cpc / ОБЪЕМ / СУПФАМ | ||
| |||

Фикоцианин представляет собой пигмент -белковый комплекс из семейства светособирающих фикобилипротеинов , наряду с аллофикоцианином и фикоэритрином . [1] Это дополнительный хлорофилла . пигмент Все фикобилипротеины водорастворимы, поэтому они не могут существовать внутри мембраны, как каротиноиды . Вместо этого фикобилипротеины агрегируют, образуя кластеры, которые прикрепляются к мембране и называются фикобилисомами . Фикоцианин имеет характерный светло-синий цвет, поглощает оранжевый и красный свет, особенно 620 нм (в зависимости от конкретного типа), и излучает флуоресценцию при длине волны около 650 нм (также в зависимости от типа). Аллофикоцианин поглощает и излучает волны с большей длиной волны, чем фикоцианин C или фикоцианин R. Фикоцианины обнаружены в цианобактериях (также называемых сине-зелеными водорослями ). [2] Фикобилипротеины обладают флуоресцентными свойствами, которые используются в наборах для иммуноанализа . Фикоцианин происходит от греческого phyco, означающего « водоросли », а цианин — от английского слова « cyan », которое условно означает оттенок сине-зеленого (близкий к «аква») и происходит от греческого « kyanos », что означает несколько другой цвет: «темно-синий». Продукт фикоцианин, производимый компаниями Aphanizomenon flos-aquae и Spirulina , используется, например, в пищевой промышленности и производстве напитков в качестве натурального красителя «Lina Blue» или «EXBERRY Shade Blue» и содержится в сладостях и мороженом. Кроме того, флуоресцентное обнаружение фикоцианиновых пигментов в пробах воды является полезным методом мониторинга биомассы цианобактерий. [3]
Фикобилипротеины состоят из двух субъединиц (альфа и бета), имеющих белковый остов, с которым ковалентно связаны 1–2 линейных тетрапиррольных хромофора.
C-фикоцианин часто встречается в цианобактериях, которые процветают вокруг горячих источников, поскольку он может быть стабильным примерно до 70 ° C, с идентичным спектроскопическим (светопоглощающим) поведением при 20 и 70 ° C. Термофилы содержат несколько разные аминокислотные последовательности, что делает их стабильными в этих более высоких условиях. Молекулярная масса составляет около 30 000 Да. стабильность этого белка in vitro Показано, что при таких температурах существенно ниже. Фотоспектральный анализ белка после 1-минутной выдержки в условиях 65°С в очищенном состоянии показал 50% потерю третичной структуры.

Структура
[ редактировать ]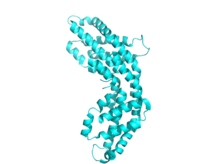
Фикоцианин имеет общую структуру со всеми фикобилипротеинами . [4] Структура начинается со сборки мономеров фикобилипротеинов, которые представляют собой гетеродимеры, состоящие из субъединиц α и β, и их соответствующих хромофоров, связанных тиоэфирной связью.
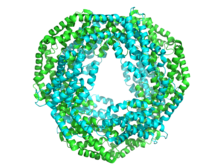
Каждая субъединица обычно состоит из восьми α-спиралей . Мономеры спонтанно агрегируют с образованием кольцевых тримеров (αβ) 3 , которые обладают вращательной симметрией и центральным каналом. Тримеры агрегируют парами с образованием гексамеров (αβ) 6 , иногда с помощью дополнительных линкерных белков. Каждый стержень фикобилисомы обычно содержит два или более гексамера фикоцианина. Несмотря на общее сходство структуры и сборки фикобилипротеинов, существует большое разнообразие конформаций гексамеров и палочек, даже если рассматривать только фикоцианины. В более широком масштабе фикоцианины также различаются по кристаллической структуре , хотя биологическая значимость этого спорна.
Например, структура C-фикоцианина Synechococcus vulcanus была уточнена до разрешения 1,6 Ангстрем . [5] тиосвязанного фикоцианобилина (ПХБ) Мономер (αβ) состоит из 332 аминокислот и 3 молекул кофактора . И α-, и β-субъединицы имеют PCB в положении аминокислоты 84, но β-субъединица также имеет дополнительный PCB в положении 155. Эта дополнительная PCB обращена к внешней стороне тримерного кольца и, следовательно, участвует в переносе энергии между стержнями в комплексе фикобилисом. Помимо кофакторов, существует множество предсказуемых нековалентных взаимодействий с окружающим растворителем (водой), которые, как предполагается, способствуют структурной стабильности.
R-фикоцианин II (R-PC II) обнаружен у некоторых видов Synechococcus . [6] Говорят, что R-PC II является первым PEB, содержащим фикоцианин, происходящий из цианобактерий. [6] Его очищенный белок состоит из альфа- и бета-субъединиц в равных количествах. [6] R-PC II содержит ПХБ в бета-84 и фикоэритробиллин (ПЭБ) в альфа-84 и бета-155. [6]
депонировано 310 кристаллических структур фикоцианина По состоянию на 21 марта 2023 года в Банке данных белков . [7]
Спектральные характеристики
[ редактировать ]C-фикоцианин имеет единственный пик поглощения при ~621 нм. [8] [9] незначительно варьируется в зависимости от организма и условий, таких как температура, pH и концентрация белка in vitro . [10] [11] Максимум его эмиссии составляет ~642 нм. [8] [9] Это означает, что пигмент поглощает оранжевый свет и излучает красноватый свет. R-фикоцианин имеет максимумы поглощения при 533 и 544 нм. [6] Максимум флуоресценции R-фикоцианина составляет 646 нм. [6]
| Свойство | C-фикоцианин | R-фикоцианин |
|---|---|---|
| Максимум поглощения (нм) | 621 | 533, 544 |
| Максимум излучения (нм) | 642 | 646 |
| Коэффициент вымирания (ε) | 1,54x10 6 М −1 см −1 | - |
| Квантовый выход | 0.81 | - |
Экологическая значимость
[ редактировать ]Фикоцианин продуцируется многими фотоавтотрофными цианобактериями. [12] Даже если цианобактерии имеют большие концентрации фикоцианина, продуктивность в океане все равно ограничена из-за условий освещенности. [12]
Фикоцианин имеет экологическое значение, поскольку указывает на цветение цианобактерий. Обычно хлорофилл а используется для обозначения численности цианобактерий, однако, поскольку он присутствует в большом количестве групп фитопланктона, это не идеальный показатель. [13] Например, в исследовании, проведенном в Балтийском море, фикоцианин использовался в качестве маркера нитчатых цианобактерий во время ядовитого летнего цветения. [13] Некоторые нитчатые организмы Балтийского моря включают Nodularia spumigena и Aphanizomenon flosaquae .
Важная цианобактерия спирулина ( Arthrospira Platensis ) представляет собой микроводоросль, продуцирующую C-PC. [14]
Существует множество различных методов производства фикоцианинов, включая фотоавтотрофное, миксотрофное, гетеротрофное и рекомбинантное производство. [15] Фотоавтотрофное производство фикоцианина заключается в выращивании культур цианобактерий в открытых прудах в субтропических или тропических регионах. [15] Миксотрофное производство водорослей – это когда водоросли выращиваются на культурах, содержащих органический источник углерода, такой как глюкоза . [15] Использование миксотрофного производства обеспечивает более высокие темпы роста и более высокую биомассу по сравнению с простым использованием фотоавтотрофной культуры. [15] В миксотрофной культуре сумма гетеротрофного и автотрофного роста по отдельности была равна миксотрофному росту. [16] Согласно его определению, гетеротрофное производство фикоцианина не ограничено светом. [15] Galdieria ulfuraria — одноклеточный родофит , содержащий большое количество C-PC и небольшое количество аллофикоцианина . [15] G. сульфурария является примером гетеротрофного производства C-PC, поскольку его средой обитания являются горячие кислые источники, и для роста он использует ряд источников углерода. [15] Рекомбинантное производство C-PC является еще одним гетеротрофным методом и включает генную инженерию. [15]
Грибы, образующие лишайники, и цианобактерии часто имеют симбиотические отношения, и поэтому фикоцианиновые маркеры можно использовать для демонстрации экологического распределения цианобактерий, связанных с грибами. Как показала высокоспецифичная ассоциация между видами Lichina и штаммами Rivularia , фикоцианин обладает достаточным филогенетическим разрешением, чтобы раскрыть эволюционную историю группы на северо-западной Атлантического океана прибрежной окраине . [17]
Биосинтез
[ редактировать ]Два гена cpcA и cpcB, расположенные в опероне cpc и транслируемые с одного и того же транскрипта мРНК, кодируют α- и β-цепи C-PC соответственно. [18] Дополнительные элементы, такие как линкерные белки и ферменты, участвующие в синтезе фикобилина, а также фикобилипротеины, часто кодируются генами в соседних кластерах генов, а оперон cpc Arthrospira Platensis также кодирует линкерный белок, помогающий в сборке комплексов C-PC. [19] У красных водорослей гены фикобилипротеина и линкерного белка расположены в пластидном геноме. [20]
Фикоцианобилин синтезируется из гема и вставляется в апо-белок C-PC в три ферментативных этапа. [21] Циклический гем окисляется до линейного биливердина IXα под действием гемоксигеназы и далее превращается в 3Z-фикоцианобилин, доминирующий изомер фикоцианобилина, под действием 3Z-фикоцианобилин:ферредоксиноксидоредуктазы. Вставка 3Z-фикоцианобилина в апобелок C-PC посредством образования тиоэфирной связи катализируется фикоцианобилинлиазой. [22]
Промотор оперона cpc расположен в вышерасположенной области гена cpcB длиной 427 п.н. У A.platensis в этом регионе идентифицировано шесть предполагаемых промоторных последовательностей, четыре из которых демонстрируют экспрессию зеленого флуоресцентного белка при трансформации в E.coli . [23] Также было продемонстрировано присутствие других положительных элементов, таких как элементы, реагирующие на свет, в том же регионе. [24]
Множественные последовательности промотора и отвечающего элемента в опероне cpc позволяют цианобактериям и красным водорослям регулировать его экспрессию в ответ на множество условий окружающей среды. Экспрессия генов cpcA и cpcB регулируется светом. Низкая интенсивность света стимулирует синтез ЦПК и других пигментов, тогда как синтез пигментов подавляется при высокой интенсивности света. [25] Также было показано, что температура влияет на синтез: определенные концентрации пигментов демонстрируют явный максимум при 36 ° C у Arthronema africanum, цианобактерии с особенно высоким содержанием C-PC и APC. [26]
Ограничение азота, а также железа вызывает деградацию фикобилипротеинов. Источники органического углерода стимулируют синтез C-PC у Anabaena spp., но, по-видимому, почти не оказывают эффекторного негативного эффекта на A. Platensis . [27] [28] У родофитов Cyanidium Caldarium и Galdieria ulfuraria продукция C-PC подавляется глюкозой, но стимулируется гемом. [29]
Биотехнология
[ редактировать ]Чистые экстракты фикоцианинов можно выделить из водорослей. Основной порядок разделения следующий. Разрыв клеточной стенки под действием механических сил (замораживание-оттаивание) или химических агентов (ферментов). Затем C-PC выделяют центрифугированием и очищают осаждением сульфатом аммония или хроматографией - ионной или гель-фильтрацией . После этого образец замораживают и высушивают . [15]
Приложения
[ редактировать ]Фикоцианин можно использовать во многих практиках, особенно в медицине и пищевых продуктах. Его также можно использовать в генетике, где он действует как индикатор благодаря своей естественной флуоресценции. [30]
Лекарство
[ редактировать ]Этот раздел нуждается в более надежных медицинских справках для проверки или слишком сильно полагается на первоисточники . ( март 2018 г. ) |  |
Антиоксидантное и противовоспалительное действие
[ редактировать ]Фикоцианин обладает как антиоксидантными, так и противовоспалительными свойствами. [31] [32] [33] Пероксильные, гидроксильные и алкоксильные радикалы представляют собой окислители, удаляемые C-PC. C-PC, однако, оказывает большее влияние на пероксильные радикалы. C-PC является металлосвязывающим антиоксидантом, поскольку предотвращает перекисное окисление липидов. [34] Пероксильные радикалы стабилизируются хромофором (субъединицей C-PC). [35] Чтобы удалить гидроксильные радикалы, это необходимо делать при слабом освещении и при высоких уровнях C-PC. [36] Гидроксильные радикалы обнаруживаются в воспаленных частях тела. [34] C-PC, будучи антиоксидантом, удаляет эти вредные радикалы и, следовательно, является противовоспалительным средством.
Нейропротекция
[ редактировать ]Избыток кислорода в мозге генерирует активные формы кислорода (АФК). АФК вызывают повреждение нейронов головного мозга, что приводит к снижению неврологической функции. C-фикоцианин удаляет перекись водорода, разновидность АФК, изнутри астроцитов , уменьшая окислительный стресс. [37] Астроциты также увеличивают выработку факторов роста, таких как BDNF и NDF, тем самым улучшая регенерацию нервов. C-PC также предотвращает астроглиоз и глиальное воспаление. [37] [38]
Гепатопротекция
[ редактировать ]Обнаружено, что C-фикоцианин обладает защитой от гепатотоксичности. [31] [39] Вадираджа и др. (1998) обнаружили увеличение уровня глутамин-пировиноградной трансаминазы в сыворотке крови при обработке C-PC гептатоксинами, такими как четыреххлористый углерод (CCl4) или R-(+)-пулегон. C-PC защищает печень с помощью системы цитохрома-P450 . [39] Он может либо нарушать выработку ментофурана, либо нарушать образование α, β-ненасыщенного γ-кетоальдегида. Оба они являются ключевыми компонентами системы цитохрома P-450, которая производит реактивный метаболит, вырабатывающий токсины при связывании с тканями печени. Другим возможным механизмом защиты с помощью C-PC может быть удаление реактивных метаболитов (или свободных радикалов, если причиной является CCl4).
Противораковый
[ редактировать ]C-фикоцианин (C-PC) обладает противораковым действием. Рак возникает, когда клетки продолжают бесконтрольно расти. Было обнаружено, что C-PC предотвращает рост клеток. [40] C-PC останавливает образование опухоли до S-фазы. Синтез ДНК не осуществляется из-за попадания опухолевой клетки в G0, что приводит к отсутствию пролиферации опухоли. [41] Более того, C-PC индуцирует апоптоз. Когда клетки обрабатываются C-PC, образуются АФК (радикальные формы кислорода). Эти молекулы уменьшают выработку BCl-2 (регулятор апоптоза). Здесь BCl-2 ингибирует белки, называемые каспазами. Каспазы являются частью пути апоптоза. Когда BCl-2 снижается, экспрессия каспаз увеличивается. В результате происходит апоптоз. [42] [41] Одного C-PC недостаточно для лечения рака, необходимы другие лекарства, чтобы преодолеть персистенцию опухолевых клеток.
Еда
[ редактировать ]C-фикоцианин (C-PC) можно использовать в качестве натурального синего пищевого красителя. [43] Этот пищевой краситель можно использовать только для продуктов, приготовленных при низкой температуре, из-за его неспособности сохранять синий цвет при высоких температурах без добавления консервантов или сахара. [43] [44] Тип сахара не имеет значения, C-PC стабилен при высоком содержании сахара. Зная это, C-PC можно использовать для приготовления многих видов продуктов, одним из которых являются сиропы. C-PC можно использовать для сиропов от зеленого до синего цвета. Он может иметь разные зеленые оттенки за счет добавления желтых пищевых красителей.
Ссылки
[ редактировать ]- ^ Глейзер А.Н. (январь 1989 г.). «Световоды. Направленная передача энергии в фотосинтетической антенне» . Журнал биологической химии . 264 (1): 1–4. дои : 10.1016/S0021-9258(17)31212-7 . ПМИД 2491842 .
- ^ Ратха С.К., Прасанна Р. (февраль 2012 г.). «Биоразведка микроводорослей как потенциальный источник «зеленой энергии» — проблемы и перспективы». Прикладная биохимия и микробиология . 48 (2): 109–125. дои : 10.1134/S000368381202010X . ПМИД 22586907 . S2CID 18430041 .
- ^ Бриент Л., Ленгронн М., Бертран Э., Роллан Д., Сипель А., Штайнманн Д., Боден И., Легеас М., Ле Рузик Б., Борманс М. (февраль 2008 г.). «Фикоцианиновый зонд как инструмент мониторинга цианобактерий в пресноводных водоемах». Журнал экологического мониторинга . 10 (2): 248–55. дои : 10.1039/b714238b . ПМИД 18246219 .
- ^ Ван XQ, Ли Л.Н., Чанг В.Р., Чжан Дж.П., Гуй Л.Л., Го Б.Дж., Лян, округ Колумбия (июнь 2001 г.). «Структура C-фикоцианина из Spirulina Platensis с разрешением 2,2 А: новая моноклинная кристаллическая форма фикобилипротеинов в фикобилисомах». Acta Crystallographica Раздел D. 57 (Часть 6): 784–92. Бибкод : 2001AcCrD..57..784W . дои : 10.1107/S0907444901004528 . ПМИД 11375497 .
- ^ Адир Н., Вайнер Р., Лернер Н. (декабрь 2002 г.). «Уточненная структура c-фикоцианина из цианобактерии Synechococcus vulcanus при силе тока 1,6 А: понимание роли молекул растворителя в термической стабильности и структуре кофактора». Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1556 (2–3): 168–74. дои : 10.1016/s0005-2728(02)00359-6 . ПМИД 12460674 .
- ^ Перейти обратно: а б с д и ж Онг Л.Дж., Глейзер А.Н. (май 1987 г.). «R-фикоцианин II, новый фикоцианин, встречающийся в морских видах Synechococcus. Идентификация терминального акцептора энергии билина в фикоцианинах» . Журнал биологической химии . 262 (13): 6323–7. дои : 10.1016/S0021-9258(18)45573-1 . ПМИД 3571260 .
- ^ «Неполимерные объекты» .
- ^ Перейти обратно: а б «С – ПК (С – Фикоцианин)» . АнаСпец.
- ^ Перейти обратно: а б Писарро С.А., Зауэр К. (май 2001 г.). «Спектроскопическое исследование светособирающего белка C-фикоцианина, связанного с бесцветными линкерными пептидами». Фотохимия и фотобиология . 73 (5): 556–63. doi : 10.1562/0031-8655(2001)073<0556:ssotlh>2.0.co;2 (неактивен 6 мая 2024 г.). ПМИД 11367580 . S2CID 101133523 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на май 2024 г. ( ссылка ) - ^ Глейзер А.Н., Фэнг С., Браун Д.М. (август 1973 г.). «Спектроскопические свойства C-фикоцианина и его альфа- и бета-субъединиц» . Журнал биологической химии . 248 (16): 5679–85. дои : 10.1016/S0021-9258(19)43559-X . ПМИД 4198883 .
- ^ Станье Р.Ю., Кунисава Р., Мандель М., Коэн-Базир Г. (июнь 1971 г.). «Очистка и свойства одноклеточных сине-зеленых водорослей (отряда Chroococcales)» . Бактериологические обзоры . 35 (2): 171–205. дои : 10.1128/MMBR.35.2.171-205.1971 . ПМК 378380 . ПМИД 4998365 .
- ^ Перейти обратно: а б Бухвейц М (2016). «Натуральные решения проблемы синего цвета в продуктах питания». В Карле Р., Швайггерте Р.М. (ред.). Справочник по натуральным пигментам в продуктах питания и напитках . стр. 355–384. дои : 10.1016/b978-0-08-100371-8.00017-8 . ISBN 978-0-08-100371-8 .
- ^ Перейти обратно: а б Возняк М., Брадтке К.М., Дарецкий М., Кренжель А. (март 2016 г.). «Эмпирическая модель оценки концентрации фикоцианинов как индикатора цветения цианобактерий в оптически сложных прибрежных водах Балтийского моря» . Дистанционное зондирование . 8 (3): 212. Бибкод : 2016RemS....8..212W . дои : 10.3390/rs8030212 .
- ^ Куддус М., Сингх П., Томас Г. и Аль-Хазими А. (2013). Последние разработки в области производства и биотехнологического применения C-фикоцианина. BioMed Research International, 2013.
- ^ Перейти обратно: а б с д и ж г час я Куддус М., Сингх П., Томас Г., Аль-Хазими А. (2013). «Последние разработки в области производства и биотехнологического применения C-фикоцианина» . БиоМед Исследования Интернэшнл . 2013 : 742859. doi : 10.1155/2013/742859 . ПМК 3770014 . ПМИД 24063013 .
- ^ Маркес Ф.Дж., Сасаки К., Какидзоно Т., Нишио Н., Нагай С. (1993). «Особенности роста Spirulina Platensis в миксотрофных и гетеротрофных условиях». Журнал ферментации и биоинженерии . 76 (5): 408–410. дои : 10.1016/0922-338x(93)90034-6 .
- ^ Ортис-Альварес Р., де Лос-Риос А., Фернандес-Мендоса Ф., Торральба-Бурриаль А., Перес-Ортега С. (16 июля 2015 г.). «Экологическая специализация двух фотобионт-специфичных морских видов цианолишайников рода Lichina» . ПЛОС ОДИН . 10 (7): e0132718. Бибкод : 2015PLoSO..1032718O . дои : 10.1371/journal.pone.0132718 . ПМК 4504470 . ПМИД 26181436 .
- ^ Лю Дж, Чжан X, Суй Z, Чжан X, Мао Y (март 2005 г.). «Клонирование и характеристика оперона c-фикоцианина из цианобактерии Arthrospira Platensis FACHB341». Журнал прикладной психологии . 17 (2): 181–185. Бибкод : 2005JAPco..17..181L . дои : 10.1007/s10811-005-6418-2 . S2CID 548831 .
- ^ Гуань Х, Цинь С., Су З, Чжао Ф, Гэ Б, Ли Ф, Тан Х (июль 2007 г.). «Комбинированный биосинтез флуоресцентного цианобактериального голо-альфа-фикоцианина в Escherichia coli с использованием одного вектора экспрессии». Прикладная биохимия и биотехнология . 142 (1): 52–9. дои : 10.1007/s12010-007-8000-7 . ПМИД 18025568 . S2CID 38038885 .
- ^ Охта Н., Мацузаки М., Мисуми О., Миягишима С.Ю., Нодзаки Х., Танака К., Шин-И Т., Кохара Ю., Куроива Т. (апрель 2003 г.). «Полное секвенирование и анализ пластидного генома одноклеточной красной водоросли Cyanidioschyzon merolae» . Исследование ДНК . 10 (2): 67–77. дои : 10.1093/dnares/10.2.67 . ПМИД 12755171 .
- ^ Тули А.Дж., Цай Я.А., Глейзер А.Н. (сентябрь 2001 г.). «Биосинтез флуоресцентной цианобактериальной голо-альфа-субъединицы C-фикоцианина в гетерологичном хозяине» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (19): 10560–5. Бибкод : 2001PNAS...9810560T . дои : 10.1073/pnas.181340998 . ПМК 58505 . ПМИД 11553806 .
- ^ Эриксен Н.Т. (август 2008 г.). «Производство фикоцианина - пигмента, применимого в биологии, биотехнологии, пищевых продуктах и медицине». Прикладная микробиология и биотехнология . 80 (1): 1–14. дои : 10.1007/s00253-008-1542-y . ПМИД 18563408 . S2CID 9638809 .
- ^ Го Н, Чжан Х, Лу Ю, Сун Х (март 2007 г.). «Анализ факторов, влияющих на интенсивность запуска в восходящей последовательности гена бета-субъединицы фикоцианина из Arthrospira Platensis, методом сайт-направленного мутагенеза». Биотехнологические письма . 29 (3): 459–64. дои : 10.1007/s10529-006-9266-5 . ПМИД 17242853 . S2CID 23575772 .
- ^ Лу И, Чжан Икс (15 апреля 2005 г.). «Вышестоящая последовательность гена β-субъединицы фикоцианина Arthrospira Platensis регулирует экспрессию гена gfp в ответ на интенсивность света» . Электронный журнал биотехнологии . 8 (1). doi : 10.2225/vol8-issue1-fulltext-9 (неактивен 24 апреля 2024 г.). hdl : 1807/5704 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ Слот Дж.К., Вибе М.Г., Эриксен Н.Т. (январь 2006 г.). «Накопление фикоцианина в гетеротрофных и миксотрофных культурах ацидофильной красной водоросли Galdieria сульфурария». Ферментные и микробные технологии . 38 (1–2): 168–175. doi : 10.1016/j.enzmictec.2005.05.010 .
- ^ Чанева Г., Фурнаджиева С., Минкова К., Лукавский Дж. (23 марта 2007 г.). «Влияние света и температуры на цианобактерию Arthronema africanum - перспективный штамм, продуцирующий фикобилипротеины». Журнал прикладной психологии . 19 (5): 537–544. Бибкод : 2007JAPco..19..537C . дои : 10.1007/s10811-007-9167-6 . S2CID 32093759 .
- ^ Венугопал В., Прасанна Р., Суд А., Джайсвал П., Кошик Б.Д. (2006). «Стимуляция накопления пигмента у штаммов Anabaena azollae: влияние интенсивности света и сахара». Фолиа микробиологическая . 51 (1): 50–6. дои : 10.1007/bf02931450 . ПМИД 16821712 . S2CID 22719533 .
- ^ Нараян М.С., Манодж Г.П., Вачравелу К., Бхагьялакшми Н., Махадевасвами М. (ноябрь 2005 г.). «Использование глицерина в качестве источника углерода для роста, производства пигментов и липидов в Spirulina Platensis». Международный журнал пищевых наук и питания . 56 (7): 521–8. дои : 10.1080/09637480500410085 . ПМИД 16503562 . S2CID 2352249 .
- ^ Трокслер Р.Ф., Эрхардт М.М., Браун-Мейсон А.С., Оффнер Г.Д. (декабрь 1981 г.). «Первичная структура фикоцианина из одноклеточного родофита Cyanidium Caldarium. II. Полная аминокислотная последовательность бета-субъединицы» . Журнал биологической химии . 256 (23): 12176–84. дои : 10.1016/S0021-9258(18)43250-4 . ПМИД 7028751 .
- ^ «Фикоцианин из водорослей и его применение» . Ойлгей.
- ^ Перейти обратно: а б Ромай С., Арместо Х., Ремирес Д., Гонсалес Р., Ледон Н., Гарсиа И. (январь 1998 г.). «Антиоксидантные и противовоспалительные свойства С-фикоцианина из сине-зеленых водорослей». Исследование воспаления . 47 (1): 36–41. дои : 10.1007/s000110050256 . ПМИД 9495584 . S2CID 672069 .
- ^ Ромай С., Гонсалес Р., Ледон Н., Ремирес Д., Римбау В. (июнь 2003 г.). «C-фикоцианин: билипротеин с антиоксидантным, противовоспалительным и нейропротекторным действием». Современная наука о белках и пептидах . 4 (3): 207–16. дои : 10.2174/1389203033487216 . ПМИД 12769719 .
- ^ Ромай Ч., Арместо Дж., Ремирес Д., Гонсалес Р., Ледон Н., Гарсия И. (1998). «Антиоксидантные и противовоспалительные свойства С-фикоцианина из сине-зеленых водорослей». Исследование воспаления . 47 (1): 36–41. дои : 10.1007/s000110050256 . ПМИД 9495584 . S2CID 672069 .
- ^ Перейти обратно: а б Ромай С., Ледон Н., Гонсалес Р. (август 1998 г.). «Дальнейшие исследования противовоспалительной активности фикоцианина на некоторых моделях воспаления на животных». Исследование воспаления . 47 (8): 334–338. дои : 10.1007/s000110050338 . ПМИД 9754867 . S2CID 24249892 .
- ^ Патель А., Мишра С. и Гош ПК (2006). Антиоксидантный потенциал C-фикоцианина, выделенного из цианобактерий видов Lyngbya, Phormidium и Spirulina spp.
- ^ Чжоу ЗП, ЛИУ, Чен XL, Ван JX, Чен М, Чжан YZ, Чжоу BC (2005). «Факторы, влияющие на антиоксидантную активность C-фикоцианинов из Spirulina Platensis» . Журнал пищевой биохимии . 29 (3): 313–322. дои : 10.1111/j.1745-4514.2005.00035.x .
- ^ Перейти обратно: а б Мин, СК, Пак, Дж.С., Луо, Л., Квон, Ю.С., Ли, ХК, Шим, Х.Дж., ... и Шин, Х.С. (2015). Оценка влияния C-фикоцианина на опосредованную астроцитами нейропротекцию против окислительного повреждения головного мозга с использованием 2D и 3D модели ткани астроцитов. Научные отчеты, 5, 14418.
- ^ Лю, К., Хуан, Ю., Чжан, Р., Цай, Т., и Цай, Ю. (2016). Медицинское применение C-фикоцианина, полученного из спирулины. Доказательная дополнительная и альтернативная медицина, 2016.
- ^ Перейти обратно: а б Вадираджа Б.Б., Гайквад Н.В., Мадьястха К.М. (1998). «Гепатопротекторное действие C-фикоцианина: защита от четыреххлористого углерода и R-(+)-пулегона-опосредованной гепатотоксичности у крыс». Связь с биохимическими и биофизическими исследованиями . 249 (2): 428–431. дои : 10.1006/bbrc.1998.9149 . ПМИД 9712713 .
- ^ Баша О.М., Хафез Р.А., Эль-Аюти Ю.М., Махрус К.Ф., Бариди М.Х., Салама А.М. (2008). «C-фикоцианин ингибирует пролиферацию клеток и может вызывать апоптоз в клетках HepG2 человека» (PDF) . Египетский журнал иммунологии . 15 (2): 161–7. ПМИД 20306699 . S2CID 42395208 . Архивировано из оригинала (PDF) 15 марта 2018 года.
- ^ Перейти обратно: а б Лю Ц, Хуан И, Чжан Р, Цай Т, Цай Ю (2016). «Медицинское применение спирулины C-фикоцианина из производного » . Доказательная дополнительная и альтернативная медицина . 2016 : 1–14. дои : 10.1155/2016/7803846 . ПМЦ 4879233 . ПМИД 27293463 .
- ^ Пардхасарадхи Б.В., Али А.М., Кумари А.Л., Редданна П., Хар А. (ноябрь 2003 г.). «Фикоцианин-опосредованный апоптоз в опухолевых клетках AK-5 включает подавление Bcl-2 и образование АФК» . Молекулярная терапия рака . 2 (11): 1165–70. ПМИД 14617790 .
- ^ Перейти обратно: а б Мартелли Дж., Фолли С., Висаи Л., Далья М., Феррари Д. (январь 2014 г.). «Повышение термической стабильности синего красителя C-фикоцианина из Spirulina Platensis для применения в пищевой промышленности». Технологическая биохимия . 49 (1): 154–159. дои : 10.1016/j.procbio.2013.10.008 .
- ^ Чайклахан Р., Чирасуван Н., Буннаг Б. (апрель 2012 г.). «Стабильность фикоцианина, экстрагированного из Spirulina sp.: Влияние температуры, pH и консервантов». Технологическая биохимия . 47 (4): 659–664. дои : 10.1016/j.procbio.2012.01.010 .
Дальнейшее чтение
[ редактировать ]- Барсанти Л (2008). «Странности и курьезы в мире водорослей» . В Евангелисте V, Барсанти Л., Фрассанито А.М., Пассарелли В., Гуальтьери П. (ред.). Водорослевые токсины: природа, возникновение, эффект и обнаружение . Наука НАТО ради мира и безопасности. Серия A: Химия и биология. Дордрехт: Спрингер. стр. 353–391. дои : 10.1007/978-1-4020-8480-5_17 . ISBN 978-1-4020-8479-9 .