изохинолин

| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
изохинолин [ 1 ] | |||
| Другие имена
Бензо[ c ]пиридин
2-бензазин | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.003.947 | ||
| Номер ЕС |
| ||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 9 Ч 7 Н | |||
| Молярная масса | 129.162 g·mol −1 | ||
| Появление | Бесцветная маслянистая жидкость; гигроскопичные тромбоциты в твердом состоянии | ||
| Плотность | 1,099 г/см 3 | ||
| Температура плавления | 26–28 ° C (79–82 ° F; 299–301 К) | ||
| Точка кипения | 242 ° С (468 ° F; 515 К) | ||
| Кислотность ( pKa ) | ПК БХ + = 5.14 [ 2 ] | ||
| −83.9·10 −6 см 3 /моль | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Изохинолин — это отдельный химический образец — гетероциклическое ароматическое органическое соединение , а также название семейства многих тысяч природных растительных алкалоидов, любой из которых можно назвать «изохинолином». Это изомер хинолина . структурный Изохинолин и хинолин представляют собой бензопиридины , которые состоят из бензольного кольца, конденсированного с пиридиновым кольцом. В более широком смысле термин изохинолин используется для обозначения производных изохинолина . 1-Бензилизохинолин является структурной основой многих природных алкалоидов, таких как папаверин . Изохинолиновое кольцо в этих природных соединениях происходит от ароматической аминокислоты тирозина . [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ]
Характеристики
[ редактировать ]Изохинолин — бесцветная гигроскопичная жидкость при температуре выше точки плавления с резким неприятным запахом . Нечистые образцы могут выглядеть коричневатыми, что типично для азотистых гетероциклов. Кристаллизуется в виде пластинок, которые плохо растворяются в воде, но хорошо растворяются в этаноле , ацетоне , диэтиловом эфире , сероуглероде и других обычных органических растворителях . Он также растворим в разбавленных кислотах как протонированное производное.
Являясь аналогом пиридина, изохинолин является слабым основанием с p K a 5,14. [ 2 ] Он протонирует с образованием солей при обработке сильными кислотами , такими как HCl. Он образует аддукты с кислотами Льюиса , такими как BF 3 .
Производство
[ редактировать ]Изохинолин был впервые выделен из каменноугольной смолы в 1885 году Хугеверфом и ван Дорпом. [ 9 ] Они выделили его фракционной кристаллизацией сульфата кислоты. Вайсгербер в 1914 году разработал более быстрый путь путем селективной экстракции каменноугольной смолы, используя тот факт, что изохинолин является более основным, чем хинолин. Затем изохинолин можно выделить из смеси фракционной кристаллизацией сульфата кислоты.
Хотя производные изохинолина можно синтезировать несколькими методами, незамещенный изохинолин получают сравнительно немногими прямыми методами. Реакция Померанца-Фритча представляет собой эффективный метод получения изохинолина. В этой реакции используются бензальдегида диэтилацеталь и аминоацетоальдегида, которые в кислой среде реагируют с образованием изохинолина. [ 10 ] Альтернативно можно использовать бензиламин и глиоксаля ацеталь для получения того же результата с использованием модификации Шлиттлера-Мюллера. [ 11 ]
Несколько других методов полезны для получения различных производных изохинолина.
В реакции Бишлера-Наперальского β-фенилэтиламин ацилируется и циклодегидратируется кислотой Льюиса, такой как хлористый фосфорил или пентоксид фосфора . Полученный 1-замещенный 3,4-дигидроизохинолин затем можно дегидрировать с использованием палладия. Следующая реакция Бишлера-Наперальского дает папаверин.
Реакция Пикте -Гамса и реакция Пикте-Шпенглера являются вариациями реакции Бишлера-Наперальского. Реакция Пикте-Гамса работает аналогично реакции Бишлера-Наперальского; единственное отличие состоит в том, что дополнительная гидроксигруппа в реагенте обеспечивает место для дегидратации в тех же условиях реакции, что и циклизация с образованием изохинолина, вместо того, чтобы требовать отдельной реакции для превращения промежуточного дигидроизохинолина.
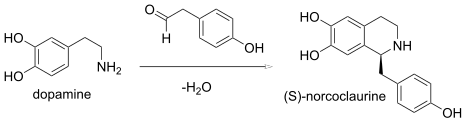
В реакции Пикте-Шпенглера конденсация β- фенилэтиламина и альдегида образует имин, который подвергается циклизации с образованием тетрагидроизохинолина вместо дигидроизохинолина . В энзимологии -норкоклауринсинтаза (S) , ( EC 4.2.1.78 ) представляет собой фермент катализирующий биологический синтез Пиктекта-Шпенглера:
Внутримолекулярные реакции аза-Виттига также дают изохинолины.
Применение деривативов
[ редактировать ]Изохинолины находят множество применений, в том числе:
- анестетики; диметизохин является одним из примеров (показан ниже).
- антигипертензивные средства, такие как хинаприл и дебризохин (все они являются производными 1,2,3,4-тетрагидроизохинолина).
- антиретровирусные средства, такие как саквинавир с изохинолильной функциональной группой (показано ниже).
- сосудорасширяющие средства, известный пример папаверин , показанный ниже.
- платиновые комплексы изохинолинов, функционализированных мочевиной, использовались в качестве анионных рецепторов для хлоридов и сульфатов. [ 12 ]
- Соединения бисбензилизохинолиния — соединения, сходные по структуре с тубокурарином . Они имеют две изохинолиниевые структуры, связанные углеродной цепью, содержащей две сложноэфирные связи.
В человеческом теле
[ редактировать ]Считается, что болезнь Паркинсона , медленно прогрессирующее двигательное расстройство, вызывается определенными нейротоксинами . Нейротоксин под названием MPTP (1[ N ]-метил-4-фенил-1,2,3,6- тетрагидропиридин ), предшественник MPP. + , был обнаружен и связан с болезнью Паркинсона в 1980-х годах. Активные нейротоксины разрушают дофаминергические нейроны , что приводит к паркинсонизму и болезни Паркинсона. несколько производных тетрагидроизохинолина Было обнаружено, что обладают теми же нейрохимическими свойствами, что и MPTP. Эти производные могут действовать как предшественники активных нейротоксинов. [ 13 ]
Другое использование
[ редактировать ]Изохинолины используются в производстве красителей , красок , инсектицидов и фунгицидов . Он также используется в качестве растворителя для жидкостно-жидкостной экстракции смол терпенов и ингибитора , а также в качестве коррозии .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 212. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
- ^ Перейти обратно: а б Браун Х.К. и др., Бауд Э.А. и Наход Ф.К., Определение органических структур физическими методами , Academic Press, Нью-Йорк, 1955.
- ^ Гилкрист, TL (1997). Гетероциклическая химия (3-е изд.). Эссекс, Великобритания: Эддисон Уэсли Лонгман.
- ^ Харрис, Дж.; Поуп, WJ « Изохинолин и изохинолин -красные» Журнал Химического общества (1922), том 121, стр. 1029–1033.
- ^ Катрицкий, А.Р.; Пожарский, А.Ф. (2000). Справочник по гетероциклической химии (2-е изд.). Оксфорд, Великобритания: Elsevier.
- ^ Катрицкий, А.Р.; Рис, CW; Скривен, Э.Ф. (ред.). (1996). Комплексная гетероциклическая химия II: Обзор литературы 1982–1995 (Том 5). Тэрритаун, Нью-Йорк: Elsevier.
- ^ Нагацу, Т. «Изохинолиновые нейротоксины в головном мозге и болезнь Паркинсона» Neuroscience Research (1997), том 29, стр. 99–111.
- ^ О'Нил, Мариадель Дж. (Ред.). (2001). Индекс Merck (13-е изд.). Станция Уайтхаус, Нью-Джерси: Merck.
- ^ С. Хугеверф и В.А. ван Дорп (1885) «Об изомере хинолина», Recueil des Travaux Chemiques des Pays-Bas (Сборник работ по химии в Нидерландах), том 4, вып. 4, стр. 125–129. См. также: С. Хугеверф и В. А. ван Дорп (1886) «О некоторых производных изохинолина», Recueil des Travaux Chemiques des Pays-Bas , vol.5, no. 9, стр. 305–312.
- ^ Ли, Джей-Джей (2014). «Реакция Померанца – Фрица». Реакции имени: сборник подробных механизмов и синтетических приложений (5-е изд.). Спрингер . стр. 490–491. ISBN 9783319039794 .
- ^ Ли, Джей-Джей (2014). «Модификация Шлиттлера – Мюллера». Реакции имени: сборник подробных механизмов и синтетических приложений (5-е изд.). Спрингер . п. 492. ИСБН 9783319039794 .
- ^ Бонди, Шантель Р.; Гейл, Филип А.; Леб, Стивен Дж. (28 апреля 2004 г.). «Металло-органические анионные рецепторы: организация доноров водородных связей мочевины для инкапсуляции сульфат-ионов» . Журнал Американского химического общества . 126 (16): 5030–5031. дои : 10.1021/ja039712q . ISSN 0002-7863 .
- ^ Нива, Тошимицу; Кадзита, Нагацу, Тошихару (1998). «Производные изохинолина». стр . 3–23. doi : 10.1007/ . 978-1-4612-2000-8_1 978-1-4612-7375-2 .
Внешние ссылки
[ редактировать ]. Британская энциклопедия . Том. 22 (11-е изд.). 1911. стр. 758–759.