Дицианоаурат калия

| |
| Имена | |
|---|---|
| Название ИЮПАК
Дицианоаурат калия(I)
| |
| Другие имена | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 6235525 | |
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.034.303 |
| Номер ЕС |
|
| 37363 | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Число | 1588 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| Сезон(CN) 2 | |
| Молярная масса | 288.101 g/mol |
| Появление | белый кристалл [ 1 ] |
| Плотность | 3,45 г/см 3 [ 1 ] |
| Точка кипения | разлагается |
| 140 г/л [ 1 ] | |
| Структура | |
| Ромбоэдрический , hR54 , №148 | |
| Р 3 | |
а = 0,728 нм, б = 0,728 нм, с = 2,636 нм
| |
Объем решетки ( В )
|
1,2099 нм 3 |
Формульные единицы ( Z )
|
9 |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
токсичный |
| СГС Маркировка : | |
  
| |
| Предупреждение | |
| Х290 , Х300 , Х310 , Х315 , Х317 , Х318 , Х330 , Х410 | |
| П260 , П264 , П273 , П280 , П284 , П301+П310 | |
| Родственные соединения | |
Другие анионы
|
Аргентиноцианид калия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Дицианоаурат калия (или цианид калия-золота ) представляет собой неорганическое соединение формулы K[Au(CN) 2 ]. Это твердое вещество от бесцветного до белого цвета, растворимое в воде и слабо растворимое в спирте. Часто выделяют не саму соль, а растворы дицианоаурат-иона ([Au(CN) 2 ] − ) образуются в больших масштабах при добыче золота из его руд. [ 3 ]
Производство
[ редактировать ]При добыче золота из разбавленных источников золото избирательно извлекается путем растворения в водных растворах цианида, что обеспечивается растворением цианида натрия, цианида калия и/или цианида кальция . Реакция растворения золота, «уравнение Эльснера», выглядит следующим образом:
- 4 Au + 8 KCN + O 2 + 2 H 2 O → 4 K[Au(CN) 2 ] + 4 KOH
В этом процессе кислород является окислителем. [ 4 ]
Его также можно получить реакцией солей золота (I) с избытком цианида калия.
- AuCl + 2 KCN → K[Au(CN) 2 ] + KCl
Структура
[ редактировать ]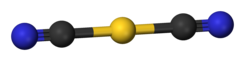
дицианоаурат представляет собой палочковидный анион.
Дицианоаурат калия – это соль. дицианоаурат - По данным рентгеновской кристаллографии, анион является линейным . [ 3 ] По данным инфракрасной спектроскопии , дицианоаурат-анион принимает очень похожую структуру в дицианоаурате натрия (NaAu(CN) 2 ). [ 5 ]
Использование
[ редактировать ]Дицианоаурат — это растворимый вид, который является основным компонентом цианирования золота — гидрометаллургического процесса извлечения золота из разбавленных руд. Фактически, в коммерческих процессах более широко используется цианид натрия, а не соль калия. [ 6 ]
Помимо основного использования в качестве промежуточного продукта при добыче золота, дицианоаурат калия часто используется при гальванике золота .
Родственные соединения
[ редактировать ]Известно также соединение, содержащее цианид золота(III): тетрацианоаурат(III) калия, K[Au(CN) 4 ]. Его использование менее распространено.
Ион калия может быть заменен катионами четвертичного аммония, как в тетрабутиламмония . дицианоаурате [ 7 ]
Безопасность
[ редактировать ]Проглатывание дицианоаурата калия в граммах может привести к смерти из-за золота, которое ингибирует фермент роданеза , который организм использует для детоксикации цианида. [ 8 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Хейнс, Уильям М., изд. (2011). Справочник CRC по химии и физике (92-е изд.). ЦРК Пресс . п. 4.82. ISBN 978-1439855119 .
- ^ Гринвуд, Нью-Йорк; и Эрншоу, А. (1997). Химия элементов (2-е изд.), Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4 .
- ^ Jump up to: а б Розенцвейг, А.; Кромер, Д.Т. (1959). «Кристаллическая структура KAu(CN) 2 » . Акта Кристаллографика . 12 (10): 709–712. дои : 10.1107/S0365110X59002109 .
- ^ Обработка руд, содержащих химически активные сульфиды железа . Мультимикс-системы
- ^ Чедвик, Б.М.; Фрэнкисс, С.Г. (1976). «Колебательные спектры и структуры некоторых комплексов дицианоаурата (I)». Журнал молекулярной структуры . 31 (1): 1–9. Бибкод : 1976JMoSt..31....1C . дои : 10.1016/0022-2860(76)80113-5 .
- ^ Рубо, Андреас; Келленс, Раф; Редди, Джей; Штайер, Норберт; Хазенпуш, Вольфганг (2006). «Цианиды щелочных металлов». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.i01_i01 . ISBN 978-3527306732 .
- ^ Стендер, Матиас; Олмстед, Мэрилин М.; Балч, Алан Л.; Риос, Дэниел; Аттар, Саид (2003). «Влияние катионов и водородных связей на самоассоциацию и люминесценцию дицианоаурат-иона Au (CN) 2 » − ". Транзакции Далтона (22): 4282. doi : 10.1039/b310085e .
- ^ Райт, Айдахо; Веси, CJ (сентябрь 1986 г.). «Острое отравление цианидом золота» . Анестезия . 41 (9): 936–939. дои : 10.1111/j.1365-2044.1986.tb12920.x . ПМИД 3022615 .
