Тетракарбонилдигидрид железа
| |
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
Тетракарбонилдигидридожелезо(II) [ нужна ссылка ] | |
| Другие имена
Тетракарбонилдигидрид железа, тетракарбонилдигидрожелезо
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
ПабХим CID
|
|
| Характеристики | |
| FeC 44ч 22О 4 | |
| Молярная масса | 169.901 g mol −1 |
| Появление | Жидкость (при -20 °C) |
| Температура плавления | −70 ° C (−94 ° F; 203 К) |
| Точка кипения | -20 ° C (-4 ° F; 253 К) (разлагается) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
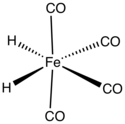
Тетракарбонилдигидрид железа представляет собой металлоорганическое соединение формулы H 2 Fe(CO) 4 . Это соединение было первым открытым гидридом переходного металла . Комплекс стабилен при низких температурах, но быстро разлагается при температуре выше –20 °С. [ 1 ]
Подготовка
[ редактировать ]Тетракарбонилдигидрид железа был впервые получен Хибером и Лейтертом из пентакарбонила железа , который сначала преобразуется в HFe(CO). −
4 : [ 2 ] [ 3 ]
- Fe(CO) 5 + 2 ОН − → HFe(CO) −
4 + ОЗ −
3 - HFe(CO) −
4 + Ч + → H 2 Fe(CO) 4
Поскольку соединение термически нестабильно и чувствительно к свету, идеальные условия в Мюнхене 1930-х годов требовали зимних ночей. Ранний метод назывался «синтезом полярной ночи».
Согласно рекомендациям Хибера и Лейтерта, соединение можно очистить путем перегонки между ловушками. [ 1 ] [ 4 ]
Структура и свойства
[ редактировать ]В тетракарбонилгидриде железа группа Fe(CO) 4 имеет C 2v молекулярную симметрию с промежуточной геометрией между октаэдрической и тетраэдрической . Гидридные лиганды, если рассматривать их как октаэдрический комплекс, являются цис-цисами . Если рассматривать тетраэдрический комплекс Fe(CO) 4 , гидриды занимают соседние грани тетраэдра. [ 5 ] Хотя структура тетракарбонилижелеза с атомами водорода, связанными в один лиганд H 2 , была предложена в качестве промежуточного продукта в некоторых реакциях перегруппировки, [ 6 ] стабильное состояние соединения имеет два атома как независимые лиганды. [ 7 ]
Реакции
[ редактировать ]Тетракарбонилдигидрид железа претерпевает быстрые замены лигандов фосфорными лигандами:
- H 2 Fe(CO) 4 + PPh 3 → H 2 Fe(CO) 3 PPh 3
Предполагается, что механизм замещения приводит к временному образованию 16e − формильный промежуточный продукт. [ 8 ]
H 2 Fe(CO) 4 имеет p K 1 6,8 и p K 2 15. [ 9 ] Моноанион [HFe(CO) 4 ] − имеет более обширную химическую реакцию, поскольку он более стабилен, чем дигидрид. [ 10 ] [ 11 ] Моноанион является промежуточным продуктом в гомогенной реакции конверсии вода-газ, катализируемой железом и карбонилом (WGSR). Медленным этапом в WGSR является перенос протона от воды к аниону гидрида железа. [ 12 ]
- HFe(CO) −
4 + H 2 O → H 2 Fe(CO) 4 + OH −
См. также
[ редактировать ]Дальнейшее чтение
[ редактировать ]- Цай, Ж.-К.; Хан, Массачусетс; Николай, К.М. (1991). «Восстановление координированного диоксида углерода гидридами переходных металлов». Металлоорганические соединения . 10 :29–30. дои : 10.1021/om00047a016 .
- Фармери, К.; Килнер, М. (1970). «Реакции замещения дигидридотетракарбонила железа». Журнал Химического общества A : 634. doi : 10.1039/J19700000634 .
Ссылки
[ редактировать ]- ^ Jump up to: а б Бланшар, Артур А.; Коулман, Джордж В. (1946). Тетракарбонилдигидрид железа . Неорганические синтезы. Том. 2. С. 243–244. дои : 10.1002/9780470132333.ch77 . ISBN 9780470132333 .
- ^ Хибер, В.; Лейтерт, Ф. (1931). «На пути к познанию координационно связанного оксида углерода: образование карбонильного водорода железа». естественные науки . 19 (17): 360. Бибкод : 1931NW.....19..360H . дои : 10.1007/BF01522286 . S2CID 791569 .
- ^ Риттмайер, П.; Вительманн, У. (2006). «Гидриды». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a13_199 . ISBN 978-3527306732 .
- ^ Ванча, Л.; Грэм, WAG (1977). «Стереохимически нежесткие шестикоординированные карбонильные комплексы металлов». Дж. Органомет. хим. 134 (2): 219. doi : 10.1016/S0022-328X(00)81421-7 .
- ^ Макнил, Э.А.; Шолер, Франция (1977). «Молекулярная структура газообразных карбонилгидридов металлов марганца, железа и кобальта». Дж. Ам. хим. Соц. 99 (19): 6243. doi : 10.1021/ja00461a011 .
- ^ Субра, К.; Оиси, Ю.; Олбрайт, штат Калифорния; Фудзимото, Х. (2001). «Внутримолекулярные перегруппировки в шестикоординированных дигидридах рутения и железа». Неорг. Хим . 40 (4): 620–627. дои : 10.1021/ic0006089 . ПМИД 11225102 .
- ^ Друэн, Би Джей; Куколич, С.Г. (1998). «Молекулярная структура тетракарбонилдигидрожелеза: микроволновые измерения и расчеты по теории функционала плотности». Дж. Ам. хим. Соц . 120 (27): 6774–6780. дои : 10.1021/ja9741584 .
- ^ Пирсон, Р.Г.; Уокер, Х.В.; Мауэрманн, Х.; Форд, ПК (1981). «Механизм миграции водорода в реакциях замещения лигандов в карбонилгидридах металлов». Неорг. хим. 20 (8): 2741. doi : 10.1021/ic50222a078 .
- ^ Уокер, Х.В.; Кресге, Коннектикут; Форд, ПК; Пирсон, Р.Г. (1979). «Скорости депротонирования и значения p K a карбонилгидридов переходных металлов». Дж. Ам. хим. Соц. 101 (24): 7428. doi : 10.1021/ja00518a061 .
- ^ Брюне, Ж.-Ж.; Шовен, Р.; Диалло, О.; Киндела, Ф.; Леглей, П.; Найбекер Д., «Координационная химия моноядерных карбонильных комплексов железа», «Обзоры координационной химии», 1998, 178–180, 331–352. два : 10.1016/S0010-8545(98)00075-7
- ^ Брюне, Джей-Джей (1990). «Тетракарбонилгидридоферраты, MHFe(CO) 4 : универсальные инструменты в органическом синтезе и катализе». хим. Откр. 90 (6): 1041–1059. дои : 10.1021/cr00104a006 .
- ^ Крэбтри, Р. Х. Мингос DMP 2007. Комплексная металлоорганическая химия III: от основ к приложениям. ООО "Эльзевир"