Нутриэпигеномика
Нутриэпигеномика — это изучение пищевых питательных веществ и их влияния на здоровье человека посредством эпигенетических модификаций. В настоящее время имеется немало доказательств того, что дисбаланс питания во время беременности и лактации связан с неинфекционными заболеваниями , такими как ожирение , сердечно-сосудистые заболевания , диабет , гипертония и рак . Если метаболические нарушения происходят в критические периоды развития, возникающие в результате эпигенетические изменения могут привести к необратимым изменениям в структуре или функциях тканей и органов и предрасполагать людей к заболеванию. [1]
Обзор
[ редактировать ]Эпигенетика связана с наследуемыми изменениями функции генов , которые происходят независимо от изменений в первичной последовательности ДНК . Двумя основными эпигенетическими механизмами, участвующими в нутриэпигеномике, являются метилирование ДНК и модификация гистонов . Метилирование ДНК в областях промотора гена обычно приводит к молчанию генов и влияет на экспрессию генов. Хотя эта форма молчания генов чрезвычайно важна для развития и клеточной дифференциации, аберрантное метилирование ДНК может быть вредным и связано с различными болезненными процессами, такими как рак. [2] Метильные группы, используемые при метилировании ДНК, часто происходят из пищевых источников, таких как фолат и холин , и это объясняет, почему диета может оказывать значительное влияние на характер метилирования и экспрессию генов. [3] Сайленсинг генов также можно усилить за счет привлечения гистондеацетилаз для уменьшения активации транскрипции. И наоборот, ацетилирование гистонов индуцирует активацию транскрипции, увеличивая экспрессию генов. Диетические компоненты могут влиять на эти эпигенетические события, тем самым изменяя экспрессию генов и нарушая функции, такие как контроль аппетита, метаболический баланс и использование топлива. [1]
Различные генетические последовательности могут быть целью эпигенетической модификации. Анализ всего транскриптома на мышах показал, что диета с ограничением белка (PR) во время беременности привела к дифференциальной экспрессии генов примерно в 1% проанализированных генов плода (235/22 690). В частности, повышенная экспрессия наблюдалась в генах, участвующих в пути р53 , апоптозе , негативных регуляторах клеточного метаболизма и генах, связанных с эпигенетическим контролем. [4] Дополнительные исследования изучали эффект PR-диеты на крысах и обнаружили изменения в метилировании промотора как глюкокортикоидного рецептора, так и рецептора, активирующего пролифератор пероксисом (PPAR). [5] [6] Изменение экспрессии этих рецепторов может привести к повышению уровня глюкозы в крови и повлиять на липидный и углеводный обмен. [3] Кормление PR-диетой беременных и/или кормящих мышей также увеличивало экспрессию глюкокиназы , ацетил-КоА-карбоксилазы , PPARα и ацил-КоА-оксидазы . [7] Сообщается, что изменения в экспрессии были обусловлены эпигенетической регуляцией либо самого промотора гена, либо промоторов факторов транскрипции, которые регулируют экспрессию генов. Дополнительные гены, которые, как было показано в исследованиях in vitro или in vivo , регулируются эпигенетическими механизмами, включают лептин , SOCS3 , транспортер глюкозы (GLUT)-4, POMC , 11-β-гидроксистероиддегидрогеназу типа 2 и гормон, высвобождающий кортикотропин . Эпигенетическая модификация этих генов может привести к «метаболическому программированию» плода и привести к долгосрочным изменениям метаболизма и энергетического гомеостаза. [8]
Нутриэпигеномика и развитие
[ редактировать ]Период развития, в котором возникает дисбаланс питания, очень важен для определения того, какие гены, связанные с заболеванием, будут затронуты. Различные органы проходят критические стадии развития, и момент времени, когда они подвергаются риску, предрасполагает людей к определенным заболеваниям. [9] Эпигенетические модификации, возникающие во время развития, могут проявиться только в более позднем возрасте, в зависимости от функции гена. [3] Хотя большинство исследований считают пренатальный и перинатальный периоды критическими временными окнами, некоторые исследования показали, что прием пищи во взрослом возрасте также может влиять на эпигеном.
Пренатальный
[ редактировать ]Пластичность развития — это процесс, в ходе которого плоды адаптируются к окружающей среде. Сигналы окружающей среды, включая пищевые компоненты, присутствующие во внутриутробной среде, могут вызывать значительные изменения в экспрессии генома посредством эпигенетических модификаций. [7] Пластические реакции развития плода могут вызывать изменения мышечной массы тела, эндокринологии, кровотока и сосудистой нагрузки, а также приводить к повышенному риску различных заболеваний во взрослом возрасте.
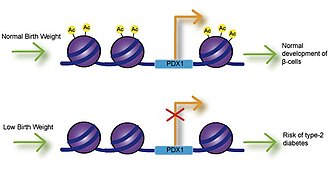
Низкий вес при рождении
[ редактировать ]Воздействие на плод кальция, фолиевой кислоты, магния, высокого или низкого содержания белка и цинка связано с массой тела при рождении. [9] Многочисленные исследования изучали связь между весом при рождении и риском заболеваний и обнаружили, что низкий вес при рождении в значительной степени связан с ишемической болезнью сердца, инсультом и диабетом 2 типа. Самое главное, что эти ассоциации возникли после поправки на факторы образа жизни, что предполагает генетическую основу возникновения заболевания. [10] Нарушение секреции инсулина связано с низким весом при рождении и может привести к резистентности к инсулину, поскольку у младенцев накапливается жир. [11] Исследования на крысах с задержкой внутриутробного развития (IUGR) показали, что ингибирование роста может привести к снижению экспрессии транскрипционного фактора Pdx1, который необходим для дифференцировки и функционирования бета-клеток поджелудочной железы. [12] Снижение ацетилирования гистонов на проксимальном промоторе Pdx1 ответственно за снижение экспрессии Pdx1 и впоследствии приводит к каскаду событий деацетилирования и метилирования гистонов, которые могут привести к диабету 2 типа.
Ожирение
[ редактировать ]Ожирение во время беременности и диета матери с высоким содержанием жиров демонстрируют тесную связь с ожирением у потомства. По мере увеличения числа женщин репродуктивного возраста с избыточным весом увеличивается и число детей и младенцев с избыточным весом. [10] Было высказано предположение, что материнское ожирение вызывает накопление жира в жировой ткани плода (ожирение) и предрасполагает детей к ожирению в детстве и взрослом возрасте. [10] Исследования на животных показали, что избыточное питание матери может повлиять на развитие мозга и вызвать нарушения программирования гипоталамуса . У потомства, которое подвергалось воздействию материнского рациона с высоким содержанием жиров или калорий, наблюдался повышенный уровень инсулина, глюкозы и лептина. Предполагается, что это повышение связано с нарушениями в сложной нейрональной сети, которая включает пути нейропептида Y (NPY) и проопиомеланокортина (POMC). [8] Эта измененная передача сигналов нейронов может, следовательно, повлиять на поведение в отношении потребления пищи и привести к ожирению, вызванному диетой, во взрослом возрасте. Хотя эпигенетические модификации, скорее всего, участвуют в развитии ожирения, конкретные гены-мишени еще не идентифицированы. Гены, участвующие в адипогенезе, такие как фактор роста фибробластов-2, гомолог фосфатазы и тензина, ингибитор циклин-зависимой киназы 1А и эстрогеновый рецептор-альфа, обладают множеством CpG-островков в своих промоторных сайтах и могут действовать как эпигенетические мишени. [13] Кроме того, было показано, что пренатальное воздействие гипометилирующего агента, такого как бисфенол А (БФА), связано с увеличением массы тела и предполагает модифицированное метилирование ДНК как механизм повышения предрасположенности к ожирению. [13]
Фолат
[ редактировать ]Давно известно, что потребление фолата матерью во время беременности связано с развитием и ростом плода и может снизить риск серьезных врожденных дефектов. Фолат является источником S-аденозилметионина (SAM), который используется для снабжения ДНК-метилтрансфераз метильными группами. Следовательно, изменения в поставках фолиевой кислоты оказывают существенное влияние на характер метилирования ДНК. Низкий уровень фолата связан с повышенным риском преждевременных родов, плохим ростом плаценты и матки и задержкой внутриутробного развития. [3] Несколько сложных заболеваний, включая рак, сердечно-сосудистые заболевания и аутизм, также связаны с уровнем фолиевой кислоты у матери. На основании исследований на животных была выдвинута гипотеза, что снижение потребления фолиевой кислоты может увеличить риск дефектов нервной трубки за счет уменьшения количества метилслойной ДНК во время краниального закрытия нервной трубки. [14] Недавно было обнаружено, что защита фолиевой кислоты от врожденных пороков сердца связана с эпигенетикой и передачей сигналов Wnt. Множественные факторы окружающей среды воздействуют на сигнальный путь Wnt во время эмбриогенеза и могут вызвать нарушение регуляции этого пути. Метаболизм фолиевой кислоты генерирует SAM, тем самым изменяя состояния метилирования гистонов H3K9, H3K4 и H3K27 и генетически изменяя передачу сигналов Wnt. [15]
Недавно двойное слепое плацебо-контролируемое исследование высоких доз фолиевой кислоты (лейковорин кальция) продемонстрировало эффективность улучшения речевого общения у детей с аутизмом . [16]
Перинатальный
[ редактировать ]Еще одним критическим временным окном развития является перинатальный период, период времени непосредственно до и после рождения. Было показано, что диета матери на поздних сроках беременности и диета ребенка в первые недели могут оказывать существенное влияние на экспрессию генов. Таким образом, перинатальное питание является как поздним этапом внутриутробного питания, так и лактации.
Здоровье костей
[ редактировать ]Костная масса и развитие остеопороза изучались в связи с перинатальным питанием. Важным фактором, который следует учитывать при исследовании перинатального питания, является то, находился ли ребенок на грудном вскармливании или на искусственном вскармливании. Исследования показали, что дети, вскармливаемые грудью, имеют увеличенную костную массу по сравнению с детьми, которых не кормили грудью, и что это небольшое увеличение костной массы в период критического развития потенциально может запрограммировать скелет на продолжение «здоровой» траектории роста. [17] Также было показано, что недостаточность витамина D у матери на поздних сроках беременности связана с уменьшением размера костей и минеральной массы в позднем детстве. [18] Пиковая костная масса оказалась хорошим предиктором риска переломов и остеопороза, причем даже небольшое увеличение пиковой костной массы приводит к гораздо более низкому риску переломов костей. [9] Исследования показывают, что генетические маркеры объясняют лишь небольшую часть изменений костной массы и риска переломов. Следовательно, на программирование здоровой кости, скорее всего, влияют различные эпигенетические механизмы, такие как импринтинг генов, способствующих росту IGF-2, или изменения гипоталамо -гипофизарно-надпочечниковой оси (HPA). [19]
Нейроразвитие
[ редактировать ]Дисбаланс в питании матери также может оказывать существенное влияние на развитие нервной системы плода . Развитие мозга происходит наиболее быстро во время развития плода и в младенчестве, и исследования показали, что воздействие определенных условий окружающей среды может иметь долгосрочные последствия для когнитивных функций . n-3 жирные кислоты , йод , железо и холин В частности, было показано, что влияют на развитие мозга, а также на когнитивные способности и поведение. Наибольшие доказательства связи между питанием и развитием нервной системы получены в исследованиях, которые показывают, что низкий вес при рождении связан с низким IQ и повышенным риском шизофрении . [20] [21] Некоторые исследования показывают, что грудное вскармливание способствует долгосрочному развитию нервной системы, обеспечивая питательные вещества, необходимые для правильного развития мозга. [22] Исследование на мышах показало, что диеты с дефицитом холина на поздних сроках беременности нарушают развитие мозга плода, включая снижение пролиферации клеток и снижение зрительно-пространственной и слуховой памяти. [23] Эти когнитивные изменения, по-видимому, связаны с изменением паттернов метилирования гистонов и ДНК в гиппокампе плода , что обеспечивает связь между питанием матери, эпигенетикой и ранним развитием мозга.
Диабет 1 типа
[ редактировать ]Было высказано предположение, что грудное вскармливание может также защитить от диабета 1 типа, при этом исследования показали, что дети, находящиеся на искусственном вскармливании, подвергаются повышенному риску развития островковых аутоантител . У людей с диабетом 1 типа наблюдается доклиническая фаза диабета, характеризующаяся аутоиммунитетом против островков поджелудочной железы . [24] Введение в первые несколько месяцев жизни определенных продуктов, таких как ягоды и крупы, в значительной степени связано с повышенным риском развития островковых аутоантител по сравнению с детьми, которые в более позднем возрасте подвергаются воздействию твердой пищи. [25] Хотя патогенез развития аутоантител остается в значительной степени неизвестным, весьма вероятно, что существует эпигенетическая связь между перинатальной диетой и риском развития диабета 1 типа. [9]
Взрослая жизнь
[ редактировать ]Большинство исследований в области нутриэпигеномики сосредоточено на дисбалансе питания в периоды беременности и лактации. Однако продукты, которые потребляются во взрослом возрасте, также могут влиять на экспрессию генов и патогенез заболеваний. Рак – это заболевание, которое чаще всего связано с питанием взрослых и эпигенетическими модификациями. Гипометелирование ДНК способствует прогрессированию рака, позволяя увеличить транскрипцию генов, в то время как гиперметилирование может заставить замолчать гены-супрессоры опухолей и дополнительно способствовать неконтролируемому делению клеток и образованию опухоли . Соединения, содержащиеся в пищевых продуктах, такие как генистеин и полифенолы чая , способны регулировать ДНК-метилтрансферазы и ацетилирование гистонов в культивируемых раковых клетках и могут обеспечивать защиту от определенных типов рака. [13] Другие пищевые соединения, такие как диаллилдисульфид, присутствующий в чесноке, и сульфорафан, присутствующий в крестоцветных овощах, в клинических исследованиях были связаны с профилактикой рака. [26] Это может быть связано с их способностью ингибировать ферменты гистондеацетилазы (HDAC) и предотвращать подавление важных регуляторных генов.
Трансгенерационные эффекты
[ редактировать ]
Многие считают, что эпигенетическая регуляция очищается в процессе оплодотворения , однако появляется все больше доказательств трансгенерационных эффектов (TGE). [1] Эти TGE происходят, когда эпигенетические регуляторные паттерны недостаточно стираются во время оплодотворения, возможно, из-за уровня питания в предыдущих поколениях. Более поздние поколения могут пострадать от ограничения калорий и белка, употребления большого количества жиров и эндокринных нарушений у более ранних поколений. [1] Считается, что различия в пищевом поведении матери-крысы вызывают неправильное программирование в поколении F1 и затем могут передаваться последующим поколениям. [1] У крыс-матерей, получавших PR-диету на протяжении всей беременности, в поколениях F1 и F2 возникали проблемы с обменом веществ, даже при нормальном питании во время беременности F1. [27] [28] Эти эффекты также наблюдались в поколении F3 в зависимости от продолжительности ограничения белка. [29] [30] Если ограничение белка происходило исключительно во время беременности, потомство F1 и F2 имело более высокое систолическое артериальное давление и более низкое количество нефронов, что, возможно, предрасполагало их к гипертонии. [30] У потомков материнских крыс, получавших PR-диету во время беременности и лактации, было обнаружено изменение утилизации глюкозы, что потенциально может привести к развитию диабета в более позднем возрасте. [29]
Ограничение белка в поколении F0 приводило к гипометилированию промоторов, участвующих в метаболизме в поколениях F1 и F2, даже несмотря на то, что беременная крыса F1 получала обычную диету. [31] Точный механизм этой ситуации еще предстоит выяснить; однако прямая передача вполне возможна, то есть эпигенетические метки сохранялись во время сперматогенеза и оогенеза , когда они обычно стираются.
Модели, используемые в нутриэпигеномных исследованиях
[ редактировать ]Большинство исследований на сегодняшний день используют обычные модели грызунов для изучения роли питания на фенотипе . [10] Популярные области исследований включают исследования ЗВУР, в ходе которых грызуны, а иногда и овцы, подвергаются различным условиям питания. Модель для изучения ЗВУР у грызунов была разработана Simmons et al. (2010) и используется для исследования диабета II типа. [32] Материнским крысам перевязывают маточные артерии, что приводит к изменению использования глюкозы и инсулина у плода и, следовательно, может служить моделью диабета. Было обнаружено, что эти крысы с задержкой роста очень похожи на человеческие плоды, поскольку у них обоих наблюдаются такие симптомы, как снижение уровня глюкозы и инсулина. Гестационный диабет также можно изучать путем химической индукции с использованием стрептозотоцином . лечения беременных крыс [33] Стрептозотоцин может вызвать разрушение бета-клеток поджелудочной железы в зависимости от введенной концентрации.
Преобладающие средства исследования нутриэпигенетики включают изменение условий питания, которым подвергается субъект, и последующий мониторинг эффектов. Ограничение потребления калорий и белка — два наиболее распространенных метода. [33] У беременных грызунов потребление калорий может быть снижено до 30-50% от нормального потребления. Грызунам с ограниченным содержанием белка дают 8-9% казеина , в отличие от контрольных крыс, которым дают 20% казеина. Микронутриенты, такие как цинк и железо, также могут быть ограничены для изучения воздействия на потомство. Кроме того, для изучения влияния диеты на эпигеномику крыс, которых кормили диетами с отсутствием или включением доноров метила, часто используют изменения в метилировании ДНК, которые являются обычным средством подавления или экспрессии генов. [34] Добавление материнским мышам фолиевой кислоты, витамина B12 , холина и бетаина приводит к повышению уровня метилирования ДНК в сайтах CpG и вызывает изменение цвета шерсти. [35] Это пример эпигенетически модифицируемых локусов, называемых «метастабильными эпиаллелями», из которых идентифицированы лишь некоторые. Вышеупомянутое является примером локуса гена «агути», при котором вставка мобильного элемента выше гена агути гиперметилируется в результате добавки и вызывает изменение цвета шерсти мышей. Диеты с более высоким содержанием углеводов и жиров, имитирующие типичные диеты западного типа, также могут использоваться в нутриэпигенетических исследованиях. [10] [33] Другой используемый метод — «догоняющий», когда потомство крыс, рожденных от матерей, находящихся на различных диетах, впоследствии подвергается перекрестному вскармливанию с матерями, которых кормят обычным рационом. [33]
Будущие направления
[ редактировать ]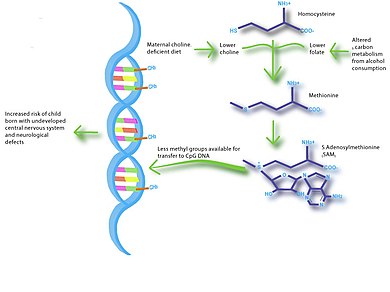
Возможности использования нутриэпигеномики для вмешательства весьма обширны. Это может включать профилактическую терапию, например, обеспечение оптимального режима питания во время беременности и кормления грудью. [33] Беременные матери уже стали обычным явлением дополнять свой рацион холином и фолатом, чтобы предотвратить развитие неврологических нарушений у плода.
Высокоспецифическая диета, называемая «диета EpiG», может применяться для людей, которые, как полагают, подвергаются более высокому риску развития метаболических нарушений. [1] Эти диеты могут включать добавки доноров метильных кислот, таких как фолат. Есть также много других природных соединений, таких как ресвератрол , куркумин и зеленый чай, которые были названы «эпигенетическими модификаторами», поскольку они обладают противораковыми свойствами, а также используются для лечения метаболических заболеваний. [36] Однако функции этих соединений по-прежнему требуют долгосрочных исследований для оценки их эффекта с течением времени.
Также существует потенциал для терапевтических методов лечения, которые могут исправить метаболические нарушения, такие как диабет II типа. [33] Известно, что компоненты чеснока и овощей семейства крестоцветных содержат ингибиторы HDAC , которые изменяют ацетилирование белков-гистонов и могут обеспечивать защиту от рака. [26] Эти же соединения также участвуют в синдроме раздраженного кишечника (СРК) и раке толстой кишки , поскольку они могут модифицировать гистоны, обычно участвующие в этих заболеваниях. [37]
Выяснение путей развития заболеваний является еще одним будущим направлением нутриэпигеномных исследований. Например, диеты с дефицитом холина и метаболизм алкоголя во время беременности могут иметь очень схожие метаболические пути. [38] Таким образом, исследования на животных с использованием диет с ограничением холина могут помочь в изучении нарушений алкогольного спектра плода .
По сравнению с исследованиями материнской передачи, исследования роли отцовского питания отсутствуют. Обзор показал, что питание обоих родителей действительно играет роль в определении здоровья их потомства. [39] Исследование зародышевой линии показало, что отцовские крысы, которых кормили диетой с высоким содержанием жиров, приводили к дисфункции инсулина у потомства F1. [40] Хотя это, вероятно, происходит посредством эпигенетических модификаций, аналогичных тем, которые постулируются в рационе матери, точный механизм еще предстоит определить. Оценить роль эпигенетических механизмов может быть проще, используя наследование по отцовской линии, поскольку сперматозоиды передают эпигенетическую и генетическую информацию, тогда как женские клетки также передают митохондриальную ДНК . [39]
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ Jump up to: а б с д и ж Галлу-Кабани С., Виге А., Гросс М.С., Джуньен С. (2007). «Нутриэпигеномика: ремоделирование наших эпигеномов на протяжении всей жизни под воздействием пищевых и метаболических факторов и за их пределами». Клин Химическая Лаборатория Мед . 45 (3): 321–7. дои : 10.1515/CCLM.2007.081 . ПМИД 17378726 . S2CID 29084180 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Бердаско М., Эстеллер М. (2010). «Аберрантный эпигенетический ландшафт рака: как нарушается клеточная идентичность» . Ячейка разработчиков . 19 (5): 698–711. дои : 10.1016/j.devcel.2010.10.005 . ПМИД 21074720 .
- ^ Jump up to: а б с д Пожарный Ю., Ламбертини Л., Клюни Дж., Феррара Л., Ли М.Дж. (март 2010 г.). «Эпигенетика в женском здравоохранении». Гора Синай J Med . 77 (2): 225–35. дои : 10.1002/msj.20176 . ПМИД 20309920 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Георге К.П., Гоял Р., Холвегер Дж.Д., Лонго Л.Д. (май 2009 г.). «Реакция экспрессии плацентарных генов на ограничение материнского белка у мышей» . Плацента . 30 (5): 411–7. дои : 10.1016/j.placenta.2009.03.002 . ПМЦ 2674533 . ПМИД 19362366 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Лилликроп К.А. , Филлипс Э.С., Торренс С., Хэнсон М.А., Джексон А.А., Бердж Г.К. (август 2008 г.). «Кормление беременных крыс диетой с ограничением белка постоянно изменяет метилирование специфических цитозинов в печеночном промоторе PPAR-альфа потомства» . Бр Дж Нутр . 100 (2): 278–82. дои : 10.1017/S0007114507894438 . ПМК 2564112 . ПМИД 18186951 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Лилликроп К.А. , Слейтер-Джеффрис Дж.Л., Хэнсон М.А., Годфри К.М., Джексон А.А., Бердж Г.К. (июнь 2007 г.). «Индукция измененной эпигенетической регуляции печеночных глюкокортикоидных рецепторов у потомков крыс, получавших во время беременности диету с ограничением белка, позволяет предположить, что снижение экспрессии ДНК-метилтрансферазы-1 участвует в нарушении метилирования ДНК и изменениях модификаций гистонов» . Бр Дж Нутр . 97 (6): 1064–73. дои : 10.1017/S000711450769196X . ПМК 2211425 . ПМИД 17433129 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Бердж Г.К., Лилликроп К.А. (2010). «Питание, эпигенетика и пластичность развития: значение для понимания болезней человека». Анну Рев Нутр . 30 : 315–39. дои : 10.1146/annurev.nutr.012809.104751 . ПМИД 20415585 .
- ^ Jump up to: а б Тамасиро К.Л., Моран Т.Х. (2010). «Перинатальная среда и ее влияние на метаболическое программирование потомства» . Физиологическое поведение . 100 (5): 560–6. дои : 10.1016/j.physbeh.2010.04.008 . ПМЦ 2886179 . ПМИД 20394764 .
- ^ Jump up to: а б с д Хэнли Б., Диджан Дж., Фьютрелл М., Гринберг А., Хаммел С., Джуньен С., Колецко Б., Льюис С., Ренц Х., Саймондс М., Грос М., Харторн Л., Мейс К., Сэмюэлс Ф., ван Дер Бик EM (июль 2010 г.) . «Метаболический импринтинг, программирование и эпигенетика – обзор нынешних приоритетов и будущих возможностей» . Бр Дж Нутр . 104 : С1–25. дои : 10.1017/S0007114510003338 . ПМИД 20929595 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б с д и Симмонс Р. (февраль 2011 г.). «Эпигенетика и материнское питание: природа против воспитания» . Проц Нутр Соц . 70 (1): 73–81. дои : 10.1017/S0029665110003988 . ПМИД 21110912 .
- ^ Йенсен CB, Сторгаард Х, Дела Ф, Холст Дж. Дж., Мадсбад С., Вааг А. А. (апрель 2002 г.). «Ранние дифференциальные дефекты секреции и действия инсулина у 19-летних мужчин европеоидной расы с низкой массой тела при рождении» . Диабет . 51 (4): 1271–80. дои : 10.2337/диабет.51.4.1271 . ПМИД 11916955 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Парк Дж. Х., Стофферс Д. А., Николлс Р. Д., Симмонс Р. А. (июнь 2008 г.). «Развитие диабета 2 типа после задержки внутриутробного развития у крыс связано с прогрессирующим эпигенетическим молчанием Pdx1» . Джей Клин Инвест . 118 (6): 2316–24. дои : 10.1172/JCI33655 . ПМЦ 2373422 . ПМИД 18464933 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б с Кэмпион Дж., Милагро Ф.И., Мартинес Х.А. (июль 2009 г.). «Индивидуальность и эпигенетика при ожирении» . Обес преп . 10 (4): 383–92. дои : 10.1111/j.1467-789X.2009.00595.x . ПМИД 19413700 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Данлеви Л.П., Беррен К.А., Миллс К., Читти Л.С., Копп А.Дж., Грин Н.Д. (июль 2006 г.). «Целостность цикла метилирования необходима для закрытия нервной трубки млекопитающих». Исследование врожденных дефектов. Часть A: Клиническая и молекулярная тератология . 76 (7): 544–52. дои : 10.1002/bdra.20286 . ПМИД 16933307 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Линаск К.К., Хухта Дж. (2010). «Защита фолиевой кислоты от врожденных пороков сердца, связанная с канонической передачей сигналов wnt и эпигенетикой» . Курр Опин Педиатр . 22 (5): 561–6. дои : 10.1097/MOP.0b013e32833e2723 . ПМК 3004285 . ПМИД 20844350 .
- ^ Фрай, Р.Э.; Слэттери, Дж.; Дели, Л.; Фергерсон, Б.; Стрикленд, Т.; Типпетт, М.; Сейли, А.; Винн, Р.; Роуз, С. (18 октября 2016 г.). «Фолиниевая кислота улучшает вербальное общение у детей с аутизмом и речевыми нарушениями: рандомизированное двойное слепое плацебо-контролируемое исследование» . Молекулярная психиатрия . 23 (2): 247–256. дои : 10.1038/mp.2016.168 . ISSN 1476-5578 . ПМЦ 5794882 . ПМИД 27752075 .
- ^ Джонс Дж., Дуайер Т. (октябрь 2000 г.). «Вес при рождении, длина тела при рождении и плотность костей у детей препубертатного возраста: доказательства связи, которая может быть опосредована генетическими факторами». Кальциф. Ткань Int . 67 (4): 304–8. дои : 10.1007/s002230001148 . ПМИД 11000344 . S2CID 28607176 .
- ^ Джавайд М.К., Крозье С.Р., Харви, Северная Каролина; и др. (январь 2006 г.). «Статус витамина D у матери во время беременности и костная масса у детей в возрасте 9 лет: продольное исследование». Ланцет . 367 (9504): 36–43. дои : 10.1016/S0140-6736(06)67922-1 . ПМИД 16399151 . S2CID 6608342 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Купер С., Харви Н., Коул З., Хэнсон М., Деннисон Э. (2009). «Истоки развития остеопороза: роль материнского питания». Программирование питания на раннем этапе и результаты здоровья в дальнейшей жизни . Достижения экспериментальной медицины и биологии. Том. 646. стр. 31–9. дои : 10.1007/978-1-4020-9173-5_3 . ISBN 978-1-4020-9172-8 . ПМИД 19536660 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ричардс М., Харди Р., Кух Д., Уодсворт М.Е. (январь 2001 г.). «Вес при рождении и когнитивные функции в британской когорте 1946 года рождения: продольное популяционное исследование» . БМЖ . 322 (7280): 199–203. дои : 10.1136/bmj.322.7280.199 . ПМК 26584 . ПМИД 11159613 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ганнелл Д., Харрисон Дж., Уитли Э., Льюис Дж., Тайнелиус П., Расмуссен Ф. (ноябрь 2005 г.). «Связь роста плода и детства с риском шизофрении. Когортное исследование с участием 720 000 шведских мужчин и женщин». Шизофр. Рез . 79 (2–3): 315–22. doi : 10.1016/j.schres.2005.07.022 . ПМИД 16125903 . S2CID 20845635 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Лукас А. (февраль 1998 г.). «Программирование ранним питанием: экспериментальный подход» . Дж. Нутр . 128 (2 доп.): 401S–406S. дои : 10.1093/jn/128.2.401S . ПМИД 9478036 .
- ^ Мехединт М.Г., Никулеску М.Д., Крачунеску К.Н., Зейсель Ш.Х. (январь 2010 г.). «Дефицит холина изменяет глобальное метилирование гистонов и эпигенетическую маркировку в сайте Re1 гена кальбиндина 1» . ФАСЕБ Дж . 24 (1): 184–95. дои : 10.1096/fj.09-140145 . ПМК 2797040 . ПМИД 19752176 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Эйзенбарт Г.С. (1986). «Сахарный диабет I типа. Хроническое аутоиммунное заболевание». N Engl J Med . 314 (21): 1360–8. дои : 10.1056/NEJM198605223142106 . ПМИД 3517648 .
- ^ Зиглер А.Г., Шмид С., Хубер Д., Хаммел М., Бонифачо Э. (2003). «Раннее вскармливание младенцев и риск развития аутоантител, связанных с диабетом 1 типа». ДЖАМА . 290 (13): 1721–8. дои : 10.1001/jama.290.13.1721 . ПМИД 14519706 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Дэвис CD, Росс SA (февраль 2007 г.). «Диетические компоненты влияют на модификации гистонов и риск рака» . Нутр. Преподобный . 65 (2): 88–94. дои : 10.1111/j.1753-4887.2007.tb00285.x . ПМИД 17345961 .
- ^ Мартин Дж. Ф.; Джонстон CR; Хан КТ; Бенишек Д.С. (апрель 2000 г.). «Пищевые причины резистентности к инсулину: крысиная модель для людей, склонных к диабету. 2000» . Дж Нутр . 130 (4): 741–44. дои : 10.1093/jn/130.4.741 . ПМИД 10736323 .
- ^ Самбрано Э; Мартинес-Самайоа, премьер-министр; Баутиста CJ; и др. (июль 2005 г.). «Половые различия в трансгенерационных изменениях роста и метаболизма у потомства (F2) самок (F1) крыс, получавших низкобелковую диету во время беременности и лактации» . Дж. Физиол. (Лондон.) . 566 (Часть 1): 225–36. дои : 10.1113/jphysicalol.2005.086462 . ПМЦ 1464716 . ПМИД 15860532 .
- ^ Jump up to: а б Харрисон, М; Лэнгли-Эванс, Южная Каролина (2009). «Межпоколенческое программирование нарушения нефрогенеза и гипертонии у крыс после ограничения материнского белка во время беременности» . Дж. Нутр . 101 (7): 1020–30. дои : 10.1017/S0007114508057607 . ПМЦ 2665257 . ПМИД 18778527 .
- ^ Jump up to: а б Бенишек ДК; Джонстон CS; Мартин Дж. Ф. (май 2006 г.). «Метаболизм глюкозы изменяется у получающих адекватное питание потомков (поколение F3) крыс, истощенных во время беременности и перинатальной жизни. 2006» . Диабетология . 49 (5): 1117–19. дои : 10.1007/s00125-006-0196-5 . ПМИД 16557373 .
- ^ Бердж GC; Слейтер-Джеффрис Дж; Торренс С; Филлипс Э.С.; Хэнсон М.А.; Лилликроп КА (март 2007 г.). «Ограничение белка в рационе беременных крыс поколения F0 индуцирует измененное метилирование промоторов печеночных генов у потомства взрослых самцов поколений F1 и F2. 2007» . Бр Дж Нутр . 97 (3): 435–9. дои : 10.1017/S0007114507352392 . ПМК 2211514 . ПМИД 17313703 .
- ^ Болокер Дж., Герц С.Дж., Симмонс Р.А. (май 2002 г.). «Гестационный диабет приводит к развитию диабета у взрослых крыс. 2002». Диабет . 51 (5): 1499–1506. дои : 10.2337/диабет.51.5.1499 . ПМИД 11978648 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б с д и ж Фернандес-Твинн DS, Ozanne SE (ноябрь 2010 г.). «Питание в раннем возрасте и метаболическое программирование» . Энн. Н-Й акад. Наука . 1212 (1): 78–96. Бибкод : 2010NYASA1212...78F . дои : 10.1111/j.1749-6632.2010.05798.x . ПМИД 21070247 .
- ^ Никулеску, доктор медицинских наук, Зейсель С.Х. (август 2002 г.). «Диета, доноры метила и метилирование ДНК: взаимодействие между пищевыми фолатами, метионином и холином» . Дж. Нутр . 132 (8 дополнений): 2333S–2335S. дои : 10.1093/jn/132.8.2333S . ПМИД 12163687 .
- ^ Уотерленд Р.А., Йиртл Р.Л. (август 2003 г.). «Мобильные элементы: цели раннего воздействия питания на эпигенетическую регуляцию генов. 2003» . Мол. Клетка. Биол . 23 (15): 5293–5300. дои : 10.1128/MCB.23.15.5293-5300.2003 . ПМК 165709 . ПМИД 12861015 .
- ^ Сив К.С., Ндлову М.Н., Хагеман Г., Ванден Берге В. (декабрь 2010 г.). «Природа или воспитание: пусть еда станет вашим эпигенетическим лекарством при хронических воспалительных заболеваниях. 2010» (PDF) . Биохим. Фармакол . 80 (12): 1816–32. дои : 10.1016/j.bcp.2010.07.029 . ПМИД 20688047 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Барнетт М., Бермингем Э., Макнабб В., Бассетт С., Армстронг К., Раунс Дж., Рой Н. (август 2010 г.). «Исследование микроэлементов и эпигенетических механизмов в отношении воспалительных заболеваний кишечника». Мутат. Рез . 690 (1): 71–80. дои : 10.1016/j.mrfmmm.2010.02.006 . ПМИД 20188748 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Зейзель С (2011). «Что метаболизм холина может рассказать нам о механизмах, лежащих в основе нарушений алкогольного спектра плода» . Мол. Нейробиол . 44 (2): 185–91. дои : 10.1007/s12035-011-8165-5 . ПМЦ 3605552 . ПМИД 21259123 .
- ^ Jump up to: а б Фергюсон-Смит AC, Патти МЭ (2011). «Ты — то, что ел твой отец» . Клеточные метаб . 13 (2): 115–7. дои : 10.1016/j.cmet.2011.01.011 . ПМИД 21284975 .
- ^ Нг С.Ф., Лин Р.К., Лэйбатт Д.Р., Баррес Р., Оуэнс Дж.А., Моррис М.Дж. (октябрь 2010 г.). «Хроническая диета с высоким содержанием жиров у отцов программирует дисфункцию β-клеток у потомства самок крыс. 2010». Природа . 467 (7318): 963–966. дои : 10.1038/nature09491 . ПМИД 20962845 . S2CID 4308799 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )