Перманганат магния
| |
| Идентификаторы | |
|---|---|
| |
3D model ( JSmol )
|
|
| ХимическийПаук |
|
| Информационная карта ECHA | 100.030.740 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
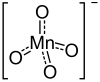
| Mg(MnO 4 ) 2 | |
| растворимый | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Перманганат магния – неорганическое соединение с химической формулой Mg(MnO 4 ) 2 . Его можно использовать в качестве окислителя. [ 1 ]
Подготовка
[ редактировать ]Гексагидрат перманганата магния был получен Э. Мицерлихом и Х. Ашоффом путем взаимодействия перманганата бария с сульфатом магния: [ 2 ]
- MgSO 4 + Ba(MnO 4 ) 2 → Mg(MnO 4 ) 2 + BaSO 4
Его можно получить реакцией хлорида магния и перманганата серебра :
- MgCl 2 + 2AgMnO 4 → Mg(MnO 4 ) 2 + 2AgCl
гексагидрат Mg(MnO 4 ) 2 ·6H 2 O, который малогигроскопичен. Из раствора можно кристаллизовать [ 3 ] Безводную форму можно получить разложением гексагидрата нагреванием.
Химические свойства
[ редактировать ]Шестиводный перманганат магния представляет собой твердое вещество сине-черного цвета. [ 4 ] Он разлагается при 130 ° C с выделением кислорода в процессе автокаталитического разложения. Тетрагидрат разлагается при температуре выше 150 °C. Кристаллы практически нерастворимы в трихлориде углерода , четыреххлористом углероде , бензоле , толуоле , нитробензоловом эфире, лигроине и сероуглероде , но растворимы в пиридине и ледяной уксусной кислоте . Он растворяется в воде и полностью диссоциирует в разбавленных растворах. Он окисляет ряд органических соединений и мгновенно реагирует (в некоторых случаях с возгоранием) с обычными растворителями, такими как тетрагидрофуран , этанол , метанол , трет-бутанол , ацетон и уксусная кислота . [ 2 ]
Приложения
[ редактировать ]Перманганат магния применяется в различных отраслях промышленности и техники, таких как: [ 2 ]
- средство для пропитки древесины.
- добавка в табачные фильтры.
- в качестве катализатора при окислении толуола на воздухе до бензойной кислоты и в исследованиях протеома .
Ссылки
[ редактировать ]- ^ Сол Вулф, Кристофер Ф. Ингольд (декабрь 1983 г.). «Окисление органических соединений перманганатом цинка» . Журнал Американского химического общества . 105 (26): 7755–7757. дои : 10.1021/ja00364a054 . ISSN 0002-7863 . Архивировано из оригинала 24 октября 2019 г. Проверено 27 июня 2020 г.
- ^ Перейти обратно: а б с Котай, Ласло; Гач, Иштван; Саджо, Иштван Э.; Шарма, Прадип К.; Банерджи, Калян К. (29 марта 2011 г.). «ХимИнформ Аннотация: Убеждения и факты в химии перманганатов - обзор синтеза и реакционной способности простых и сложных перманганатов» . ХимИнформ . 42 (13): нет. дои : 10.1002/chin.201113233 .
- ^ Моулс, Э.; Креспи, М. Перманганаты. III. Анналы Испанского королевского общества физики и химии , 1923. 21. 305–316. ISSN: 0365-6675.
- ^ Хейнс, Уильям М. (22 июня 2016 г.). CRC Справочник по химии и физике . ЦРК Пресс. ISBN 978-1-4987-5429-3 .