фосфетан

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
фосфетан | |
| Идентификаторы | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 3 Ч 7 П | |
| Молярная масса | 74.063 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
фосфетан [ 1 ] представляет собой 4-членный фосфорорганический гетероцикл . Исходная молекула фосфетана, имеющая формулу C 3 H 7 P, на один атом больше, чем фосфираны , на один меньше, чем фосфолы , и является аналогом азетидинов с тяжелым атомом . О первом известном синтезе фосфетана сообщили в 1957 году Косолапов и Штрук . [ 2 ] но метод был неэффективен и его трудно воспроизвести: выход редко превышал 1%. Гораздо более эффективный метод был описан в 1962 году Макбрайдом. [ 3 ] метод которого позволил провести первые исследования физических и химических свойств фосфетанов. Фосфетаны представляют собой хорошо изученный класс молекул, которые нашли широкое применение в качестве химических строительных блоков, реагентов для органического/неорганического синтеза и лигандов в координационной химии.
Синтез
[ редактировать ]С 1957 года было разработано множество методов синтеза фосфетанов. Наиболее часто используются следующие.
Метод Макбрайда (электрофильное присоединение к олефинам)
[ редактировать ]Метод, первоначально изложенный Макбрайдом, был разработан для сингулярных алкенов , а также диенов. Оба типа следуют одному и тому же общему механизму: образование катиона фосфина из дихлорфосфина и трихлорида алюминия, электрофильное присоединение алкена к фосфению, перегруппировка карбокатиона , внутримолекулярное нуклеофильное присоединение нового алкилфосфина к карбокатиону и окисление образующегося фосфетана. с водой для получения оксида фосфетана . Ограничениями этого подхода являются непредсказуемая перегруппировка карбокатионов в более сложно разветвленных алканах, несовместимость карбокатионов со многими нуклеофильными функциональными группами и риск тушения катионов путем элиминирования . [ 3 ]
Моноеновое присоединение
[ редактировать ]В случае электрофильного присоединения одного алкена [ 3 ] [ 4 ] перегруппировка карбокатионов происходит посредством гидридных или алкильных сдвигов. Общая схема синтеза фосфетана из моноенов приведена ниже:

Диеновое присоединение
[ редактировать ]В случае электрофильного присоединения диена [ 5 ] [ 6 ] Перегруппировка карбокатионов сначала происходит посредством катион-π-циклизации. Общая схема синтеза фосфетана из диенов приведена ниже:

Алкилирование и внутримолекулярная циклизация
[ редактировать ]Пути алкилирования и циклизации были разработаны как для фосфинов, так и для оксидов фосфина.
Из фосфинов
[ редактировать ]Синтез фосфетанов путем Р(III)-алкилирования и последующей циклизации обычно протекает путем последовательного фосфанид /фосфинового замещения 1,3-алкилдигалогенидов или сульфонатных эфиров (ОТф, ОТс, ОМ и др.). [ 7 ] [ 8 ] [ 9 ] [ 10 ] Источником фосфанида обычно является соль лития, но его также можно получить путем депротонирования фосфинов in situ. Механизм S N 2 , связанный с этой трансформацией, обладает преимуществом стереоспецифичности , но за счет толерантности к электрофильным или эпимеризуемым функциональным группам и кинетически медленной реакционной способности со вторичными/третичными уходящими группами. Общий механизм показан ниже:

Из оксидов фосфина
[ редактировать ]Подобные синтезы из соединений P(V) известны, но встречаются гораздо реже из-за их относительной неэффективности и непредсказуемости. [ 2 ] Этот препарат характеризуется образованием реактива Гриньяра in situ с последующим внутримолекулярным присоединением/циклизацией до оксида фосфина, все на основе н-пропильной цепи. Именно этот метод применили Косолапов и Штрук при первом синтезе фосфетана. Общий механизм показан ниже:

Циклопропановое расширение кольца
[ редактировать ]Другой способ получения фосфетанов связан с расширением кольца циклопропанов , при котором , по-видимому, фосфин непосредственно вставляется в связь CC. [ 11 ] [ 12 ] Истинный механизм этого преобразования аналогичен механизму синтеза Макбрайда и иногда классифицируется как таковой, со схожими преимуществами и недостатками. Хотя снятие напряжения циклопропанового кольца оказывает большую помощь в первоначальной связи CP, часто требуется исчерпывающее алкильное замещение для стабилизации образовавшегося карбокатиона. Общий механизм показан ниже:

[2+2] циклоприсоединение
[ редактировать ]который был обнаружен, является [2+2] -циклоприсоединение фосфаалкенов Одним из последних методов получения фосфетанов , и олефинов. Этот метод часто не обсуждается из-за его склонности к образованию фосфетанов, а скорее из-за его понимания реакционной способности гораздо более неуловимых фосфаалкенов. Трудный синтез этих фосфаалкенов серьезно ограничивает применимость метода в отношении синтеза фосфетана, несмотря на его привлекательный стереоспецифичный и модульный подход. Обычно это связано с фосфором, связанным с кислотой Льюиса, и может происходить с богатыми электронами фосфаалкенами и бедными электронами олефинами. [ 13 ] или обратное. [ 14 ] Пример каждого из них и механизм показаны ниже:

Структура и связь
[ редактировать ]Экспериментальные и кристаллографические данные существуют для многих типов фосфетана, перечисленных ниже, однако вся геометрическая и электронная ( ВЗМО и НСМО ) информация, приведенная ниже, была определена теоретически B3LYP. с помощью функционала [ 15 ] [ 16 ] [ 17 ] [ 18 ] и базовый набор DEF2-SVP [ 19 ] с использованием ORCA (5.0.3) [ 20 ] для родительской молекулы в каждом координационном числе, чтобы обеспечить общую и последовательную тенденцию в качестве введения в предмет. Геометрии и орбитальные графики были созданы с использованием Авогадро (4.1). [ 21 ]
Дикоординированные фосфетаны
[ редактировать ]Хотя в литературе редко сообщается, если вообще сообщается, дикоординированные фосфетаны архетипов фосфениевых, фосфанидных и фосфорных радикалов теоретически возможны в качестве временных реакционноспособных промежуточных продуктов. Их оптимизированная физическая и электронная геометрия представлена главным образом для сравнения с более часто наблюдаемыми три-, тетра- и пентакоординатными фосфетанами.
Ион фосфения
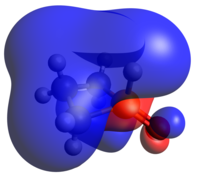
[ редактировать ]Фосфениевый корпус изоэлектронен циклическому карбену . Оптимизированная геометрия довольно плоская по сравнению с другими двухкоординатными случаями: ее HOMO и LUMO представляют собой экзоциклическую неподеленную пару и пустую p-орбиталь соответственно.
-
Оптимизированная геометрия
-
ГОМО
-
СВЕТ
Фосфорный радикал
[ редактировать ]Оптимизированная геометрия и граничные молекулярные орбитали для двухкоординированного радикала фосфора аналогичны случаю фосфения. Кольцо стало немного менее плоским, и ВЗМО теперь представляет собой однозанятую р-орбиталь. Единственная пара — HOMO-1.
-
Оптимизированная геометрия
-
ГОМО
-
СВЕТ
Фосфанид-ион
[ редактировать ]Фосфанидный корпус изоэлектронен циклическим эфирам . В этом ионе имеется значительно больше складок внутри фосфетанового кольца, а также расширение угла CPC, но ВЗМО и ВЗМО-1 аналогичны радикальному случаю, теперь оба заняты дважды.
-
Оптимизированная геометрия
-
ГОМО
-
СВЕТ
Трехкоординированные фосфетаны
[ редактировать ]Трехкоординированные фосфетаны хорошо известны в литературе и являются примером классического тригонально-пирамидального фосфорного центра P(III). конформационная изомерия , хотя и с очень низким кинетическим барьером (~ 2,45 ккал/моль для данного примера). В этих трехкоординированных молекулах присутствует [ 22 ] в котором водород может быть псевдоосным (как показано) или псевдоэкваториальным. Псевдоаксиальный конформер является более стабильным из двух. Поскольку неподеленная пара больше, она занимает псевдоэкваториальное положение, но оно довольно быстро переворачивается из-за минимизации стерического столкновения, когда R становится больше, чем H. Фосфетановое кольцо сморщено, а не плоское, из-за асимметрии выше и ниже кольца около фосфора. Как и ожидалось, ВЗМО представляет собой нуклеофильную неподеленную пару, обычно связанную с фосфинами.
-
Оптимизированная геометрия
-
ГОМО
-
СВЕТ
Тетракоординированные фосфетаны
[ редактировать ]Тетракоординированные фосфетаны представляют собой, безусловно, наиболее часто наблюдаемую геометрию вокруг фосфорного центра, обычно в виде повсеместного центра оксида фосфора P (V), но нередко в виде ионов фосфетана.
Фосфетаний-ион
[ редактировать ]Фосфетаний изоэлектронен тетракоординированному углероду и принимает его тетраэдрическую геометрию, значительно выравнивая кольцо за счет увеличения молекулярной симметрии. Отклонение от этого могло бы произойти при любой замене одного из атомов водорода на более объемную группу, после чего кольцо сморщилось бы с более крупным заместителем псевдоэкваториальным. Кислотность ; водородов α-углерода значительно увеличивается из-за движущей силы нейтрализации заряда это отражается на вкладе CH σ-разрыхления связи в LUMO.
-
Оптимизированная геометрия
-
ГОМО
-
СВЕТ
оксид фосфетана
[ редактировать ]Другое классическое соединение фосфора — тетраэдрический оксид фосфина P(V). Как и трехкоординированные фосфетаны, оксиды фосфетана также проявляют изомерию, на этот раз с гораздо большим кинетическим барьером. Когда оксид псевдоэкваториальный (как показано), обозначается транс , а когда оксид псевдоаксиальный, соединение обозначается цис . Предпочтение одного перед другим во многом основано на замещении углерода в середине, а не на оксиде. [ 23 ] Как и следовало ожидать от ковалентно связанного оксида, ВЗМО представляет собой неподеленную пару кислорода, а НСМО в значительной степени зависит от π-разрыхляющего взаимодействия PO.
-
Оптимизированная геометрия
-
ГОМО
-
СВЕТ
Пентакоординированные фосфетаны
[ редактировать ]Пентакоординированные фосфетаны, или фосфораны, представляют собой альтернативную геометрическую мантию, в которой может существовать фосфорный центр P (V). Важно отметить, что этот класс фосфоранов обычно не тригонально-бипирамидальный, а ближе к квадратно-пирамидальному. Результатом этого геометрического возмущения является появление σ-разрыхляющих связей PH, которые широко представлены в LUMO, что объясняет характерную кислотность Льюиса для квадратно-пирамидальных фосфоранов.
-
Оптимизированная геометрия
-
ГОМО
-
СВЕТ
Шестикоординированные фосфетаны
[ редактировать ]Гексакоординированные анионные фосфаты в основном известны в литературе как противоионы ( гексафторфосфат ), но теоретически возможны как реакционноспособные интермедиаты ассоциативных механизмов в фосфорных центрах. В этом соединении фосфор принимает ожидаемую октаэдрическую геометрию. Как и ожидалось для этого гексакоординированного фосфата, σ-связывающие орбитали CH включают ВЗМО, что обеспечивает ожидаемую гидрированность из-за благоприятной нейтрализации заряда. Подобно двухкоординатному случаю, эта оптимизированная физическая и электронная геометрия представлена главным образом для сравнения с более часто наблюдаемыми три-, тетра- и пентакоординатными фосфетанами.
-
Оптимизированная геометрия
-
ГОМО
-
СВЕТ
Реактивность
[ редактировать ]Фосетаны проявляют широкий диапазон реакционной способности и упоминаются в литературе во многих различных аспектах химической реакции. Есть случаи, когда фосфетаны сами по себе являются интересующим субстратом, случаи, когда фосфетаны наблюдаются как временные промежуточные продукты во время химической реакции, случаи, когда фосфетаны используются в качестве активных реагентов в химических реакциях, и случаи, когда фосфетаны связываются с металлом, который является активный реагент в данном процессе. Все эти всеобъемлющие сценарии обсуждаются более подробно ниже.
Присущая реактивность
[ редактировать ]Большая часть реакционной способности, присущей фосфетановым субстратам или проявляемой непосредственно на них, является одой его кольцевой деформации, рассчитанной как ~ 17,9 ккал / моль. [ 22 ] Высвобождение части или всей этой энергии деформации приводит к двум характерным типам наблюдаемой реактивности: расширению кольца и раскрытию кольца. Реакционная способность фосфорного центра, включая восстановление, окисление и образование фосфорана, а также алкилирование атомов углерода кольца, в некоторых случаях может осуществляться без расщепления кольца, что представляет собой конечный тип собственной реакционной способности. Эти четыре будут обсуждаться более подробно ниже.
Реакции раскрытия кольца
[ редактировать ]Реакции раскрытия фосфетанового кольца в прошлом представляли синтетический интерес как потенциальный метод создания полипропилфосфиновых полимеров и материалов, но, несмотря на происходящие реакции раскрытия кольца, полимеризация такого материала наблюдалась лишь изредка в очень концентрированных растворах. [ 8 ] [ 24 ]

Основное наблюдение открытия кольца является побочным продуктом других предполагаемых реакций, таких как окисление фосфетана. [ 25 ] [ 26 ] и функционализация α-углерода. [ 27 ]

Один преднамеренный и конструктивный метод раскрытия цикла был описан в литературе и включает фосфетанилид , который подвергается реакции Виттига с альдегидами с образованием γ-ненасыщенных оксидов фосфина. [ 28 ]

Реакции расширения кольца
[ редактировать ]Существуют методы расширения кольца для внедрения атомов углерода, кислорода и азота в фосфетановые кольца с получением соответствующих фосфолов, но они имеют ограниченное синтетическое применение из-за их непредсказуемой стерео- и региоселективности в отношении несимметричных фосфетанов. Внедрение углерода (иногда известное как перегруппировка Аллена-Миллара-Триппа ) обычно включает добавление воды к фосфетанию, имеющему уходящую группу. [ 25 ] или пи-система [ 29 ] [ 25 ] (обычно еноны, но также и фенильные группы) от альфа до фосфора, который высвобождается в результате миграции алкила после распада оксида фосфетана.

Введение кислорода в связь PC оксида фосфетана осуществляется с помощью mCPBA и происходит по неизвестному в настоящее время механизму с необычно высокой региоселективностью для менее замещенного углерода. [ 30 ] [ 31 ]

Внедрение атома азота происходит в результате фотолиза оксида азидофосфетана, предположительно в результате перегруппировки типа Курциуса из образовавшегося нитрена . Хотя это предлагаемый механизм, существуют явные сомнения относительно промежуточного соединения N=P=O. [ 32 ] [ 33 ]

Реакционная способность по фосфору
[ редактировать ]Окислительно-восстановительный процесс между фосфетанами P(III) и оксидами фосфетана P(V) возможен и хорошо документирован благодаря использованию мягких реагентов, таких как кислород или вода и гидриды кремния, для достижения окисления и восстановления соответственно.

Более интересным является синтез стабильных 5-координационных фосфетанов ( фосфоранов ) как из традиционных фосфинов P(III), так и из оксидов фосфина P(V), в дополнение к ионам фосфетана P(V), с помощью пары общих методов. Что касается фосфиновых субстратов, то синтез фосфорана обычно происходит путем реакции с пероксидами / дисульфидами. [ 34 ] [ 35 ] [ 36 ] или перфтор π-системы, такие как перфторацетон, [ 37 ] механизм которого не выяснен, или перфтор-1,3-бутадиен. [ 38 ]

Методы получения фосфоранов из оксидов P(V) и фосфетаний обычно заключаются в ступенчатом пути дезоксигенирования - нуклеофильного присоединения. [ 39 ] или пути прямого присоединения, [ 28 ] соответственно. Нуклеофилы обычно представляют собой галогениды или алкокси-функциональные группы, и в случае дезоксигенирования-замещения два нуклеофила могут быть либо связанными (например, катехол ), либо нет.

Функционализация α-углерода
[ редактировать ]Последней частью свойственной фосфетанам реакционной способности, которая будет обсуждаться, является функционализация альфа-углеродов оксида фосфетана, почти всегда посредством депротонирования литийорганическими реагентами с последующим замещением S N 2 алкилгалогенида. [ 40 ] Использование хиральных аксиллярий фосфора может сделать этот процесс стереоселективным. [ 41 ] [ 42 ]

Реактивные промежуточные продукты
[ редактировать ]Появление фосфетанов и их производных хорошо описано в литературе по органической химии в качестве реакционноспособных промежуточных продуктов множества различных процессов. Эти процессы включают, помимо прочего, химические процессы Виттига , Хорнера-Уодсворта-Эммонса , Кори-Фукса и Зейферта-Гилберта . Все эти процессы включают образование in-situ и разложение промежуточных продуктов оксафосфетана по путям метатезисного типа с образованием алкенов или алкинов из альдегидов и фосфорного реагента.
Реагенты и катализаторы
[ редактировать ]С начала 2010-х годов был достигнут значительный прогресс в разработке фосфетанов в качестве полезных реагентов и катализаторов, дополняющих катализаторы на основе переходных металлов в органическом синтезе. Эти усилия в первую очередь были предприняты исследовательской группой доктора Александра Радосевича. [ 43 ] [ 44 ] [ 45 ] [ 46 ] [ 47 ] [ 48 ] в Университете штата Пенсильвания , а затем в Массачусетском технологическом институте , но вклад лаборатории доктора Томаса Вернера [ 49 ] [ 50 ] в Leibniz-Institut für Katalyse (Институт катализа Лейбница) также оказали большое влияние. Общей темой, лежащей в основе этих работ, является восстановительное воздействие активных частиц фосфетана на субстрат, что приводит к образованию оксида фосфетана и желаемого продукта с последующим восстановлением оксида фосфетана обратно в фосфетан с помощью мягкого гидрида кремния, который замыкает каталитический цикл.

Нехарактерная бифильная природа этих фосфинов и других нетригональных соединений пниктогена является результатом нарушения молекулярной симметрии . [ 51 ] в данном случае это вызвано кольцевой деформацией, присущей фоспетанам. Большинство этих превращений исследуются на основе стехиометрической реакционной способности фосфетана, что иллюстрирует их полезность в качестве катализаторов или реагентов в случае несовместимости субстрата с гидридом. Ниже приведен общий каталитический цикл и сокращенный список реакций, которые можно катализировать этим методом.

Лиганды комплексов переходных металлов
[ редактировать ]Комплексы переходных металлов с лигированными фосфетанами P(III) известны для вольфрама, [ 52 ] железо, [ 53 ] [ 54 ] [ 13 ] молибден, [ 55 ] [ 8 ] платина, [ 24 ] рутений, [ 56 ] [ 57 ] родий, [ 58 ] [ 57 ] [ 59 ] палладий, [ 42 ] [ 56 ] [ 60 ] иридий, [ 42 ] и, возможно, более того, для получения ахиральных , рацемических и оптически чистых координационных комплексов. Несмотря на эти усилия, сложные детали их природы как лигандов и воздействия на металлцентры, поскольку они отличаются от традиционных фосфинов, относительно недостаточно изучены. Прямое сравнение классических комплексов бис-триалкилфосфиндихлорплатины(II) с соответствующим фосфетансодержащим комплексом, возможно, указывает на ослабление σ- транс-эффекта и π-акцепторного характера фосфетанового лиганда, скорее всего, из-за упомянутого выше нарушения симметрии, что подтверждается короткими Pt-P (2,208 и 2,210 ангстрем) и Pt-Cl (2,342 и 2,355 ангстрем) связи. [ 24 ] Чтобы сделать это утверждение категорическим, необходима дополнительная работа.
Большая часть исследований и интереса к фосфетанам как лигандам связана с их способностью придавать энантиоселективность определенным каталитическим гидрированиям . [ 61 ] снижение, [ 60 ] и π-аллил [ 62 ] реакции при использовании соответствующих хиральных фосфетанов. Как и в случае большинства асимметричных катализов, наблюдаемая энантио- или диастереоселективность объясняется неблагоприятным стерическим взаимодействием между хиральными лигандами, субстратом и другими реагентами, хотя кажется, что использование более традиционных хиральных фосфинов оказалось более популярным, чем использование хиральных фосфетанов. Ниже приведены избранные примеры энантиоселективного катализа с использованием фосфетановых лигандов.

Ссылки
[ редактировать ]- ^ Маринетти, Анджела; Кармайкл, Дункан (1 января 2002 г.). «Синтез и свойства фосфетанов» . Химические обзоры . 102 (1): 201–230. дои : 10.1021/cr990135r . ISSN 0009-2665 . ПМИД 11782133 .
- ^ Перейти обратно: а б Косолапов Геннадий М.; Страк, Роберт Ф. (1 января 1957 г.). «736. Константы диссоциации некоторых циклических фосфиновых кислот» . Журнал Химического общества (обновленный) : 3739–3740. дои : 10.1039/JR9570003739 . ISSN 0368-1769 .
- ^ Перейти обратно: а б с Юнгерманн, Эрик; Макбрайд, Джей-Джей; Клаттер, Р.; Маис, Аго (февраль 1962 г.). «Новая реакция фосфорилирования олефинов. I. Область применения реакции» . Журнал органической химии . 27 (2): 606–610. дои : 10.1021/jo01049a063 . ISSN 0022-3263 .
- ^ Вилкас, Эрна; Вилкас, Мишель; Жонио, Дениз; Паскар-Билли, Клодин (1 января 1978 г.). «1-Изопропил-4,6-диметил-6-фосфа(V)бицикло[3.1.1]гепт-3-ен-6-оксид: искаженный фосфетан, синтезированный из α-пинена и комплекса дихлорида метилфосфоновой кислоты с хлоридом алюминия; X -лучевой кристалл и молекулярная структура» . Журнал Химического общества, Химические коммуникации (3): 125–126. дои : 10.1039/C39780000125 . ISSN 0022-4936 .
- ^ Вайсман, Стивен А.; Бакстер, СГ; Ариф, Атта М.; Коули, Алан Х. (1 января 1986 г.). «Реакция иона галогенофосфения с циклоокта-1,5-диеном; прямой синтез и рентгенокристаллическая структура фосфетанового фрагмента» . Журнал Химического общества, Chemical Communications (14): 1081–1082. дои : 10.1039/C39860001081 . ISSN 0022-4936 .
- ^ Коули, Алан Х.; Стюарт, Константин А.; Уиттлси, Брюс Р.; Райт, Томас К. (1 января 1984 г.). «Синтез фосфорного гетероцикла с использованием ионов фосфена и 1,4-диенов» . Буквы тетраэдра . 25 (8): 815–816. дои : 10.1016/S0040-4039(01)80034-4 . ISSN 0040-4039 .
- ^ Берглунд, Донна; Мик, Девон В. (январь 1968 г.). «Координация положительно заряженным фосфорным лигандом» . Журнал Американского химического общества . 90 (2): 518–519. дои : 10.1021/ja01004a071 . ISSN 0002-7863 .
- ^ Перейти обратно: а б с Хоклесс, Дэвид CR; Канг, Ю Бенг; Макдональд, Марк А.; Пабель, Майкл; Уиллис, Энтони К.; Уайлд, С. Брюс (20 февраля 1996 г.). «Прямой синтез 1-фенилфосфетана и 1-фенилфосфирана. Кристаллические и молекулярные структуры нейтральных и катионных комплексов-предшественников циклотримеризации» . Металлоорганические соединения . 15 (4): 1301–1306. дои : 10.1021/om9507336 . ISSN 0276-7333 .
- ^ Маринетти, Анджела; Крюгер, Вирджиния; Бузин, Франсуа-Ксавье (28 апреля 1997 г.). «Синтез хиральных фосфетанов» . Буквы тетраэдра . 38 (17): 2947–2950. дои : 10.1016/S0040-4039(97)00508-X . ISSN 0040-4039 .
- ^ Имамото, Цунео; Охаси, Ацуши; Мацукава, Сатору (2000). «Улучшенный синтез 1-адамантилфосфина и его использование в синтезе циклических фосфинов, содержащих 1-адамантильную группу» . Гетероциклы . 52 (2): 905. doi : 10.3987/COM-99-S58 (неактивен 17 февраля 2024 г.). ISSN 0385-5414 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на февраль 2024 г. ( ссылка ) - ^ Вайсман, Стивен А.; Бакстер, С.Г. (1 января 1988 г.). «Введение электрофильного фосфора в циклопропаны; новый синтез фосфатанов» . Буквы тетраэдра . 29 (11): 1219–1222. дои : 10.1016/S0040-4039(00)80260-9 . ISSN 0040-4039 .
- ^ Вайсман, Стивен А.; Бакстер, СГ (1 января 1987 г.). «Циклоприсоединение ионов фосфена к норборнадиену и квадрициклану» . Буквы тетраэдра . 28 (6): 603–606. дои : 10.1016/S0040-4039(00)95791-5 . ISSN 0040-4039 .
- ^ Перейти обратно: а б Вебер, Лотар; Схеффер, Матиас Х.; Бекманн, Эйке; Штаммлер, Ханс-Георг; Нойманн, Беате (1 июня 1997 г.). «Ацилфосфаны и фосфаалкены, замещенные переходными металлами. 32.1. Преобразование звена FePC фосфаалкена в фрагмент FeP CNNC путем удлинения цепи путем внедрения 1,3-диполя (- NN(Ar)CH +) сиднонов. " . Металлоорганические соединения . 16 (13): 2958–2962. дои : 10.1021/om9700876 . ISSN 0276-7333 .
- ^ Маринетти, Анджела; Мэти, Франсуа (1 января 1990 г.). «[2 + 2] Циклоприсоединения между бедными электронами фосфа-алкеновыми комплексами и богатыми электронами алкенами или алкинами, новый путь к фосфетановым и 1,2-дигидрофосфетным кольцам» . Журнал Химического общества, Химические коммуникации (2): 153–154. дои : 10.1039/C39900000153 . ISSN 0022-4936 .
- ^ Бекке, Аксель Д. (1 апреля 1993 г.). «Термохимия с функциональной плотностью. III. Роль точного обмена» . Журнал химической физики . 98 (7): 5648–5652. Бибкод : 1993JChPh..98.5648B . дои : 10.1063/1.464913 . ISSN 0021-9606 . S2CID 52389061 .
- ^ Ли, Ченгтех; Ян, Вэйтао; Парр, Роберт Г. (15 января 1988 г.). «Развитие корреляционно-энергетической формулы Колле-Сальветти в функционал от электронной плотности» . Физический обзор B . 37 (2): 785–789. Бибкод : 1988PhRvB..37..785L . дои : 10.1103/PhysRevB.37.785 . ПМИД 9944570 .
- ^ Воско, С.Х.; Уилк, Л.; Нусайр, М. (1 августа 1980 г.). «Точные корреляционные энергии электронной жидкости, зависящие от спина, для расчета локальной спиновой плотности: критический анализ» . Канадский физический журнал . 58 (8): 1200–1211. Бибкод : 1980CaJPh..58.1200V . дои : 10.1139/p80-159 . ISSN 0008-4204 . S2CID 122287164 .
- ^ Стивенс, П.Дж.; Девлин, Ф.Дж.; Чабаловский, CF; Фриш, MJ (ноябрь 1994 г.). «Ab Initio Расчет спектров поглощения колебаний и кругового дихроизма с использованием полей функциональных сил плотности» . Журнал физической химии . 98 (45): 11623–11627. дои : 10.1021/j100096a001 . ISSN 0022-3654 . S2CID 97035345 .
- ^ Вейгенд, Флориан; Альрикс, Рейнхарт (30 августа 2005 г.). «Сбалансированные базисные наборы расщепленной валентности, тройной дзета-валентности и четверной дзета-валентности качества от H до Rn: разработка и оценка точности» . Физическая химия Химическая физика . 7 (18): 3297–3305. Бибкод : 2005PCCP....7.3297W . дои : 10.1039/B508541A . ISSN 1463-9084 . ПМИД 16240044 .
- ^ Низ, Фрэнк (январь 2012 г.). «Программная система ORCA» . WIREs Вычислительная молекулярная наука . 2 (1): 73–78. дои : 10.1002/wcms.81 . ISSN 1759-0876 . S2CID 62137389 .
- ^ Ханвелл, Маркус Д.; Кертис, Дональд Э.; Лони, Дэвид С.; Вандермеерш, Тим; Журек, Ева; Хатчисон, Джеффри Р. (13 августа 2012 г.). «Avogadro: продвинутый семантический химический редактор, платформа визуализации и анализа» . Журнал хеминформатики . 4 (1): 17. дои : 10.1186/1758-2946-4-17 . ISSN 1758-2946 . ПМК 3542060 . ПМИД 22889332 .
- ^ Перейти обратно: а б Бахрах, Стивен М. (ноябрь 1989 г.). «Теоретические исследования фосфирана и фосфетана» . Журнал физической химии . 93 (23): 7780–7784. дои : 10.1021/j100360a011 . ISSN 0022-3654 .
- ^ Кэмпбелл, Дж.А.; Коглан, Китай; Фицджеральд, А.; Кампана, К.; Кремер, ЮВ (15 ноября 1984 г.). «Строение 1-трет-бутил-2,2,3,4,4-пентаметилфосфетан-1-оксида, C12H25OP» . Acta Crystallographica Раздел C: Связь с кристаллической структурой . 40 (11): 1918–1920. Бибкод : 1984AcCrC..40.1918C . дои : 10.1107/S0108270184010052 . ISSN 0108-2701 .
- ^ Перейти обратно: а б с Тумас, Уильям; Хуанг, Жан С.; Фанвик, Филипп Э.; Кубяк, Клиффорд П. (август 1992 г.). «Синтез и реакционная способность циклических фосфетанов. Олигомеризация, кватернизация и комплексообразование с платиной (II)» . Металлоорганические соединения . 11 (8): 2944–2947. дои : 10.1021/om00044a042 . ISSN 0276-7333 .
- ^ Перейти обратно: а б с Корфилд, младший; Харгер, MJP; Шатт, младший; Триппет, С. (1 января 1970 г.). «Дальнейшие открытия колец и расширения колец фосфетанов» . Журнал Химического общества C: Organic (13): 1855–1860. дои : 10.1039/J39700001855 . ISSN 0022-4952 .
- ^ Эззелл, БР (июль 1970 г.). «Щелочное расщепление оксидов фосфетана» . Журнал органической химии . 35 (7): 2426–2428. дои : 10.1021/jo00832a079 . ISSN 0022-3263 .
- ^ Кремер, Шелдон Э.; Коулз, Джон М.; Фарр, Фрэнк Р.; Хван, Хай Ок; Кремер, Пол В.; Петерсон, Эндрю С.; Грей, Джордж А. (январь 1992 г.). «Получение, реакции и стереохимия 4-метил-4-фосфаттрацикло[3.3.0.02,8.03,6]октан-4-оксида и производных» . Журнал органической химии . 57 (2): 511–522. дои : 10.1021/jo00028a022 . ISSN 0022-3263 .
- ^ Перейти обратно: а б Брауэр, Дэвид Дж.; Чикку, Антонелла Дж.; Хесслер, Гисберт; Штельцер, Отмар (сентябрь 1992 г.). «Новые синтезы и реакции плоскокаркасных фосфетаниевых солей» . Химические отчеты . 125 (9): 1987–1997. дои : 10.1002/cber.19921250904 . ISSN 0009-2940 .
- ^ Хоуз, В.; Триппет, С. (1 января 1969 г.). «Некоторые реакции замещения по фосфору 2,2,3,4,4-пентаметилфосфетанов» . Журнал Химического общества C: Organic (11): 1465–1468. дои : 10.1039/J39690001465 . ISSN 0022-4952 .
- ^ Куин, Луи Д.; Кисалус, Джон К.; Меш, Кейт А. (декабрь 1983 г.). «Внедрение кислорода в углерод-фосфорные связи некоторых напряженных фосфорных гетероциклов» . Журнал органической химии . 48 (24): 4466–4472. дои : 10.1021/jo00172a005 . ISSN 0022-3263 .
- ^ Шевчик, Ежи; И Эн-Юнь Яо; Куин, Луи Д. (сентябрь 1990 г.). «Синтез оксидов 1,2-оксаффолана путем внедрения кислорода в CP-связь оксидов фосфетана» . Фосфор, сера и кремний и родственные элементы 54 (1–4): 135–141. дои : 10.1080/10426509008042130 . ISSN 1042-6507 .
- ^ Уайзман, Джеффри; Вестхаймер, FH (июнь 1974 г.). «Фотолиз 1-азидо-2,2,3,4,4-пентаметилфосфетан-1-оксида. Мономерный метафосфонимидат» . Журнал Американского химического общества . 96 (13): 4262–4268. дои : 10.1021/ja00820a033 . ISSN 0002-7863 .
- ^ Харгер, Мартин Дж. П. (1 января 1974 г.). «Фотолиз оксидов 1-азидофосфетана: расширение кольца до 2-оксидов 2-метокси-1,2-азафосфолидина и раскрытие кольца до метилалк-илфосфонамидатов в метаноле» . Журнал Химического общества, Perkin Transactions 1 : 2604–2609. дои : 10.1039/P19740002604 . ISSN 1364-5463 .
- ^ Денни, Дональд Б.; Денни, Дороти З.; Уайт, Деннис В. (апрель 1971 г.). «Удивительно легкое псевдовращение фосфоранов с четырехчленным кольцом» . Журнал Американского химического общества . 93 (8): 2066–2067. дои : 10.1021/ja00737a047 . ISSN 0002-7863 .
- ^ Денни, Д.Б.; Денни, ДЗ; Холл, компакт-диск; Марси, КЛ (январь 1972 г.). «Получение и химия некоторых циклических фосфоранов» . Журнал Американского химического общества . 94 (1): 245–249. дои : 10.1021/ja00756a043 . ISSN 0002-7863 .
- ^ Беррос, Байрон К.; Де'Ат, Норман Дж.; Денни, Дональд Б.; Денни, Дороти З.; Кипнис, Ирвинг Дж. (ноябрь 1978 г.). «Получение и химия некоторых фосфоранов, содержащих фосфорно-серные связи» . Журнал Американского химического общества . 100 (23): 7300–7304. дои : 10.1021/ja00491a029 . ISSN 0002-7863 .
- ^ Орам, Роберт К.; Триппетт, Стюарт (1 января 1973 г.). «Реакции 1-замещенных 2,2,3,4,4-пентаметилфосфетанов с гексафторацетоном и спектры ядерного магнитного резонанса 19F полученных 1,3,2-диоксафосфоланов» . Журнал Химического общества, Perkin Transactions 1 : 1300–1310. дои : 10.1039/P19730001300 . ISSN 1364-5463 .
- ^ Денни, DB; Денни, ДЗ; Сюй, Ю. Ф. Фосфор, 1974 , 4 , 217.
- ^ Анчак, Стивен; Триппетт, Стюарт (1 января 1978 г.). «Синтез пятивалентных фосфоранов из оксидов фосфина» . Журнал Химического общества, Perkin Transactions 1 (11): 1326–1330. дои : 10.1039/P19780001326 . ISSN 1364-5463 .
- ^ Маринетти, Анджела; Рикар, Луи (1 января 1993 г.). «Синтез и характеристика некоторых п-метилфосфетанов, нового класса богатых электронами хиральных фосфинов» . Тетраэдр . 49 (45): 10291–10304. дои : 10.1016/S0040-4020(01)80558-5 . ISSN 0040-4020 .
- ^ Маринетти, Анджела; Бузен, Франсуа-Ксавье; Рикар, Луи (24 марта 1997 г.). «Синтез и α-алкилирование 1-ментилфосфетансульфида» . Тетраэдр . 53 (12): 4363–4370. дои : 10.1016/S0040-4020(97)00132-4 . ISSN 0040-4020 .
- ^ Перейти обратно: а б с Маринетти, Анджела; Рикар, Луи (октябрь 1994 г.). «Фосфетаны как хиральные лиганды для каталитических асимметричных реакций: гидросилилирование олефинов» . Металлоорганические соединения . 13 (10): 3956–3962. дои : 10.1021/om00022a035 . ISSN 0276-7333 .
- ^ Хон, Сын Юн; Радосевич, Александр Т. (25 мая 2022 г.). «Хемоселективное первичное аминирование арилбороновых кислот с помощью P III / PV = O-катализа: синтетический захват временного промежуточного Nef HNO» . Журнал Американского химического общества . 144 (20): 8902–8907. дои : 10.1021/jacs.2c02922 . ISSN 0002-7863 . ПМЦ 9133210 . ПМИД 35549268 .
- ^ Ли, Ген; Канда, Юзуру; Хон, Сын Юн; Радосевич, Александр Т. (11 мая 2022 г.). «Возможность восстановительного перекрестного взаимодействия C–N нитроалканов и бороновых кислот с помощью стерического дизайна катализаторов P (III) / P (V) = O» . Журнал Американского химического общества . 144 (18): 8242–8248. дои : 10.1021/jacs.2c01487 . ISSN 0002-7863 . ПМЦ 9119554 . ПМИД 35499970 .
- ^ Липшульц, Джеффри М.; Радосевич, Александр Т. (15 сентября 2021 г.). «Объединение синтеза амида и активации с помощью P III / PV – катализируемой последовательной конденсации: трехкомпонентная сборка 2-амидопиридинов» . Журнал Американского химического общества . 143 (36): 14487–14494. дои : 10.1021/jacs.1c07608 . ISSN 0002-7863 . ПМК 9088293 . ПМИД 34478308 .
- ^ Ли, Ген; Миллер, Стивен П.; Радосевич, Александр Т. (15 сентября 2021 г.). «P III / PV = O-катализируемое образование межмолекулярной связи N – N: перекрестно-селективное восстановительное соединение нитроаренов и анилинов» . Журнал Американского химического общества . 143 (36): 14464–14469. дои : 10.1021/jacs.1c07272 . ISSN 0002-7863 . ПМЦ 8454687 . ПМИД 34473484 .
- ^ Ли, Ген; Цинь, Цзыян; Радосевич, Александр Т. (23 сентября 2020 г.). «P(III)/P(V)-катализируемое метиламинирование арилбороновых кислот и сложных эфиров: восстановительное сочетание C – N с нитрометаном в качестве заменителя метиламина» . Журнал Американского химического общества . 142 (38): 16205–16210. дои : 10.1021/jacs.0c08035 . ISSN 0002-7863 . ПМК 7531042 . ПМИД 32886500 .
- ^ Ныказа, Тревор В.; Купер, Джулиан К.; Ли, Ген; Махье, Нолвенн; Рамирес, Антонио; Лузун, Майкл Р.; Радосевич, Александр Т. (14 ноября 2018 г.). «Межмолекулярное восстановительное перекрестное сочетание C – N нитроаренов и бороновых кислот путем катализа P III / PV = O» . Журнал Американского химического общества . 140 (45): 15200–15205. дои : 10.1021/jacs.8b10769 . ISSN 0002-7863 . ПМК 6235741 . ПМИД 30372615 .
- ^ Лонгвиц, Ларс; Вернер, Томас (10 февраля 2020 г.). «Восстановление активированных алкенов с помощью окислительно-восстановительного циклического катализа P III / PV» . Angewandte Chemie, международное издание . 59 (7): 2760–2763. дои : 10.1002/anie.201912991 . ISSN 1433-7851 . ПМК 7027467 . ПМИД 31793147 .
- ^ Лонгвиц, Ларс; Спанненберг, Анке; Вернер, Томас (04 октября 2019 г.). «Оксиды фосфетана как катализаторы окислительно-восстановительного цикла в каталитической реакции Виттига при комнатной температуре» . АКС-катализ . 9 (10): 9237–9244. дои : 10.1021/acscatal.9b02456 . ISSN 2155-5435 . S2CID 202880682 .
- ^ Ли, Кёнхун; Блейк, Анастасия В.; Тануши, Акира; Маккарти, Шон М.; Ким, Дэниел; Лория, Сидней М.; Донахью, Кортни М.; Шпильфогель, Кайл Д.; Кейт, Джейсон М.; Дейли, Скотт Р.; Радосевич, Александр Т. (20 мая 2019 г.). «Подтверждение бифильной гипотезы нетригональных соединений фосфора (III)» . Angewandte Chemie, международное издание . 58 (21): 6993–6998. дои : 10.1002/anie.201901779 . ISSN 1433-7851 . ПМК 6513703 . ПМИД 30901511 .
- ^ Роде, Удо; Рут, Фрэнк; Джонс, Питер; Штребель, Райнер (18 января 1999 г.). «Формирование и структура первого 7-аза-1-фосфанорборнадиенового комплекса» . Angewandte Chemie, международное издание . 38 (1–2): 215–217. doi : 10.1002/(SICI)1521-3773(19990115)38:1/2<215::AID-ANIE215>3.0.CO;2-Y .
- ^ Бадер, Армин; Патхак, Девендра Д.; Уайлд, С. Брюс; Уиллис, Энтони К. (1 января 1992 г.). «Дальтоновские связи. Реакции координированных фосфинов и арсинов. Облегченный железом (II) синтез 1-фенилфосфетана и 1-фениларсетана» . Журнал Химического общества, Dalton Transactions (10): 1751–1752. дои : 10.1039/DT9920001751 . ISSN 1364-5447 .
- ^ Бадер, Армин; Канг, Ю Бенг; Пабель, Майкл; Патхак, Девендра Д.; Уиллис, Энтони К.; Уайлд, С. Брюс (март 1995 г.). «Реакции координированных фосфинов и арсинов. Облегченный железом (II) и прямой синтез трех- и семичленных гетероциклов, содержащих фосфор и мышьяк. Кристаллические структуры комплексов железа (II) с 1-фенилфосфетаном и 1-фениларсетаном» . Металлоорганические соединения . 14 (3): 1434–1441. дои : 10.1021/om00003a051 . ISSN 0276-7333 .
- ^ Канг, Ю Бенг; Пабель, Майкл; Уиллис, Энтони К.; Уайлд, С. Брюс (1 января 1994 г.). «Прямой синтез 1-фенилфосфетана и 1-фенилфосфирана. Кристаллические и молекулярные структуры комплексов-предшественников циклотримеризации fac-[Mo(CO)3(PhPCH2CH2CH2)3] и fac-[Mo(CO)3(PhPCH2CH2)3]» . Журнал Химического общества, Химические коммуникации (4): 475–476. дои : 10.1039/C39940000475 . ISSN 0022-4936 .
- ^ Перейти обратно: а б Маринетти, Анджела; Джус, Себастьян; Жене, Джон Питер; Рикар, Луи (1 января 2000 г.). «Дополнительные данные по синтезу и свойствам хиральных 1,2-бис(фосфетано)бензолов» . Тетраэдр 56 (1): 95–100. дои : 10.1016/S0040-4020(99) 00777-2 ISSN 0040-4020 .
- ^ Перейти обратно: а б Маринетти, А. (октябрь 1998 г.). «Несимметричные бидентатные лиганды, несущие хиральные фосфетановые звенья» . Синтез . 1998 (10): 1539–1543. дои : 10.1055/с-1998-2169 . S2CID 196780633 .
- ^ Маринетти, Анджела; Жюс, Себастьян; Лабрю, Фрэнсис; Лемаршан, Од; Жене, Жан-Пьер; Рикар, Луи (2001). «Синтез и характеристика монофосфинов и аминофосфинов, несущих хиральные фосфетановые звенья» . Синтез . 2001 (14): 2095–2104. дои : 10.1055/s-2001-18064 .
- ^ Маринетти, Анджела; Ле Менн, Клод; Рикар, Луи (ноябрь 1995 г.). «Моно- и биядерные комплексы родия хирального 1,1-дифосфина. Синтез и кристаллические структуры» . Металлоорганические соединения . 14 (11): 4983–4985. дои : 10.1021/om00011a006 . ISSN 0276-7333 .
- ^ Перейти обратно: а б Маринетти, Анджела; Жюс, Себастьян; Жене, Жан-Пьер; Рикар, Луи (1 апреля 2001 г.). «Хиральные 1,2-бис(фосфетано)этаны» . Журнал металлоорганической химии . 624 (1): 162–166. дои : 10.1016/S0022-328X(00)00910-4 . ISSN 0022-328X .
- ^ Маринетти, Анджела; Жюс, Себастьен; Жене, Жан-Пьер (26 ноября 1999 г.). «Исследование асимметричного гидрирования, стимулируемого родий-фосфетановыми комплексами» . Буквы тетраэдра . 40 (48): 8365–8368. дои : 10.1016/S0040-4039(99)01767-0 . ISSN 0040-4039 .
- ^ Маринетти, Анджела; Крюгер, Вирджиния; Рикар, Луи (15 февраля 1997 г.). «Новые хиральные фосфетаны: синтез и использование в катализируемом палладием аллильном алкилировании» . Журнал металлоорганической химии . 529 (1): 465–472. дои : 10.1016/S0022-328X(96)06563-1 . ISSN 0022-328X .