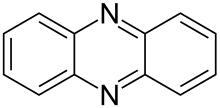
Феназин
| |

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
Феназин [ 1 ] | |
| Другие имена
Дибензопиразин
9,10-Диазаантрацен Азофенилен акридизин | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.001.995 |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 12 Ч 8 Н 2 | |
| Молярная масса | 180.21 g/mol |
| Появление | кристаллический порошок от желтого до коричневого цвета |
| Плотность | 1,25 г/см 3 |
| Температура плавления | 174–177 ° C (345–351 ° F; 447–450 К) |
| Точка кипения | 357,2 ° C (675,0 ° F; 630,3 К) при 760 мм рт. ст. |
| нерастворим в воде | |
| Опасности | |
| точка возгорания | 160,3 ° С (320,5 ° F; 433,4 К) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Феназин – органическое соединение формулы (C 6 H 4 ) 2 N 2 . Это дибензоаннелированный пиразин и исходное вещество многих красителей , таких как толуиленовый красный , индулины и сафранины (и близкородственные эвродины). [ 2 ] Феназин кристаллизуется в виде желтых игл, которые лишь умеренно растворяются в спирте . Серная кислота растворяет его, образуя раствор темно-красного цвета.
Синтез
[ редактировать ]Классически феназин получают реакцией нитробензола и анилина по реакции Воля-Ауэ . Другие методы включают в себя:
- пиролиз бариевой соли азобензоата
- окисление анилина оксидом свинца
- окисление дигидрофеназина, который получают нагреванием пирокатехина с о -фенилендиамином .
- окисление орто-аминодифениламина пероксидом свинца .
Производные
[ редактировать ]- Более сложные феназины, такие как нафтофеназины , нафтазины и нафтотолазины , можно получить конденсацией орто-диаминов с орто-хинонами. [ 3 ] или окислением орто -диамина в присутствии α- нафтола и разложением орто-анилидо-(-толуидидо-и так далее) -азосоединений разбавленными кислотами .
- При использовании алкил- или арил-орто-диаминов азониевые основания получаются . Азины преимущественно желтого цвета, перегоняются в неизмененном виде и устойчивы к окислителям . Они легко присоединяют алкилиодиды , образуя алкилазониевые соли, ангидрида также происходит образование причем между этими гидроксильными группами . Растворяется в концентрированной серной кислоте с желтовато-зеленой флуоресценцией .
- Родамины . , близкие к фталеинам, образуются при конденсации алкилметаминофенолов с фталевым ангидридом в присутствии серной кислоты Их соли представляют собой прекрасные красные красители. При входе амино- или гидроксильных в молекулу групп образуются красители. Моноаминопроизводные или евроходины получают конденсацией арилмонаминов с ортоаминоазосоединениями; конденсацией дихлоримида хинона или пара-нитрозодиметиланилина с монаминами, содержащими свободное пара-положение, или окислением ортогидроксидиаминодипбениламинов. Это желтовато-красные твердые вещества, которые ведут себя как слабые основания , их соли подвергаются гидролитической диссоциации в водном растворе . При нагревании с концентрированной соляной кислотой аминогруппа заменяется гидроксильной группой и фенольные евродолы . образуются
Аминофеназин
[ редактировать ]
Многие аминофеназины являются яркими красителями. Двумя первыми синтетическими красителями являются аминофеназины, к ним относятся идулин и нигрозин . [ 2 ]
Симметричный ( диаминофеназин является исходным веществом важного красителя нейтрального красного цвета диметилдиаминотолуфеназина). Его получают окислением орто-фенилендиамина хлоридом железа .
В аналогичном процессе окисление холодной смеси пара -аминодиметиланилина и мета -толуилендиамина дает толуиленовый синий. Этот индамин образуется как промежуточный продукт и при кипячении переходит в красный цвет; а также окислением диметилпарафенилендиатнина метатолуилендиамином. Он кристаллизуется в виде оранжево-красных иголок, а его спиртовой раствор сильно флуоресцирует. Он окрашивает шелк и протравленный хлопок в прекрасный алый цвет. В коммерческом отношении он известен как нейтральный красный . феназония Чтобы узнать о солях , см. сафранин . Бензо[c]циннолин представляет собой изомер феназина, к которому он имеет такое же отношение, как фенантрен к антрацену .
Натуральные продукты
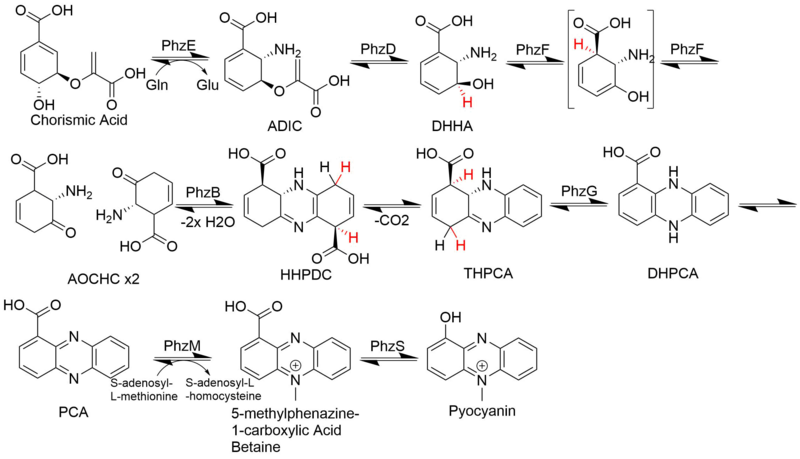
[ редактировать ]Известные биологические источники феназиновых соединений имеют преимущественно бактериальную природу. [ 4 ] Некоторые из родов, которые, как известно, производят феназины, включают виды Pseudomonas , виды Streptomyces и Pantoea agglomerans . Эти натуральные продукты феназина участвуют в вирулентности и конкурентоспособности организмов-продуцентов. Например, феназин пиоцианин, продуцируемый Pseudomonas aeruginosa, способствует его способности колонизировать легкие пациентов с муковисцидозом . Точно так же феназин-1-карбоновая кислота, продуцируемая рядом псевдомонад, увеличивает выживаемость в почвенной среде и, как было показано, необходима для биологического контроля активности некоторых штаммов. [ 5 ] [ 6 ] [ 7 ]
В то время как бактериальные феназины в основном участвуют во вторичном метаболизме, метанофеназин у метаногенных архей ( метаногенов ) участвует в первичном метаболизме и является важным переносчиком электронов. [ 8 ] Метанофеназин действует как функциональный эквивалент менахинонов и убихинонов в других организмах. Метанофеназин — это единственный известный феназин небактериального происхождения, а также единственный феназин, который участвует в первичном метаболизме. [ 9 ]
Биосинтез
[ редактировать ]Биосинтез феназина ответвляется от пути шикимовой кислоты в точке, следующей за хоризмовой кислотой . Две молекулы этого промежуточного соединения, полученного из хоризмата, затем соединяются диагонально-симметрично, образуя основной феназиновый каркас. Последовательные модификации затем приводят к появлению множества феназинов с различной биологической активностью . Примерами феназиновых алкалоидов являются пиоцианин , сафеновая кислота и эсмеральдины .
Ссылки
[ редактировать ]- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 211. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
- ^ Jump up to: а б Хорст Бернет (2012). «Азиновые красители». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a03_213.pub3 . ISBN 978-3527306732 .
- ^ Александр Р. Суррей (1955). «Пиоцианин» . Органические синтезы ; Сборник томов , т. 3, с. 753 .
- ^ Пирсон, Леланд С.; Пирсон, Элизабет А. (2010). «Метаболизм и функции феназинов у бактерий: влияние на поведение бактерий в окружающей среде и биотехнологических процессах» . Прикладная микробиология и биотехнология . 86 (6): 1659–1670. дои : 10.1007/s00253-010-2509-3 . ISSN 0175-7598 . ПМЦ 2858273 . ПМИД 20352425 .
- ^ Тернер, Дж. М. и Эй. Дж. Мессенджер (1986). Возникновение, биохимия и физиология производства феназинового пигмента . Достижения микробной физиологии. Том. 27. С. 211–275. дои : 10.1016/S0065-2911(08)60306-9 . ISBN 978-0-12-027727-8 . ПМИД 3532716 .
- ^ Макдональд М., Мавроди Д.В.; и др. (2001). «Биосинтез феназина у Pseudomonas fluorescens: точка ветвления от первичного пути биосинтеза шикимата и роль феназин-1,6-дикарбоновой кислоты». Дж. Ам. хим. Соц. 123 (38): 9459–9460. дои : 10.1021/ja011243 . ПМИД 11562236 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Дитрих Л.Е., Окегбе С., Прайс-Уилан А., Сахта Х., Хантер Р.К., Ньюман Д.К. (2013). «Морфогенез бактериального сообщества тесно связан с внутриклеточным окислительно-восстановительным состоянием» (PDF) . Журнал бактериологии . 195 (7): 1371–80. дои : 10.1128/JB.02273-12 . ПМЦ 3624522 . ПМИД 23292774 .
- ^ Бейфусс, Уве; Титце, Марио; Боймер, Себастьян; Деппенмайер, Уве (17 июля 2000 г.). «Метанофеназин: структура, общий синтез и функция нового кофактора из метаногенных архей». Angewandte Chemie, международное издание . 39 (14): 2470–2472. doi : 10.1002/1521-3773(20000717)39:14<2470::aid-anie2470>3.0.co;2-r . ISSN 1433-7851 . ПМИД 10941105 .
- ^ Бейфусс, Уве; Титце, Марио (26 января 2005 г.), Мульцер, Иоганн (редактор), «Метанофеназин и другие природные биологически активные феназины» , Natural Products Synthesis II , vol. 244, Берлин, Гейдельберг: Springer Berlin Heidelberg, стр. 77–113, doi : 10.1007/b96889 , ISBN 978-3-540-21124-2 , получено 3 июля 2022 г.
В эту статью включен текст из публикации, которая сейчас находится в свободном доступе : Чисхолм, Хью , изд. (1911). « Феназин ». Британская энциклопедия . Том. 21 (11-е изд.). Издательство Кембриджского университета. стр. 364–365.