Эпигенетика депрессии
Эта статья нуждается в более надежных медицинских ссылках для проверки или слишком сильно полагается на первоисточники . ( сентябрь 2018 г. ) |  |
Эпигенетика депрессии — это исследование того, как эпигенетика (наследственные характеристики, не связанные с изменениями в последовательности ДНК) способствуют депрессии.
На большое депрессивное расстройство сильно влияют экологические и генетические факторы. Эти факторы включают эпигенетическую модификацию генома, которая может привести к стойкому изменению экспрессии генов без изменения фактической последовательности ДНК. Генетические факторы и факторы окружающей среды могут влиять на геном на протяжении всей жизни; однако человек наиболее восприимчив в детстве. [ 1 ] Стрессы в раннем возрасте, которые могут привести к большому депрессивному расстройству, включают периодическое разлуку с матерью, жестокое обращение с детьми, развод и утрату. [ 2 ] [ 3 ] Эти факторы могут привести к появлению эпигенетических меток, которые могут изменить экспрессию генов и повлиять на развитие ключевых областей мозга, таких как гиппокамп. [ 4 ] [ 2 ] Эпигенетические факторы, такие как метилирование ДНК , могут служить потенциальными предикторами эффективности некоторых антидепрессантов, а также демонстрировать связь с симптомами депрессии. [ 5 ] [ 3 ] Применение антидепрессантов также может быть связано с изменением уровня метилирования ДНК. [ 6 ] Идентификация гена с измененной экспрессией может привести к созданию новых методов лечения антидепрессантами. [ 3 ]
Эпигенетические изменения при депрессии
[ редактировать ]Гистоновые деацетилазы
[ редактировать ]Гистондеацетилазы (HDAC) представляют собой класс ферментов, удаляющих ацетильные группы из гистонов . Различные HDAC играют разную роль в ответ на депрессию, и эти эффекты часто различаются в разных частях тела. В прилежащем ядре (NaC) обычно обнаруживается, что ацетилирование H3K14 снижается после хронического стресса (используемого для создания депрессивно-подобного состояния в модельных системах грызунов). Однако через некоторое время это ацетилирование снова начинает усиливаться и коррелирует со снижением активности и продукции HDAC2 . [ 7 ] Добавление HDAC2i ( ингибитора HDAC2 ) приводит к улучшению симптомов депрессии в модельных системах животных. [ 4 ] Более того, мыши с доминантно-негативной мутацией HDAC2, которая подавляет ферментативную активность HDAC2, обычно демонстрируют менее депрессивное поведение, чем мыши, у которых нет этой доминантно-негативной мутации. [ 8 ] HDAC5 демонстрирует противоположную тенденцию в NaC. Недостаток HDAC5 приводит к усилению депрессивного поведения. Считается, что это связано с тем, что мишени HDAC2 обладают антидепрессивными свойствами, а мишени HDAC5 обладают депрессантными свойствами. [ 4 ]
В гиппокампе существует корреляция между снижением ацетилирования и депрессивным поведением в ответ на стресс. Например, было обнаружено снижение ацетилирования H3K14 и H4K12, а также общего ацетилирования гистонов H2B и H3 . [ 9 ] [ 10 ] [ 11 ] Другое исследование показало, что уровень HDAC3 снижается у людей, устойчивых к депрессии. В гиппокампе обнаружено повышение HDAC5 при усилении депрессивного поведения (в отличие от прилежащего ядра). [ 4 ] [ 11 ] [ 12 ]
Гистоновые метилтрансферазы
[ редактировать ]Подобно HDAC, гистоновые метилтрансферазы (HMT) изменяют гистоны, но эти ферменты участвуют в переносе метильных групп гистонов к остаткам аргинина и лизина . Было обнаружено, что хронический стресс снижает уровни ряда HMT, таких как G9a , в NAc восприимчивых мышей. [ 13 ] И наоборот, у устойчивых мышей эти HMT обладают повышенной активностью. H3K9 и H3K27 имеют меньшее метилирование, когда наблюдается депрессивное поведение. В гиппокампе также происходит ряд изменений метилирования гистонов: триметилирование H3K27 гипометилируется в ответ на стресс, тогда как триметилирование H3K9 и триметилирование H3K4 гиперметилируются в ответ на кратковременный стресс. Однако триметилирование H3K9 и триметилирование H3K4 также могут быть гипометилированы в ответ на хронический длительный стресс. В целом стресс, приводящий к депрессии, коррелирует со снижением метилирования и снижением активности ГМТ. [ нужна ссылка ]
Нейротрофический фактор головного мозга
[ редактировать ]Нейротрофический фактор головного мозга (BDNF) — это нейротрофический фактор роста , который играет важную роль в памяти, обучении и высшем мышлении. Было обнаружено, что уровни BDNF в плазме и объем гиппокампа снижаются у людей с депрессией. [ 7 ] На экспрессию BDNF могут влиять различные эпигенетические модификации, а промоторы BDNF могут индивидуально регулироваться различными эпигенетическими изменениями. MeCP2 может действовать как репрессор и, как было показано, регулирует BDNF при активации. Деполяризация нейронов, вызывающая увеличение содержания кальция, приводит к фосфорилированию MeCP2, что приводит к снижению связывания MeCP2 с промотором BDNF IV. [ 14 ] Поскольку MeCP2 больше не может связываться с промотором BDNF и подавлять транскрипцию, уровни BDNF увеличиваются и улучшается развитие нейронов. При прямом метилировании промотора BDNF транскрипция BDNF подавляется. Показано, что стрессовые ситуации вызывают повышенное метилирование промотора IV BDNF, что вызывает увеличение связывания MeCP2 и, как следствие, снижение активности BDNF в гиппокампе и депрессивное поведение. BDNF поддерживает выживание нейронов в гиппокампе, а снижение его уровня может вызвать атрофию гиппокампа . Кроме того, было обнаружено повышенное метилирование CpG области IV BDNF в области Вернике головного мозга у лиц, склонных к суициду. [ 14 ] Взаимодействие BDNF и MeCP2 сложное, и есть случаи, когда MeCP2 может вызывать повышение уровней BDNF вместо репрессии. Предыдущие исследования показали, что у мышей с нокаутом MeCP2 высвобождение и транспортировка BDNF внутри нейронов в гиппокампе значительно снижены. [ 15 ] Другой эпигенетической модификацией промоторов BDNF является нейрон-рестриктивный фактор молчания ( REST или NRSF ), который эпигенетически регулирует промотор BDNF I и репрессируется MeCP2. Было обнаружено, что, как и MeCP2, REST ингибирует транскрипцию BDNF.
Гипоталамо-гипофиз-надпочечниковая ось
[ редактировать ]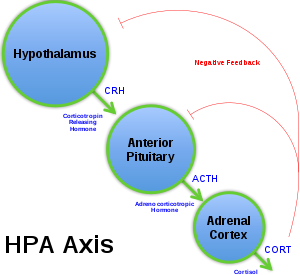
В гипоталамо-гипофизарно-надпочечниковой оси (ось HPA) кортикотропин-рилизинг-фактор (CRF) секретируется гипоталамусом в ответ на стресс и другие нормальные процессы в организме. Затем CRH действует на переднюю долю гипофиза и заставляет ее секретировать адренокортикотропный гормон (АКТГ). АКТГ действует на кору надпочечников , секретируя кортизол , который действует как индикатор отрицательной обратной связи этого пути. Когда человек подвергается стрессовым ситуациям, ось HPA активирует симпатическую нервную систему , а также увеличивает выработку CRF, АКТГ и кортизола, что, в свою очередь, повышает уровень глюкозы в крови и подавляет иммунную систему. Повышенная экспрессия CRF была обнаружена в спинномозговой жидкости у депрессивных обезьян и крыс, а также у людей с депрессией. Повышенные уровни CRF также наблюдались в гипоталамусе у людей с депрессией. [ 16 ] Установлено, что беременные мыши на ранней стадии гестации, подвергшиеся хроническому стрессу, производят потомство со сниженным метилированием промотора CRF в области гипоталамуса. [ 17 ] Это снижение метилирования может вызвать повышенную экспрессию CRF и, следовательно, повышенную активность оси HPA. Более высокие уровни оси HPA в ответ на хронический стресс также могут вызвать повреждение области гиппокампа мозга. Повышенный уровень кортизола может привести к уменьшению объема гиппокампа, что обычно наблюдается у людей с депрессией.
Нейротрофический фактор глиального клеточного происхождения
[ редактировать ]Нейротрофический фактор глиального происхождения (GDNF) представляет собой белок, который способствует выживанию и дифференцировке дофаминергических нейронов. Глядя на уровни экспрессии в прилежащем ядре, можно увидеть, что экспрессия GDNF снижается у линий мышей, чувствительных к депрессии. [ 4 ] Также было показано, что повышенная экспрессия GDNF в вентральной области покрышки присутствует у мышей, которые не восприимчивы к стрессу социального поражения , способствуя выживанию нейронов. [ 18 ] [ 19 ] Считается , что вентральная покрышка и сеть прилежащего ядра мезолимбической дофаминовой системы участвуют в устойчивости и восприимчивости к хроническому стрессу (который приводит к депрессивному поведению). Таким образом, видно, что GDNF, защищая нейроны мезолимбического пути, помогает защититься от депрессивного поведения. [ 20 ] После хронического стресса происходит ряд изменений, которые приводят к снижению уровня GDNF в прилежащем ядре. Это снижение связано со снижением ацетилирования H3 и снижением триметилирования H3K4, а также с увеличением степени метилирования ДНК в определенных сайтах CpG на промоторе GDNF. [ 20 ] Это метилирование ДНК связано с рекрутированием гистондеацетилазы 2 и метилCpG-связывающего белка 2 (MeCP2) на промотор GDNF. [ 20 ] Повышенная активность HDAC приводит к снижению экспрессии GDNF, поскольку HDAC вызывает снижение ацетилирования H3. Альтернативно, нокаут HDAC (посредством вмешательства HDAC ) приводит к нормализации уровней GDNF и, как следствие, к снижению депрессивно-подобного поведения даже у восприимчивых линий мышей. [ 21 ] Белок, связывающий элемент ответа циклического АМФ (CREB), который, как полагают, участвует в регуляции GDNF, связывается с вышеупомянутым MeCP2 и образует комплексы с метилированными сайтами CpG на промоторе GDNF. [ 22 ] [ 23 ] Это привлечение CREB играет роль в репрессии GDNF в прилежащем ядре. Еще одним доказательством того, что метилирование ДНК играет роль в депрессивном поведении, является то, что введение ингибиторов ДНК-метилтрансферазы приводит к обращению вспять депрессивно-подобного поведения.
Видно, что метилирование ДНК промоторной области GDNF приводит к привлечению MeCP2 и HDAC, что приводит к эпигенетическому изменению меток гистонов. Это коррелирует с увеличением депрессивно-подобного поведения.
Глюкокортикоидный рецептор
[ редактировать ]Глюкокортикоидные рецепторы (ГР) — это рецепторы, с которыми связывается кортизол (и другие глюкокортикоиды ). Связанный рецептор участвует в регуляции транскрипции генов. [ 4 ] [ 24 ] Область промотора гена GR имеет последовательность, которая позволяет связываться с белком А, индуцируемым фактором роста нервов транскрипционного фактора (NGFI-A), который участвует в пластичности нейронов . На крысах было показано, что у людей, менее склонных к депрессивному поведению, наблюдается повышенное связывание NGFI-A с промоторной областью гена GR, особенно в гиппокампе. В результате наблюдается повышенная экспрессия GR в гиппокампе, как в транскрипции его мРНК , так и в общем уровне белка.
Это связано с усилением ацетилирования H3K9 в промоторной области GR. Метилирование CpG-островков в промоторной области GR приводит к снижению способности NGFI-A связываться с промоторной областью GR. Также экспериментально было показано, что метилирование сайтов CpG в области энхансера, связанного с NGFI-A, вредно для способности NGFI-A связываться с областью промотора. [ 25 ] Кроме того, метилирование промоторной области приводит к снижению рекрутирования CREB -связывающего белка , который обладает способностью гистон-ацетилтрансферазы . Это приводит к меньшему ацетилированию гистонов, что, как было показано, является модификацией, происходящей у людей, менее восприимчивых к депрессии. [ 25 ]
Из-за факторов окружающей среды происходит снижение метилирования промоторной области гена GR, что затем позволяет увеличить связывание белка NGFI-A и, как следствие, увеличить экспрессию гена GR. Это приводит к снижению депрессивного поведения.
Уход
[ редактировать ]Возможно, этот раздел нуждается в реорганизации, чтобы соответствовать рекомендациям Википедии по оформлению . ( февраль 2018 г. ) |
Антидепрессанты
[ редактировать ]С помощью вычислительной методологии было обнаружено, что эпигенетика играет решающую роль в предрасположенности и развитии расстройств настроения, а также опосредует ответ на лечение препаратами СИОЗС. Лекарства СИОЗС, включая флуоксетин, пароксетин и эсциталопрам, снижают экспрессию генов и ферментативную активность, связанную с путями метилирования и ацетилирования во многих областях мозга, вовлеченных в работу пациентов с большой депрессией. [ 26 ]
Фармакогенетические исследования были сосредоточены на эпигенетических факторах, связанных с BDNF, который является биомаркером нейропсихических заболеваний. Было показано, что BDNF чувствителен к длительному воздействию стресса (общий фактор риска депрессивных фенотипов) с эпигенетическими модификациями (в первую очередь метилированием гистонов) промоторов BDNF и вариантов сплайсинга. Такие изменения в сплайсинге генов и подавлении экспрессии BDNF в гиппокампе связаны с большим депрессивным расстройством, тогда как повышенная экспрессия в этой области связана с успешным лечением антидепрессантами. [ 26 ] У пациентов с большой депрессией и биполярным расстройством наблюдается повышенное метилирование промоторов BDNF и снижение уровней мРНК BDNF в мозге и моноцитах крови, тогда как лечение СИОЗС у пациентов с депрессией приводит к снижению метилирования гистонов и повышению уровней BDNF. [ 26 ]
Помимо гена BDNF, микроРНК (миРНК) играют роль в расстройствах настроения, а уровни транскриптов предположительно влияют на эффективность лечения СИОЗС. Посмертные исследования пациентов с большим депрессивным расстройством, а также другими психическими заболеваниями показывают, что микроРНК играют решающую роль в регуляции структуры мозга посредством синаптической пластичности и нейрогенеза. [ 26 ] Повышенное развитие нейронов гиппокампа играет роль в эффективности лечения антидепрессантами, тогда как снижение такого развития связано с нервно-психическими расстройствами. [ 26 ] В частности, микроРНК MIR-16 играет решающую роль в регуляции этих процессов у людей с расстройствами настроения. Повышенный уровень MIR-16 в гиппокампе ингибирует белки, которые способствуют нейрогенезу, включая транспортер серотонина (SERT), который является мишенью терапии СИОЗС. [ 26 ] MIR-16 подавляет экспрессию SERT у людей, что уменьшает количество переносчиков серотонина. [ 26 ] Таким образом, ингибирование MIR-16 способствует выработке SERT и служит мишенью для терапии СИОЗС. [ 26 ] Препараты СИОЗС усиливают нейрогенез в гиппокампе за счет снижения уровня MIR-16, тем самым восстанавливая активность нейронов гиппокампа после лечения у пациентов с нервно-психическими расстройствами. [ 26 ] У пациентов с большим депрессивным расстройством лечение препаратами СИОЗС приводит к дифференциальной экспрессии 30 микроРНК, половина из которых играет роль в модуляции структуры нейронов и/или участвует в психических расстройствах. [ 26 ]
Понимание эпигенетических профилей пациентов с нервно-психическими расстройствами в ключевых областях мозга привело к большему знанию результатов лечения пациентов после лечения СИОЗС. Исследования полногеномных ассоциаций направлены на оценку индивидуальных полиморфизмов в генах, которые участвуют в депрессивных фенотипах, и помогают повысить эффективность фармакогенетических исследований. [ 27 ] Однонуклеотидный полиморфизм гена 5-HT(2A) коррелировал с отменой пароксетина из-за побочных эффектов в группе пожилых пациентов с большой депрессией, но не с отменой миртазапина (антидепрессанта, не относящегося к СИОЗС). Кроме того, гипометилирование промотора SERT коррелировало с плохими результатами лечения пациентов и успехом лечения после 6 недель лечения эсциталопрамом. [ 26 ] Было показано, что такая работа, посвященная закономерностям метилирования на периферии, сопоставима с закономерностями метилирования в тканях мозга и предоставляет информацию, позволяющую разработать индивидуальные фармакогенетические подходы. [ 26 ]
BDNF как модулятор серотонина
[ редактировать ]Известно, что снижение нейротрофического фактора головного мозга (BDNF) связано с депрессией. Исследования показывают, что увеличение BDNF может обратить вспять некоторые симптомы депрессии. Например, усиление передачи сигналов BDNF может обратить вспять снижение передачи сигналов в гиппокампальном мозге, наблюдаемое на животных моделях депрессии. BDNF участвует в депрессии благодаря своему влиянию на серотонин. Было показано, что BDNF способствует развитию, функционированию и экспрессии серотонинергических нейронов. [ 28 ] Поскольку более активный серотонин приводит к более позитивному настроению, антидепрессанты повышают уровень серотонина. Трициклические антидепрессанты обычно блокируют транспортеры серотонина , чтобы удерживать серотонин в синаптической щели, где он все еще активен. Норадренергические и специфические серотонинергические антидепрессанты являются антагонистами серотониновых рецепторов. Норадренергические и специфические серотонинергические антидепрессанты ( NASSA ), такие как миртазапин , и трициклические антидепрессанты, такие как имипрамин, повышали BDNF в коре головного мозга и гиппокампе крыс. [ 29 ] Поскольку уровни мРНК BDNF увеличиваются при длительном применении миртазапина, увеличение экспрессии гена BDNF может быть необходимо для улучшения депрессивного поведения. Это также увеличивает потенциал пластичности нейронов. [ 30 ] Как правило, эти антидепрессанты повышают периферические уровни BDNF за счет снижения метилирования промоторов BDNF, которые, как известно, модулируют серотонин. [ 6 ] Поскольку экспрессия BDNF увеличивается при H3K27me3 при лечении антидепрессантами, BDNF усиливает свое влияние на модуляцию серотонина. снижении [ 31 ] Он модулирует серотонин путем снижения , связанного с G-белком , 5-HT 2A уровня белка рецептора в гиппокампе. [ 32 ] Увеличение BDNF усиливает ингибирование пресинаптического захвата серотонина, что приводит к уменьшению симптомов депрессии.
Влияние антидепрессантов на глюкокортикоидные рецепторы
[ редактировать ]Увеличение связывания NGFI-A и, как следствие, увеличение экспрессии глюкокортикоидных рецепторов (GR) приводит к уменьшению депрессивно-подобного поведения. Антидепрессанты могут повышать уровень ГР у больных пациентов, подавляя симптомы депрессии. Электрошоковая терапия часто используется для лечения пациентов с депрессией. Обнаружено, что эта форма лечения приводит к увеличению уровня экспрессии NGFI-A. [ 33 ] Электрошоковая терапия деполяризует ряд нейронов по всему мозгу, что приводит к повышению активности ряда внутриклеточных путей. Сюда входит путь цАМФ [ 33 ] что за счет последующих эффектов приводит к экспрессии NGFI-A. Было обнаружено , что антидепрессанты, такие как транилципромин и имипрамин, оказывают аналогичный эффект; лечение этими препаратами привело к увеличению экспрессии NGFI-A и последующей экспрессии GR. [ 33 ] Считается, что эти два препарата изменяют синаптические уровни 5-НТ, что затем изменяет уровень активности пути цАМФ. Также известно, что повышенная экспрессия глюкокортикоидных рецепторов модулирует путь HPA за счет усиления отрицательной обратной связи. [ 33 ] Это увеличение экспрессии является результатом снижения метилирования, увеличения ацетилирования и связывания транскрипционного фактора HGFI-A. [ 24 ] Это способствует более умеренной реакции HPA, чем у людей с депрессией, что затем снижает уровень гормонов, связанных со стрессом. [ 25 ] Было обнаружено, что другой антидепрессант, дезипрамин , увеличивает плотность ГР и экспрессию мРНК ГР в гиппокампе. [ 34 ] Считается, что это происходит из-за взаимодействия между ответным элементом GR и ацетилтрансферазой, CREB-связывающим белком. Таким образом, этот антидепрессант, увеличивая ацетилирование, снижает реакцию HPA и, как следствие, уменьшает симптомы депрессии.
Ингибиторы HDAC как антидепрессанты
[ редактировать ]Было показано, что ингибиторы HDAC вызывают у животных эффекты, подобные антидепрессантам. Исследования показывают, что антидепрессанты вызывают эпигенетические изменения в транскрипции генов, тем самым изменяя передачу сигналов. Эти изменения экспрессии генов наблюдаются в генах BDNF, CRF, GDNF и GR (см. разделы выше). Постоянно сообщается, что модификации гистонов изменяют структуру хроматина во время депрессии за счет удаления ацетильных групп, а чтобы обратить это вспять, ингибиторы HDAC действуют, противодействуя удалению ацетильных групп на гистонах. Ингибиторы HDAC могут снижать транскрипцию генов в гиппокампе и префронтальной коре, усиление которой является признаком депрессии. В исследованиях депрессии на животных кратковременное введение ингибиторов HDAC уменьшало реакцию страха у мышей, а хроническое введение вызывало эффекты, подобные антидепрессантам. Это говорит о том, что длительное лечение ингибиторами HDAC помогает в лечении депрессии. Некоторые исследования показывают, что применение ингибиторов HDAC, таких как вориностат и Ромидепсин , гематологические противораковые препараты, может усиливать эффект других антидепрессантов. Эти ингибиторы HDAC могут стать антидепрессантами в будущем, но клинические испытания должны дополнительно оценить их эффективность на людях. [ 35 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Хайм С., Биндер Э.Б. (январь 2012 г.). «Текущие тенденции исследований стресса и депрессии в раннем возрасте: обзор исследований на людях чувствительных периодов, взаимодействия генов и окружающей среды и эпигенетики». Экспериментальная неврология . 233 (1): 102–11. дои : 10.1016/j.expneurol.2011.10.032 . ПМИД 22101006 . S2CID 42993795 .
- ^ Перейти обратно: а б Тойокава С., Уддин М., Коэнен К.К., Галеа С. (январь 2012 г.). «Как социальная среда «попадает в сознание»? Эпигенетика на стыке социальной и психиатрической эпидемиологии» . Социальные науки и медицина . 74 (1): 67–74. doi : 10.1016/j.socscimed.2011.09.036 . ПМК 3246041 . ПМИД 22119520 .
- ^ Перейти обратно: а б с Виалоу В., Фенг Дж., Робисон А.Дж., Нестлер Э.Дж. (2013). «Эпигенетические механизмы депрессии и антидепрессивное действие» . Ежегодный обзор фармакологии и токсикологии . 53 (1): 59–87. doi : 10.1146/annurev-pharmtox-010611-134540 . ПМЦ 3711377 . ПМИД 23020296 .
- ^ Перейти обратно: а б с д и ж Сан Х., Кеннеди П.Дж., Нестлер Э.Дж. (январь 2013 г.). «Эпигенетика депрессивного мозга: роль ацетилирования и метилирования гистонов» . Нейропсихофармакология . 38 (1): 124–37. дои : 10.1038/нпп.2012.73 . ПМК 3521990 . ПМИД 22692567 .
- ^ Пеннер-Гёк С., Биндер Э.Б. (декабрь 2019 г.). «Эпигенетика и депрессия» . Диалоги в клинической неврологии . 21 (4): 397–405. doi : 10.31887/DCNS.2019.21.4/ebinder . ISSN 1958-5969 . ПМЦ 6952745 . ПМИД 31949407 .
- ^ Перейти обратно: а б Менке А., Биндер Э.Б. (сентябрь 2014 г.). «Эпигенетические изменения при депрессии и лечении антидепрессантами» . Диалоги в клинической неврологии . 16 (3): 395–404. дои : 10.31887/DCNS.2014.16.3/аменке . ПМК 4214180 . ПМИД 25364288 .
- ^ Перейти обратно: а б Ковингтон Х.Э., Мейз И., ЛаПлан, королевский адвокат, Виалоу В.Ф., Ониши Ю.Н., Бертон О., Фасс Д.М., Рентал В., Раш А.Дж., Ву Э.И., Гоуз С., Кришнан В., Руссо С.Дж., Тамминга С., Хаггарти С.Дж., Нестлер Э.Дж. (сентябрь 2009 г.) ). «Антидепрессивное действие ингибиторов гистондеацетилазы» . Журнал неврологии . 29 (37): 11451–60. doi : 10.1523/JNEUROSCI.1758-09.2009 . ПМК 2775805 . ПМИД 19759294 .
- ^ Учида С., Хара К., Кобаяши А., Оцуки К., Ямагата Х., Хобара Т., Сузуки Т., Мията Н., Ватанабэ Ю. (январь 2011 г.). «Эпигенетический статус Gdnf в вентральном полосатом теле определяет восприимчивость и адаптацию к ежедневным стрессовым событиям» . Нейрон . 69 (2): 359–72. дои : 10.1016/j.neuron.2010.12.023 . ПМИД 21262472 .
- ^ Ковингтон Х.Э., Виалу В.Ф., ЛаПлан К., Ониши Ю.Н., Нестлер Э.Дж. (апрель 2011 г.). «Гиппокамп-зависимая антидепрессантоподобная активность ингибирования деацетилазы гистонов» . Письма по неврологии . 493 (3): 122–6. дои : 10.1016/j.neulet.2011.02.022 . ПМК 3074929 . ПМИД 21335060 .
- ^ Холлис Ф., Дюклот Ф., Гунджан А., Каббадж М. (март 2011 г.). «Индивидуальные различия влияния социального поражения на ангедонию и ацетилирование гистонов в гиппокампе крыс» . Гормоны и поведение . 59 (3): 331–7. дои : 10.1016/j.yhbeh.2010.09.005 . ПМК 3037445 . ПМИД 20851702 .
- ^ Перейти обратно: а б Цанкова Н.М., Кумар А., Нестлер Э.Дж. (июнь 2004 г.). «Модификации гистонов в областях промотора генов в гиппокампе крыс после острых и хронических электросудорожных припадков» . Журнал неврологии . 24 (24): 5603–10. doi : 10.1523/JNEUROSCI.0589-04.2004 . ПМЦ 6729334 . ПМИД 15201333 .
- ^ Ферланд К.Л., Шредер Л.А. (февраль 2011 г.). «Регуляция ацетилирования гистонов в гиппокампе крыс, находящихся в хроническом стрессе: потенциальная роль сиртуинов» . Нейронаука . 174 : 104–14. doi : 10.1016/j.neuroscience.2010.10.077 . ПМК 3020273 . ПМИД 21056634 .
- ^ Ковингтон Х.Э., Мейз И., Сан Х., Бомзе Х.М., ДеМайо К.Д., Ву Э.И., Дитц Д.М., Лобо М.К., Гозе С., Музон Е., Неве Р.Л., Тамминга К.А., Нестлер Э.Дж. (август 2011 г.). «Роль репрессивного метилирования гистонов в индуцированной кокаином уязвимости к стрессу» . Нейрон . 71 (4): 656–70. дои : 10.1016/j.neuron.2011.06.007 . ПМК 3163060 . ПМИД 21867882 .
- ^ Перейти обратно: а б Карпова Н.Н. (январь 2014 г.). «Роль эпигенетики BDNF в пластичности нейронов, зависящей от активности» . Нейрофармакология . 76 Ч. С: 709–18. doi : 10.1016/j.neuropharm.2013.04.002 . ПМИД 23587647 .
- ^ Сюй X, Козиковски А.П., Поццо-Миллер Л. (2014). «Селективный ингибитор гистондеацетилазы-6 улучшает транспортировку BDNF в нейронах гиппокампа у мышей с нокаутом Mecp2: последствия синдрома Ретта» . Границы клеточной нейронауки . 8 : 68. дои : 10.3389/fncel.2014.00068 . ПМЦ 3945638 . ПМИД 24639629 .
- ^ Биндер Э.Б., Немерофф CB (2010). «Система CRF, стресс, депрессия и тревога: выводы генетических исследований человека» . Молекулярная психиатрия . 15 (6): 574–88. дои : 10.1038/mp.2009.141 . ПМЦ 3666571 . ПМИД 20010888 .
- ^ Мургатройд С., Шпенглер Д. (2011). «Эпигенетика раннего развития ребенка» . Фронтовая психиатрия . 2 : 16. doi : 10.3389/fpsyt.2011.00016 . ПМК 3102328 . ПМИД 21647402 .
- ^ Кришнан В., Хан М.Х., Грэм Д.Л., Бертон О., Рентал В., Руссо С.Дж., Лаплант К., Грэм А., Люттер М., Лагас Д.К., Гоуз С., Рейстер Р., Таннус П., Грин Т.А., Нив Р.Л., Чакраварти С., Кумар А. , Айш А.Дж., Селф Д.В., Ли Ф.С., Тамминга К.А., Купер Д.С., Гершенфельд Х.К., Нестлер Э.Дж. (октябрь 2007). «Молекулярные адаптации, лежащие в основе восприимчивости и устойчивости к социальному поражению в областях вознаграждения мозга» . Клетка . 131 (2): 391–404. дои : 10.1016/j.cell.2007.09.018 . ПМИД 17956738 . S2CID 15260992 .
- ^ Лин Л.Ф., Доэрти Д.Х., Лайл Дж.Д., Бектеш С., Коллинз Ф. (май 1993 г.). «GDNF: нейротрофический фактор глиальной клеточной линии для дофаминергических нейронов среднего мозга». Наука . 260 (5111): 1130–2. Бибкод : 1993Sci...260.1130L . дои : 10.1126/science.8493557 . ПМИД 8493557 .
- ^ Перейти обратно: а б с ЛаПлан К, Виалу В, Ковингтон Х.Э., Думитриу Д., Фенг Дж., Уоррен Б.Л., Мейз И., Дитц Д.М., Уоттс Э.Л., Иньигес С.Д., Ку Дж.В., Музон Е., Ренталь В., Холлис Ф., Ван Х., Нунан М.А., Рен Ю. , Эйш А.Дж., Боланьос К.А., Каббадж М., Сяо Г., Нив Р.Л., Херд Ю.Л., Остинг Р.С., Фан Г., Моррисон Дж.Х., Нестлер Э.Дж. (сентябрь 2010 г.). «Dnmt3a регулирует эмоциональное поведение и пластичность позвоночника в прилежащем ядре» . Природная неврология . 13 (9): 1137–43. дои : 10.1038/nn.2619 . ПМЦ 2928863 . ПМИД 20729844 .
- ^ Миллер, Калифорния (январь 2011 г.). «Стресс и депрессия? Проверьте свой GDNF на наличие эпигенетической репрессии» . Нейрон . 69 (2): 188–90. дои : 10.1016/j.neuron.2011.01.006 . ПМК 3785080 . ПМИД 21262458 .
- ^ Чахрур М., Юнг С.Ю., Шоу С., Чжоу Х., Вонг С.Т., Цинь Дж., Зогби Х.И. (май 2008 г.). «MeCP2, ключевой фактор неврологических заболеваний, активирует и подавляет транскрипцию» . Наука . 320 (5880): 1224–9. Бибкод : 2008Sci...320.1224C . дои : 10.1126/science.1153252 . ПМЦ 2443785 . ПМИД 18511691 .
- ^ Цен X, Нитта А, Охья С, Чжао Ю, Одзава Н, Моури А, Иби Д, Ван Л, Сузуки М, Сайто К, Ито Ю, Каваго Т, Нода Ю, Ито Ю, Фурукава С, Набешима Т (март 2006 г.) ). «Аналог дипептидоподобной структуры FK506 увеличивает экспрессию нейротрофического фактора глиальной линии посредством белка, связывающего ответный элемент цАМФ, активируемого сигнальным путем белка теплового шока 90/Akt» . Журнал неврологии . 26 (12): 3335–44. doi : 10.1523/JNEUROSCI.5010-05.2006 . ПМК 6674092 . ПМИД 16554484 .
- ^ Перейти обратно: а б Уивер И.С., Червони Н., Шампань Ф.А., Д'Алессио А.С., Шарма С., Секль Дж.Р., Дымов С., Шиф М., Мини М.Дж. (август 2004 г.). «Эпигенетическое программирование материнским поведением» (PDF) . Природная неврология . 7 (8): 847–54. дои : 10.1038/nn1276 . ПМИД 15220929 . S2CID 1649281 .
- ^ Перейти обратно: а б с Уивер И.С., Д'Алессио А.С., Браун С.Э., Хеллстром И.С., Дымов С., Шарма С., Шиф М., Мини М.Дж. (2007). «Фактор транскрипции, индуцируемый фактором роста нервов, белок А опосредует эпигенетическое программирование: изменение эпигенетических меток с помощью непосредственно-ранних генов» . Дж. Нейроски . 27 (7): 1756–68. doi : 10.1523/JNEUROSCI.4164-06.2007 . ПМК 2951014 . ПМИД 17301183 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Пина Дж. (2015). Флуоксетин: фармакология, механизм действия и возможные побочные эффекты . Нова Биомедикал. стр. 125–167. ISBN 978-1-63482-077-6 .
- ^ Фаббри С., Минарини А., Ниицу Т., Серретти А. (август 2014 г.). «Понимание фармакогенетики селективных ингибиторов обратного захвата серотонина». Экспертное заключение по метаболизму и токсикологии лекарственных средств . 10 (8): 1093–118. дои : 10.1517/17425255.2014.928693 . ПМИД 24930681 . S2CID 10514401 .
- ^ Мартинович К, Лу Б (2008). «Взаимодействие между BDNF и серотонином: роль в расстройствах настроения» . Нейропсихофармакология . 33 (1): 73–83. дои : 10.1038/sj.npp.1301571 . ПМИД 17882234 .
- ^ Рогоз З., Скуза Г., Легутко Б. (декабрь 2005 г.). «Повторное лечение миртазепином индуцирует экспрессию генов нейротрофического фактора головного мозга у крыс». Журнал физиологии и фармакологии . 56 (4): 661–71. ПМИД 16391422 .
- ^ Зобель А., Майер В. (август 2010 г.). «Фармакогенетика антидепрессивного лечения». Европейский архив психиатрии и клинической неврологии . 260 (5): 407–17. дои : 10.1007/s00406-009-0091-4 . ПМИД 20047055 . S2CID 1045752 .
- ^ Дюкло Ф., Каббадж М. (2015). «Эпигенетические механизмы, лежащие в основе роли нейротрофического фактора головного мозга в депрессии и реакции на антидепрессанты» . Журнал экспериментальной биологии . 218 (Часть 1): 21–31. дои : 10.1242/jeb.107086 . ПМК 4286703 . ПМИД 25568448 .
- ^ Трайковска В., Сантини М.А., Маркуссен А.Б., Томсен М.С., Хансен Х.Х., Миккельсен Дж.Д., Арнеберг Л., Кокая М., Кнудсен Г.М., Азнар С. (декабрь 2009 г.). «BDNF снижает уровень белка рецептора 5-HT (2A) в культурах гиппокампа». Нейрохимия Интернэшнл . 55 (7): 697–702. doi : 10.1016/j.neuint.2009.06.013 . ПМИД 19563850 . S2CID 2557641 .
- ^ Перейти обратно: а б с д Моринобу С., Страусбо Х., Тервиллигер Р., Думан Р.С. (1997). «Регуляция c-Fos и NGF1-A с помощью лечения антидепрессантами». Синапс . 25 (4): 313–20. doi : 10.1002/(SICI)1098-2396(199704)25:4<313::AID-SYN1>3.0.CO;2-D . ПМИД 9097389 . S2CID 8447638 .
- ^ Фречилла Д., Отано А., Дель Рио Дж. (1998). «Влияние хронического лечения антидепрессантами на активность связывания транскрипционных факторов в гиппокампе и лобной коре крыс» . Прогресс нейропсихофармакологии и биологической психиатрии . 22 (5): 787–802. дои : 10.1016/S0278-5846(98)00040-2 . ПМИД 9723120 . S2CID 25888764 .
- ^ Фучики М., Ямамото С., Моринобу С., Окада С., Ямаваки Ю., Ямаваки С. (2016). «Потенциальное использование ингибиторов деацетилазы гистонов при лечении депрессии» . Прогресс нейропсихофармакологии и биологической психиатрии . 64 : 320–4. дои : 10.1016/j.pnpbp.2015.03.010 . ПМИД 25818247 .