Купрат
Купраты — это класс соединений, которые содержат меди атом(ы) (Cu) в анионе . Их можно условно разделить на два основных типа:
1. Неорганические купраты . Эти соединения имеют общую формулу XYCu м О н . Некоторые из них нестехиометричны. Многие из этих соединений известны своими сверхпроводящими свойствами. [ нужна ссылка ] Примером неорганического купрата является тетрахлорокупрат (II) или тетрахлоркупрат (II) ( [ Cu Cl 4 ] 2− ), анионный координационный комплекс , в котором атом меди в степени окисления +2 окружен четырьмя ионами хлорида .
2. Органические купраты . Это медьорганические соединения, некоторые из которых имеют общую формулу [КуР 2 ] − , где медь находится в степени окисления +1, где по крайней мере одна из групп R может быть любой органической группой . Эти соединения, характеризующиеся связью меди с органическими группами, часто используются в органическом синтезе из-за их реакционной способности . [ нужна ссылка ] Примером органического купрата является анион диметилкупрата (I). [Си( СН 3 ) 2 ] − .
Одним из наиболее изученных купратов является Y Ba 2 Cu 3 O 7 — высокотемпературный сверхпроводящий материал . Этот оксид купрата стал предметом обширных исследований из-за его способности проводить электричество без сопротивления при относительно высоких температурах . [ нужна ссылка ]
Термин «купрат» происходит от слова «cuprum», латинского слова, обозначающего медь. В основном он используется в контексте оксидных материалов, анионных координационных комплексов и анионных медьорганических соединений, что отражает разнообразную роль меди в химии. Этот термин в основном используется в трех контекстах: оксидные материалы, анионные координационные комплексы и анионные медьорганические соединения. [ нужна ссылка ]
Оксиды купратов
[ редактировать ]
Одним из простейших купратов на основе оксидов является купрат калия(III). КСuО 2 . Этот вид можно рассматривать как К + соль полианиона [CuO - 2 ] п . Таким образом, материал классифицируется как оксид купрата. Это темно-синее диамагнитное твердое вещество получают путем нагревания пероксида калия и оксида меди(II) в атмосфере кислорода : [1]
- К 2 О 2 + 2 CuO → 2 KCuO 2
другие купраты(III) щелочных металлов Известны и ; кроме того, структуры KCuO 2 ( купрат калия (III)), RbCuO 2 ( купрат рубидия (III)) и CsCuO 2 ( купрат цезия (III)). Определены также [2]
KCuO 2 впервые был открыт в 1952 г. В. К. Валем и В. Клеммом, они синтезировали это соединение путем нагревания оксида меди(II) и супероксида калия в атмосфере кислорода. [3]
- 2 КО 2 + 2 CuO → KCuO 2 + O 2
Его также можно синтезировать путем нагревания супероксида калия и медного порошка: [4]
- КО 2 + Cu → KCuO 2
KCuO 2 реагирует с воздухом довольно медленно. Он начинает разлагаться при 760 К (487 ° C; 908 ° F), а его цвет меняется с синего на бледно-зеленый при 975 К (702 ° C; 1295 ° F). Его температура плавления составляет 1025 К (752 ° C; 1385 ° F). [3] [4]
RbCuO 2 (сине-черный) и CsCuO 2 (черный) можно получить реакцией оксида рубидия и оксида цезия с порошками оксида меди (II) при 675 К (402 °C; 755 °F) и 655 К (382 °C; 719 °F) в кислороде. атмосфера соответственно. Любой из них быстро реагирует с воздухом, в отличие от КСuО 2 . [4]
Фактически, KCuO 2 – нестехиометрическое соединение, поэтому более точная формула: KCuO x и x очень близки к 2. Это вызывает образование дефектов кристаллической структуры , а это приводит к склонности этого соединения к восстановлению . [4]
Купрат натрия (III) NaCuO 2 можно получить, используя гипохлориты или гипобромиты для окисления гидроксида меди в щелочных и низкотемпературных условиях. [5]
- 2 NaOH + CuSO 4 → Cu(OH) 2 ↓
- Cu(OH) 2 + 2 NaOH + NaClO → 2 NaCuO2 NaCl + H2O +
Купраты(III) нестабильны в воде и также могут окислять воду. [5]
- 4 CuO − 2 + 2 H 2 O → 4 CuO + O 2 ↑ + 4 OH −
Купрат натрия(III) имеет красновато-коричневый цвет, но постепенно чернеет по мере разложения до оксида меди(II) . [5] Чтобы предотвратить разложение, его необходимо готовить при низкой температуре в отсутствие света . [ нужна ссылка ]
Координационные комплексы
[ редактировать ]Медь образует множество анионных координационных комплексов с отрицательно заряженными лигандами, такими как цианиды, гидроксиды и галогениды, а также алкилами и арилами.
Медь(I)
[ редактировать ]Купраты, содержащие медь(I), имеют тенденцию быть бесцветными, что отражает их d 10 конфигурация . Структуры варьируются от линейной 2-координатной , тригонально-планарной и тетраэдрической молекулярной геометрии . Примеры включают линейную [Cu Cl 2 ] − и тригонально-планарный [CuCl 3 ] 2− . [6] Цианид дает аналогичные комплексы, а также трианионный тетрацианокупрат (I), [Си( CN ) 4 ] 3− . [7] дицианокупрат(I), [Си(CN) 2 ] − , существует как в молекулярных , так и в полимерных мотивах, в зависимости от противокатиона . [8]
Медь(II)
[ редактировать ]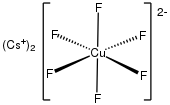
К купратам, содержащим медь(II), относятся трихлоркупрат(II), [CuCl 3 ] − , который является димерным, и плоскоквадратным тетрахлоркупратом (II), [СuCl 4 ] 2− и пентахлоркупрат(II), [CuCl 5 ] 3− . [9] [10] 3-координационные комплексы хлоркупрата(II) встречаются редко. [11]
Комплексы тетрахлоркупрата (II) имеют тенденцию принимать уплощенную тетраэдрическую геометрию оранжевого цвета. [12] [13] [14] [15]
Тетрагидроксикупрат(II) натрия ( Na 2 [Cu(OH) 4 ] ) является примером гомолептического ( все лиганды одинаковы) гидроксидного комплекса. [16]
- Cu(OH) 2 + 2 NaOH → Na2 [ (OH Cu )
Медь(III) и медь(IV)
[ редактировать ]Гексафторкупрат(III) [CuF 6 ] 3− и гексафторкупрат(IV) [CuF 6 ] 2− являются редкими примерами комплексов меди(III) и меди(IV). Они являются сильными окислителями .
Органические купраты
[ редактировать ]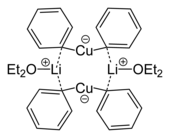
Купраты играют роль в органическом синтезе . Это всегда Cu(I), хотя промежуточные соединения используются в некоторых химических реакциях Cu(II) или даже Cu(III) . Органические купраты часто имеют идеализированные формулы. [КуР 2 ] − и [КуР 3 ] 2− , оба из которых содержат медь в степени окисления +1, где R представляет собой алкил или арил . Эти реагенты находят применение в качестве нуклеофильных алкилирующих реагентов . [18]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Г. Брауэр, изд. (1963). «Купрат калия (III)». Справочник по препаративной неорганической химии . Том. 2 (2-е изд.). Нью-Йорк: Академическая пресса. п. 1015.
- ^ Хестерманн, Клаус; Хоппе, Рудольф (1969). «Кристаллическая структура KCuO2 , RbCuO2 и CsCuO2 » . Журнал неорганической и общей химии . 270 (1–4): 69–75. дои : 10.1002/zaac.19693670506 .
- ^ Jump up to: а б Выбор, Курт; Клемм, Вильгельм (1952). «О купрате калия(III)» . Журнал неорганической и общей химии . 270 (1–4): 69–75. дои : 10.1002/zaac.19522700109 . Проверено 20 января 2023 г.
- ^ Jump up to: а б с д Коста, Джорджио А.; Кайзер, Елена (1995). «Структурные и термические свойства щелочного купрата KCuO 2 » . Термохимика Акта . 269–270: 591–598. дои : 10.1016/0040-6031(95)02575-8 . Проверено 20 января 2023 г.
- ^ Jump up to: а б с Маги, Дж. С.; Вуд, Р.Х. (1965). «Исследование стабильности купрата натрия (III)». Канадский химический журнал . 43 (5): 1234–1237. дои : 10.1139/v65-164 .
- ^ Стрикер, Мэрион; Линдер, Томас; Олкерс, Бенджамин; Сундермейер, Йорг (2010). «Каталитические ионные жидкости на основе Cu (I) / (II), их металлоламинатная твердотельная структура и каталитическая активность в окислительном карбонилировании метанола». Зеленая химия . 12 (9): 1589. doi : 10.1039/c003948a .
- ^ Кроекер, Скотт; Василишен, Родерик Э. (1999). «Исследование кристаллического тетрацианокупрата трикалия методом многоядерного магнитного резонанса». Канадский химический журнал . 77 (11): 1962–1972. дои : 10.1139/v99-181 .
- ^ Боумейкер, Грэм А.; Хартл, Ганс; Урбан, Виктория (2000). «Кристаллические структуры и колебательная спектроскопия [NBu 4 ][Cu(CN)X] (X = Br, I) и [NBu 4 ][Cu 3 (CN)4]·CH 3 CN». Неорганическая химия . 39 (20): 4548–4554. дои : 10.1021/ic000399s .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Уиллетт, Роджер Д.; Мясник, Роберт Э.; Ланди, Кристофер П.; Твэмли, Брендан (2006). «Обмен двух галогенидов в димерах галогенидов меди (II): (4,4 ' -бипиридиний) Cu 2 Cl 6- x BRX ». Многогранник . 25 (10): 2093–2100. дои : 10.1016/j.poly.2006.01.005 .
- ^ Хассельгрен, Катрин; Ягнер, Сьюзен; Танец, Ян (2002). «Трёхкоординатный [Cu II х 3 ] − (X = Cl, Br), в ловушке молекулярного кристалла». Chemistry – A European Journal . 8 (6): 1269–1278. doi : 10.1002/1521-3765(20020315)8:6<1269::AID-CHEM1269 3.0.CO;2-9 . PMID 11921210 >
- ^ Махуи, А.; Лапассе, Дж.; Морет, Дж.; Сен-Грегуар, П. (1996). «Тетраэтиламмоний Тетраметиламмоний Тетрахлоркупрат(II), [(C 2 H 5 ) 4 N][(CH 3 ) 4 N][CuCl 4 ]». Acta Crystallographica Раздел C. 52 (11): 2674–2676. дои : 10.1107/S0108270196009031 .
- ^ Гильермо Мингес Эспалларгас; Ли Браммер; Жакко ван де Стрик; Кеннет Шенкленд; Аластер Дж. Флоренс; Гарри Адамс (2006). «Обратимая экструзия и поглощение молекул HCl кристаллическими твердыми телами, включающая разрыв и образование координационных связей». Дж. Ам. хим. Соц. 128 (30): 9584–9585. дои : 10.1021/ja0625733 . ПМИД 16866484 .
- ^ Келли, А.; Налла, С.; Бонд, MR (2015). «От плоскоквадратного до сплюснутого тетраэдра CuX 4 2− ( X = Cl, Br) структурный фазовый переход в солях 1,2,6-триметилпиридиния». Acta Crystallogr. B. 71 ( Pt 1): 48–60. doi : 10.1107/S205252061402664X . PMID 25643715 .
- ^ Эгон Виберг; Нильс Виберг; Арнольд Фредерик Холлеман (2001). Неорганическая химия . Академическая пресса. стр. 1252–1264. ISBN 0-12-352651-5 .
- ^ Брауэр, Г., изд. (1963). «Тетрагидроксокупрат(II) натрия». Справочник по препаративной неорганической химии . Том. 1 (2-е изд.). Нью-Йорк, штат Нью-Йорк: Академическая пресса. п. 1015.
- ^ Лоренцен, Нис Петер; Вайс, Эрвин (1990). «Синтез и структура димерного дифенилкупрата лития: [{Li(OEt 2 )}(CuPh 2 )] 2 ». Angewandte Chemie International Edition на английском языке . 29 (3): 300. doi : 10.1002/anie.199003001 .
- ^ Луи С. Хегедус (1999). Переходные металлы в синтезе сложных органических молекул . Университетские научные книги. стр. 61–65. ISBN 1-891389-04-1 .