Гидроксид меди(II)

| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
Гидроксид меди(II)
| |
| Другие имена
Гидроксид меди
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.039.817 |
| КЕГГ | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| Cu(OH) 2 | |
| Молярная масса | 97.561 g/mol |
| Появление | Синее или сине-зеленое твердое вещество |
| Плотность | 3,368 г/см 3 , твердый |
| Температура плавления | Примерно 80 ° C (176 ° F; 353 К), разлагается на CuO. |
| незначительный | |
Произведение растворимости ( K sp )
|
2,20 х 10 −20 [ 1 ] |
| Растворимость | нерастворим в этаноле ; растворим в NH 4 OH |
| +1170.0·10 −6 см 3 /моль | |
| Термохимия | |
Стандартный моляр
энтропия ( S ⦵ 298 ) |
108 Дж·моль −1 ·К −1 |
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
−450 кДж·моль −1 |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
Раздражает кожу, глаза и дыхательные пути |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза )
|
1000 мг/кг (перорально, крыса) |
| NIOSH (пределы воздействия на здоровье в США): | |
ПЭЛ (допустимо)
|
СВВ 1 мг/м 3 (туз С) [ 2 ] |
РЕЛ (рекомендуется)
|
СВВ 1 мг/м 3 (туз С) [ 2 ] |
IDLH (Непосредственная опасность)
|
СВВ 100 мг/м 3 (туз С) [ 2 ] |
| Паспорт безопасности (SDS) | Паспорт безопасности |
| Родственные соединения | |
Другие анионы
|
Оксид меди(II) Карбонат меди(II) Сульфат меди(II) Хлорид меди(II) |
Другие катионы
|
гидроксид никеля(II) гидроксид цинка Гидроксид железа(II) гидроксид кобальта |
Родственные соединения
|
Оксид меди(I) Хлорид меди(I) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Гидроксид меди(II) представляет собой гидроксид меди ) с химической формулой Cu(OH 2 . Это бледно-зеленовато-голубое или голубовато-зеленое твердое вещество. Некоторые формы гидроксида меди(II) продаются как «стабилизированный» гидроксид меди(II), хотя они, вероятно, состоят из смеси карбоната и гидроксида меди(II) . Гидроксид меди является сильным основанием, хотя его низкая растворимость в воде затрудняет непосредственное наблюдение. [ 3 ]
возникновение
[ редактировать ]Гидроксид меди (II) известен с момента начала выплавки меди около 5000 г. до н. э., хотя алхимики, вероятно, были первыми, кто изготовил его путем смешивания растворов щелочи (гидроксида натрия или калия) и медного купороса (сульфата меди (II)). [ 4 ] Источники обоих соединений были доступны в древности.
Его производили в промышленных масштабах в 17 и 18 веках для использования в таких пигментах, как синий вердитер и бременский зеленый . [ 5 ] Эти пигменты использовались в керамике и живописи . [ 6 ]
Минерал
[ редактировать ]Минерал формулы Cu(OH) 2 называется спертиниитом . Гидроксид меди(II) редко встречается в виде несвязанного минерала , поскольку он медленно реагирует с углекислым газом из атмосферы с образованием основного карбоната меди(II) . Так, гидроксид меди(II) во влажном воздухе медленно приобретает тускло-зеленый налет по реакции:
- 2 Cu(OH) 2 + CO 2 → Cu 2 CO 3 (OH) 2 + H 2 O
Сырой материал в принципе представляет собой молярную смесь Cu(OH) 2 и CuCO 3 в соотношении 1:1 . [ 7 ] Эта патина образуется на статуях из бронзы и других медных сплавов, таких как Статуя Свободы .
Производство
[ редактировать ]Гидроксид меди(II) можно получить добавлением гидроксида натрия к различным источникам меди(II). Однако природа образующегося гидроксида меди (II) зависит от конкретных условий. Некоторые методы позволяют получить гранулированный прочный гидроксид меди (II), тогда как другие методы позволяют получить термочувствительный коллоидоподобный продукт. [ 3 ]
Традиционно раствор растворимой соли меди(II), такой как сульфат меди(II) (CuSO 4 ·5H 2 O), обрабатывают основанием: [ 8 ]
- 2NaOH + CuSO 4 ·5H 2 O → Cu(OH) 2 + 6H 2 O + Na 2 SO 4
Эта форма гидроксида меди имеет тенденцию превращаться в черный оксид меди (II) : [ 9 ]
- Cu(OH) 2 → CuO + H 2 O
Более чистый продукт можно получить, если хлорид аммония для образования аммиака на месте. к раствору заранее добавить [ 10 ] В качестве альтернативы его можно получить двухэтапной процедурой из сульфата меди (II) через «основной сульфат меди:» [ 9 ]
- 4 CuSO 4 + 6 NH 3 + 6H 2 O → Cu 4 SO 4 (OH) 6 + 3 (NH 4 ) 2 SO 4
- Cu 4 SO 4 (OH) 6 + 2 NaOH → 4 Cu(OH) 2 + Na 2 SO 4
Альтернативно, гидроксид меди легко получить электролизом воды (содержащей небольшое количество электролита, такого как сульфат натрия или сульфат магния ) с медным анодом :
- С + 2ОН − → Cu(OH) 2 + 2e −
Структура
[ редактировать ]Строение Cu(OH) 2 установлено методом рентгеновской кристаллографии. Медный центр имеет квадратно-пирамидальную форму. Четыре расстояния Cu-O в плоском диапазоне составляют 1,96 Å, а осевое расстояние Cu-O составляет 2,36 Å. Гидроксидные лиганды в плоскости имеют либо двойную , либо тройную мостиковую структуру. [ 11 ]
Реакции
[ редактировать ]Он стабилен до температуры около 100 °C. [ 8 ] Выше этой температуры он разлагается на оксид меди (II).
Гидроксид меди(II) реагирует с раствором аммиака с образованием темно-синего раствора тетрамминмеди [Cu(NH 3 ) 4 ] 2+ сложный ион .
Гидроксид меди(II) окисляет аммиак в присутствии кислорода, образуя аммианитриты меди, такие как Cu(NO 2 ) 2 (NH 3 ) n . [ 12 ] [ 13 ]
Гидроксид меди(II) умеренно амфотерен . Слегка растворяется в концентрированной щелочи , образуя [Cu(OH) 4 ] 2− . [ 14 ] [ 8 ]
Реагент для органической химии
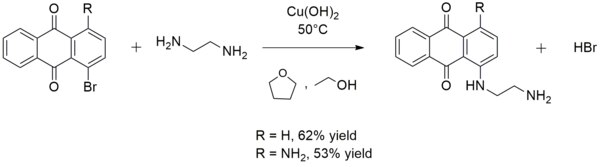
[ редактировать ]Гидроксид меди (II) играет лишь специализированную роль в органическом синтезе . Часто, когда его используют для этой цели, его готовят на месте путем смешивания растворимой соли меди (II) и гидроксида калия . его используют при синтезе ариламинов Иногда . Например, гидроксид меди(II) катализирует реакцию этилендиамина с 1-бромантрахиноном или 1-амино-4-бромантрахиноном с образованием 1-((2-аминоэтил)амино)антрахинона или 1-амино-4-((2-аминоэтила). )амино)антрахинон соответственно: [ 15 ]
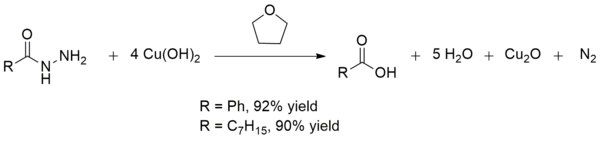
Гидроксид меди (II) также превращает гидразиды кислот в карбоновые кислоты при комнатной температуре. Это превращение может быть использовано при синтезе карбоновых кислот при наличии других хрупких функциональных групп . Выходы, как правило, превосходны, как и в случае производства бензойной и октановой кислот : [ 15 ]
Использование
[ редактировать ]Гидроксид меди(II) в растворе аммиака, известный как реактив Швейцера , растворяет целлюлозу . [ 3 ] Это свойство привело к тому, что его начали использовать в производстве вискозы , целлюлозного волокна .
Он также используется в аквариумной индустрии из-за его способности уничтожать внешних паразитов рыб, в том числе сосальщиков, морского клеща , бруклинеллеза и морского бархатца , не убивая при этом рыбу. Хотя другие водорастворимые соединения меди могут быть эффективны в этой роли, они обычно приводят к высокой смертности рыб.
Гидроксид меди (II) использовался в качестве альтернативы бордоской жидкости , фунгициду и нематициду . [ 3 ] [ 16 ] К таким продуктам относится Kocide 3000, производимый Kocide LLC. Гидроксид меди(II) также иногда используется в качестве красителя для керамики .
Гидроксид меди(II) объединили с латексной краской, в результате чего получился продукт, предназначенный для контроля роста корней горшечных растений. Вторичные и боковые корни растут и расширяются, в результате чего образуется плотная и здоровая корневая система. Он продавался под названием Spin Out, которое впервые было представлено Griffin LLC. Права теперь принадлежат SePRO Corp. [ 17 ] Сейчас он продается под названием Microkote либо в виде раствора, который вы наносите самостоятельно, либо в виде обработанных горшков.
Прочие гидроксиды меди(II)
[ редактировать ]
Вместе с другими компонентами гидроксиды меди(II) многочисленны. Некоторые медь(II)-содержащие минералы содержат гидроксид. Известные примеры включают азурит , малахит , антлерит и брошантит . Азурит (2CuCO 3 ·Cu(OH) 2 ) и малахит (CuCO 3 ·Cu(OH) 2 являются гидроксикарбонатами ) являются гидроксикарбонатами , тогда как антлерит (CuSO 4 ·2Cu(OH) 2 ) и брохантит (CuSO 4 ·3Cu(OH) 2 ) . 2 ) представляют собой гидроксисульфаты .
Многие синтетические производные гидроксида меди (II) были исследованы. [ 19 ]
Ссылки
[ редактировать ]- ^ Прадьот Патнаик. Справочник неорганических химикатов . МакГроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ Перейти обратно: а б с Карманный справочник NIOSH по химическим опасностям. «#0150» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Перейти обратно: а б с д Чжан, Цзюнь; Ричардсон, Х. Уэйн (2016). «Медные соединения». Энциклопедия промышленной химии Ульмана . стр. 1–31. дои : 10.1002/14356007.a07_567.pub2 . ISBN 978-3-527-30673-2 .
- ^ Ричард Коуэн, Очерки по геологии, истории и людям , Глава 3: «Огонь и металлы: медь» .
- ^ Тони Йохансен, Пигменты исторического художника. Архивировано 9 июня 2009 г. в Wayback Machine . PaintMaking.com. 2006.
- ^ Blue verditer. Архивировано 27 сентября 2007 г. в Wayback Machine . Натуральные пигменты. 2007.
- ^ Мастерсон, WL, и Херли, CN (2004). Химия: принципы и реакции, 5-е изд . Thomson Learning, Inc. (стр. 331)»
- ^ Перейти обратно: а б с О. Глемсер и Х. Зауэр «Гидроксид меди (II)» в Справочнике по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, Нью-Йорк. Том. 2. п. 1013.
- ^ Перейти обратно: а б Соломон, Салли Д.; Рутковски, Сьюзен А.; Махон, Меган Л.; Халперн, Эрика М. (2011). «Синтез медных пигментов, малахита и ярь-медяни: изготовление темперной краски». Журнал химического образования . 88 (12): 1694–1697. Бибкод : 2011JChEd..88.1694S . дои : 10.1021/ed200096e .
- ^ Ю. Куденнек, А. Лесерф (2003). «Пересмотр превращения Cu(OH)2 в CuO» (PDF) . Науки о твердом теле . 5 (11–12): 1471–1474. Бибкод : 2003SSSci...5.1471C . doi : 10.1016/j.solidstatesciences.2003.09.009 . S2CID 96363475 .
- ^ HR Освальд; А. Реллер; Х.В. Шмалле; Э. Дублер (1990). «Строение гидроксида меди(II), Cu(OH) 2 ». Акта Кристаллогр . C46 (12): 2279–2284. дои : 10.1107/S0108270190006230 .
- ^ Ю. Куденнек; и др. (1995). «Кинетическое исследование окисления аммиака в присутствии ионов меди». Доклады Академии наук, серия IIВ . 320 (6): 309–316.
- ^ Ю. Куденнек; и др. (1993). «Синтез и исследование Cu(NO 2 ) 2 (NH 3 ) 4 и Cu(NO 2 ) 2 (NH 3 ) 2 ». Европейский журнал твердого тела и неорганической химии . 30 (1–2): 77–85.
- ^ Полинг, Лайнус (1970). Общая химия . Dover Publications, Inc. (стр. 702).
- ^ Перейти обратно: а б Цуда, Т. (2001). «Гидроксид меди(II)». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rc228 . ISBN 0-471-93623-5 .
- ^ Бордоская смесь . УЦ ИПМ онлайн. 2007.
- ^ «Корпорация SePRO» . Архивировано 21 июня 2009 г. в Wayback Machine .
- ^ Зиган, Ф.; Шустер, HD (1972). «Уточнение структуры азурита Cu3 ( OH) 2 (CO3 ) 2 методом нейтронографии ». Журнал кристаллографии, кристаллической геометрии, кристаллофизики, кристаллохимии . 135 (5–6): 416–436. Бибкод : 1972ZK....135..416Z . дои : 10.1524/zkri.1972.135.5-6.416 . S2CID 95738208 .
- ^ Кондинский, А.; Монахов, К. (2017). «Разрыв гордиева узла в структурной химии полиоксометаллатов: медь (II) – оксо/гидроксикластеры» . Химия: Европейский журнал . 23 (33): 7841–7852. дои : 10.1002/chem.201605876 . ПМИД 28083988 .