Сигматропная реакция
Сигматропная реакция в органической химии — это перициклическая реакция , конечным результатом которой является замена одной σ-связи на другую σ-связь в некаталитической внутримолекулярной реакции . [ 1 ] Название сигматропик является результатом соединения давно устоявшегося обозначения сигма, состоящего из одиночных связей углерод -углерод, и греческого слова тропос , что означает поворот. В этом типе реакции перегруппировки заместитель системы в другую часть во внутримолекулярной реакции перемещается из одной части π-связанной с одновременной перегруппировкой π-системы. [ 2 ] Истинные сигматропные реакции обычно некатализируются, хотя кислотой Льюиса катализ возможен . Сигматропные реакции часто имеют катализаторы из переходных металлов, которые образуют промежуточные продукты в аналогичных реакциях. Наиболее известными из сигматропных перегруппировок являются [3,3] перегруппировка Коупа , перегруппировка Кляйзена , перегруппировка Кэрролла и синтез индола Фишера .
Обзор сигматропных сдвигов
[ редактировать ]Номенклатура сигматропного сдвига Вудворда – Хоффмана
[ редактировать ]Сигматропные перегруппировки кратко описываются термином [ порядка i,j] , который определяется как миграция σ-связи, прилегающей к одной или нескольким π-системам, в новую позицию (i-1) и (j-1) атомов удаленных . от исходного местоположения σ-связи. [ 3 ] Когда сумма i и j является четным числом, это указывает на участие нейтральной цепи, состоящей только из атомов C. Нечетное число указывает на участие заряженного атома C или неподеленной пары гетероатомов, заменяющей двойную связь CC. Таким образом, [1,5] и [3,3] сдвиги становятся сдвигами [1,4] и [2,3] с гетероатомами, сохраняя при этом соображения симметрии. Водороды в третьем примере опущены для ясности.
Удобный способ определения порядка данной сигматропной перегруппировки состоит в том, чтобы пронумеровать атомы разрываемой связи как атом 1, а затем подсчитать атомы в каждом направлении от разорванной связи до атомов, образующих новую σ-связь в изделия, нумерация последовательная. Числа, соответствующие атомам, образующим новую связь, затем разделяются запятой и помещаются в скобки, чтобы создать дескриптор порядка сигматропной реакции. [ 4 ]
В случае миграции атомов водорода можно применить аналогичный метод. При определении порядка сигматропного сдвига, связанного с миграцией атомов водорода, важно учитывать все атомы, участвующие в реакции, а не только ближайшие атомы. Например, следующая миграция атома водорода имеет порядок [1,5], достигаемый путем отсчета против часовой стрелки по системе π, а не обозначение порядка [1,3] через кольцевую группу CH 2 , которое ошибочно возникло бы при счете по часовой стрелке.
В качестве общего подхода можно просто нарисовать переходное состояние реакции. Для сигматропной реакции переходное состояние будет состоять из двух фрагментов, соединенных образующимися и разрывающимися σ-связями. Сигматропная реакция называется [ i , j ]-сигматропной перегруппировкой ( i ≤ j ), если эти два фрагмента состоят из атомов i и j . Это проиллюстрировано ниже, соответствующие фрагменты показаны цветом.
Супрафациальные и антарафациальные сдвиги.
[ редактировать ]В принципе, все сигматропные сдвиги могут происходить либо с сохранением, либо с инверсией геометрии мигрирующей группы, в зависимости от того, используется ли для образования новой связи исходная связывающая доля мигрирующего атома или другая его доля. [ 4 ]
В случаях стереохимического удержания мигрирующая группа без вращения перемещается в положение связи, тогда как в случае стереохимической инверсии мигрирующая группа как вращается, так и перемещается, достигая своей связанной конформации.
Однако другой эффект стереохимического перехода, в равной степени способный производить продукты инверсии или удержания, заключается в том, остается ли мигрирующая группа на исходной стороне π-системы после повторного связывания или вместо этого переходит на противоположную сторону π-системы. Если мигрирующая группа остается на той же стороне π-системы, сдвиг называется супрафациальным , а если мигрирующая группа перемещается на противоположную грань, называется антарафациальным сдвигом. [ 3 ] которые невозможны для превращений, происходящих внутри колец малых и средних размеров.
Классы сигматропных перегруппировок
[ редактировать ][1,3] смены
[ редактировать ]Термогидридные сдвиги
[ редактировать ]При термическом [1,3] -гидридном сдвиге гидрид перемещает три атома. Правила Вудворда-Хоффмана диктуют, что это будет происходить с антарафациальным сдвигом. Хотя такой сдвиг разрешен симметрией, Мебиуса топология , необходимая в переходном состоянии, запрещает такой сдвиг, поскольку он геометрически невозможен, что объясняет тот факт, что енолы не изомеризуются без кислотного или основного катализатора . [ 4 ]
Термические алкильные сдвиги
[ редактировать ]Термические алкильные [1,3]-сдвиги, подобно [1,3]-гидридным сдвигам, должны протекать антарафациально. Здесь геометрия переходного состояния запредельна, но алкильная группа в силу природы своих орбиталей может инвертировать свою геометрию, образовать новую связь с задней долей своей пр. 3 орбитально и, следовательно, происходит через надфациальный сдвиг. Эти реакции до сих пор не распространены в соединениях с открытой цепью из-за высокоупорядоченной природы переходного состояния, которое легче достигается в циклических молекулах. [ 4 ]
Фотохимические [1,3] сдвиги
[ редактировать ]Фотохимические [1,3] сдвиги должны происходить через супрафациальные сдвиги; однако большинство из них несогласованы, поскольку проходят через триплетное состояние (т. е. имеют дирадикальный механизм, к которому правила Вудворда-Гоффмана не применимы). [ 4 ]
[1,5] смены
[ редактировать ]Сдвиг [1,5] включает сдвиг 1 заместителя (гидрида, алкила или арила ) вниз на 5 атомов π-системы. Было показано, что водород смещается как в циклических, так и в соединениях с открытой цепью при температуре 200 ˚C или выше. [ 4 ] Предполагается, что эти реакции будут протекать супрафациально через переходное состояние топологии Хюккеля.
Фотооблучение потребует антарафациального сдвига водорода. Хотя и редко, но есть примеры, когда антарафациальные сдвиги предпочтительнее: [ 5 ]
В отличие от водородных [1,5]-сдвигов, в соединениях с открытой цепью никогда не наблюдалось каких-либо [1,5]-алкильных сдвигов. [ 4 ] Однако было проведено несколько исследований для определения скоростных предпочтений для [1,5]-алкильных сдвигов в циклических системах: карбонил и карбоксил > гидрид > фенил и винил >> алкил. [ 6 ] [ 7 ]
Алкильные группы очень плохо претерпевают [1,5]-сдвиги, обычно требующие высоких температур, однако для циклогексадиена температура алкильных сдвигов ненамного выше, чем у карбонилов, лучшей мигрирующей группы. Исследование показало, что это связано с тем, что алкильные сдвиги на циклогексадиенах происходят по другому механизму. Сначала кольцо размыкается, после чего происходит сдвиг [1,7], а затем кольцо электроциклически реформируется : [ 8 ]
Тот же самый механистический процесс виден ниже, без конечной электроциклической реакции замыкания кольца, при взаимном превращении люмистерола в витамин D 2 .
[1,7] смены
[ редактировать ][1,7] согласно правилам Вудворда-Хоффмана, сигматропные сдвиги будут происходить антарафациально, через переходное состояние топологии Мебиуса. Антарафациальный сдвиг [1,7] наблюдается при превращении люмистерола в витамин D 2 , где после раскрытия электроциклического кольца в превитамин D 2 происходит сдвиг метилового водорода. [ 9 ]
Бициклические нонатриены также претерпевают [1,7] сдвиги в так называемой перегруппировке ходьбы , [ 10 ] который представляет собой сдвиг двухвалентной группы в составе трехчленного кольца в бициклической молекуле .
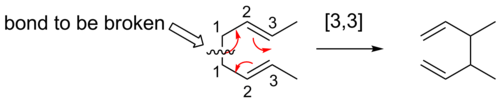
[3,3] смены
[ редактировать ][3,3] Сигматропные сдвиги являются хорошо изученными сигматропными перегруппировками. Правила Вудворда-Хоффмана предсказывают, что эти шестиэлектронные реакции будут протекать супрафациально через переходное состояние топологии Хюккеля.
Перегруппировка Клайзена
[ редактировать ]Перегруппировка Кляйзена, открытая в 1912 году Райнером Людвигом Кляйзеном , является первым зарегистрированным примером [3,3]-сигматропной перегруппировки. [ 11 ] [ 12 ] [ 13 ] Эта перегруппировка является полезной углерод -углеродной связи образования реакцией . Примером перегруппировки Кляйзена является перегруппировка [3,3] аллилвинилового , которая эфира при нагревании дает γ,δ-ненасыщенный карбонил. Образование карбонильной группы делает эту реакцию, в отличие от других сигматропных перегруппировок, необратимой по своей сути.
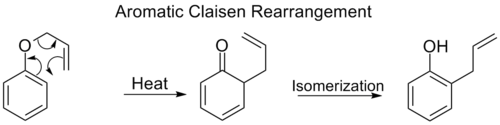
Ароматическая перегруппировка Клайзена
[ редактировать ]Орто -перегруппировка Кляйзена включает сдвиг [3,3] аллилфенилового эфира в промежуточное соединение, которое быстро таутомеризуется в орто-замещенный фенол .
Когда оба орто- положения бензольного кольца блокируются, происходит вторая [3,3]-перегруппировка. Эта пара-Кляйзеновская перегруппировка заканчивается таутомеризацией с образованием тризамещенного фенола.
Перестановка копа
[ редактировать ]Перегруппировка Коупа — это широко изученная органическая реакция, включающая [3,3]-сигматропную перегруппировку 1,5-диенов. [ 14 ] [ 15 ] [ 16 ] Он был разработан Артуром Коупом . Например, 3,4-диметил-1,5-гексадиен, нагретый до 300 °C, дает 2,6-октадиен.
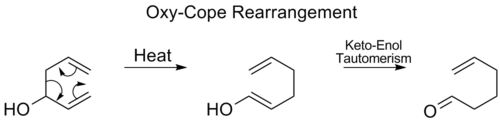
Перегруппировка Окси-Копа
[ редактировать ]При перегруппировке окси-Копа к C3 добавляется гидроксильная группа , образующая еналь или енон после кето-енольной таутомерии промежуточного енола: [ 17 ]
Перегруппировка Кэрролла
[ редактировать ]Перегруппировка Кэрролла — это реакция перегруппировки в органической химии которая включает превращение β- кетоаллилового эфира , в α-аллил-β-кетокарбоновую кислоту. [ 18 ] Эта органическая реакция сопровождается декарбоксилированием , конечным продуктом является γ,δ-аллилкетон. Перегруппировка Кэрролла представляет собой адаптацию перегруппировки Кляйзена и фактически является декарбоксилирующим аллилированием .
Синтез индола Фишера
[ редактировать ]Синтез индола Фишера представляет собой химическую реакцию , в ходе которой ароматический гетероциклический индол получается из (замещенного) фенилгидразина и альдегида или кетона в кислых условиях. [ 19 ] [ 20 ] Реакция была открыта в 1883 году Германом Эмилем Фишером .
Выбор кислотного катализатора очень важен. кислоты Бренстеда, такие как HCl , H 2 SO 4 , полифосфорная кислота и п-толуолсульфоновая кислота Успешно использовались . Кислоты Льюиса, такие как трифторид бора , хлорид цинка , хлорид железа (III) и хлорид алюминия , также являются полезными катализаторами.
Опубликовано несколько обзоров. [ 21 ] [ 22 ] [ 23 ]
[5,5] Сдвиги
[ редактировать ]Подобно сдвигам [3,3], правила Вудворда-Хоффмана предсказывают, что сигматропные сдвиги [5,5] будут происходить супрафациально, переходное состояние топологии Хюккеля. Эти реакции встречаются реже, чем сигматропные сдвиги [3,3], но это главным образом является функцией того факта, что молекулы, которые могут претерпевать сдвиги [5,5], встречаются реже, чем молекулы, которые могут подвергаться сдвигам [3,3]. [ 4 ]
[2,3] смены
[ редактировать ]Примером 2,3-сигматропной перегруппировки является перегруппировка 2,3-Виттига :
Перестановки ходьбы
[ редактировать ]Миграцию двухвалентной группы, такой как O , S , N -R или C-R2 , которая является частью трехчленного кольца в бициклической молекуле, обычно называют перегруппировкой ходьбы. Согласно правилам Вудворда-Хофмана, это можно формально охарактеризовать как сигматропный сдвиг (1, n). [ 24 ] Примером такой перегруппировки является сдвиг заместителей у тропилиденов (1,3,5-циклогептатриенов). При нагревании пи-система замыкается электроциклическое кольцо с образованием би[4,1,0]гептадиена (норкарадиена). После этого следует сдвиг [1,5]-алкила и раскрытие электроциклического кольца.
Ожидается, что, протекая через сдвиг [1,5], перегруппировка норкарадиенов будет происходить супрафациально с сохранением стереохимии. Однако экспериментальные наблюдения показывают, что 1,5-сдвиги норкарадиенов происходят антарафациально. [ 25 ] Теоретические расчеты показали, что сдвиг [1,5] является дирадикальным процессом, но без участия каких-либо дирадикальных минимумов на поверхности потенциальной энергии . [ 26 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Кэри, Ф.А. и Р.Дж. Сундберг. Продвинутая органическая химия, часть A ISBN 0-306-41198-9
- ^ «Сигматропные перегруппировки» . Химия LibreTexts . 11 ноября 2013 г.
- ^ Перейти обратно: а б Вудворд, РБ ; Хоффманн Р. Сохранение орбитальной симметрии. Академическое издательство Verlag Chemie. 2004. ISBN 0-89573-109-6 .
- ^ Перейти обратно: а б с д и ж г час Миллер, Бернард. Продвинутая органическая химия . 2-е изд. Река Аппер-Седл: Пирсон Прентис-холл. 2004. ISBN 0-13-065588-0
- ^ Кифер, EF; Тана, CJ Am. хим. Соц. , 1969 , 91 , 4478. два : 10.1021/ja01044a027
- ^ Филдс, диджей; Джонс, Д.В.; Книн, Г. Химические коммуникации , 1976 . 873 – 874. дои : 10.1039/C39760000873
- ^ Miller, L.L.; Greisinger, R.; Boyer, R.F. J. Am. Chem. Soc. 1969 . 91 . 1578. два : 10.1021/ja01034a076
- ^ Шисс, П.; Динкель, Р. Письма о тетраэдре , 1975 , 16 , 29, 2503. дои : 10.1016/0040-4039(75)80050-5
- ^ Кэри, Фрэнсис А; Сундберг, Ричард Дж (2000). Передовая органическая химия. Часть A: Структура и механизмы (4-е изд.). Нью-Йорк: Kluwer Academic/Plenum. п. 625 . ISBN 0-306-46242-7 .
- ^ Клернер, Ф.Г. Агнью. хим. Международный Эд. англ. , 1972 , 11 , 832. два : 10.1002/anie.197208321
- ^ Клайзен, Л .; Бер. 1912 , 45 , 3157. два : 10.1002/cber.19120450348
- ^ Клайзен, Л.; Титце, Э.; Химические отчеты 1925 , 58 , 275. два : 10.1002/cber.19250580207
- ^ Клайзен, Л.; Титце, Э.; Химические отчеты 1926 , 59 , 2344. два : 10.1002/cber.19260590927
- ^ Коуп, AC ; и др . Дж. Ам. хим. Соц. 1940 , 62 , 441. два : 10.1021/ja01859a055
- ^ Хоффманн, Р.; Сторер, WD J. Am. хим. Соц. 1971, 93 , 25, 6941–6948. два : 10.1021/ja00754a042
- ^ Дюпюи, М.; Мюррей, К.; Дэвидсон, ERJ Am. хим. Соц. 1991, 113 , 26, 9756–9759. два : 10.1021/ja00026a007
- ^ Берсон, Джером А.; Джонс, Мейтленд. Дж. Ам. хим. Соц. 1964, 86 , 22, 5019–5020. два : 10.1021/ja01076a067
- ^ Кэррол, MF Журнал Химического общества 1940, 704–706. дои : 10.1039/JR9400000704 .
- ^ Фишер, Э.; Журдан, Ф. Химические отчеты 1883 , 16 , 2241. два : 10.1002/cber.188301602141
- ^ Фишер, Э.; Гесс, О. Химические отчеты 1884 , 17 , 559. два : 10.1002/cber.188401701155
- ^ ван Орден, РБ; Линдвелл, HG Chem. Замри. 1942 , 30 , 69–96. два : 10.1021/cr60095a004
- ^ Robinson, B. Chem. Rev. 1963 , 63 , 373–401. два : 10.1021/cr60224a003
- ^ Robinson, B. Chem. Rev. 1969 , 69 , 227–250. два : 10.1021/cr60262a003
- ^ Дженсен, FJ Am. хим. Соц. , 1989, 111 , 13, 4643 – 4647. два : 10.1021/ja00195a018
- ^ Кларнер, Ф.Г. Темы стереохимии , 1984 , 15 , 1–42. ISSN 0082-500X
- ^ Клесс, А.; Нендель, М.; Уилси, С.; Хоук, KN J. Am. хим. Соц. , 1999 , 121 , 4524. два : 10.1021/ja9840192






![[1,3] Алкильные сдвиги](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e9/1%2C3alkylfixed.png/550px-1%2C3alkylfixed.png)
![[1,5] гидридный сдвиг в циклической системе](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7f/1%2C5hydridecyclicfixed.png/300px-1%2C5hydridecyclicfixed.png)
![Антарафациальный [1,5] гидридный сдвиг](http://upload.wikimedia.org/wikipedia/commons/thumb/9/99/1%2C5hantarafacialfixed.png/600px-1%2C5hantarafacialfixed.png)








![[5,5] сдвиг фенилпентадиенилового эфира](http://upload.wikimedia.org/wikipedia/commons/thumb/2/25/5%2C5shiftfixeds.png/800px-5%2C5shiftfixeds.png)

