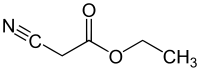
Этилцианоацетат
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
Этилцианоацетат | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.003.009 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Число | 3276 2666 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| C5H7NOC5H7NO2 | |
| Молярная масса | 113.116 g·mol −1 |
| -67.3·10 −6 см 3 /моль | |
| Опасности | |
| СГС Маркировка : | |

| |
| Предупреждение | |
| Х302 , Х312 , Х319 , Х332 | |
| P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P312 , P304+P340 , P305+P351+P338 , P312 , P322 , P330 , P337+P313 , П363 , П501 | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Этилцианоацетат представляет собой органическое соединение , содержащее сложный эфир карбоксилатной кислоты и нитрил . Это бесцветный [ 1 ] жидкость с приятным запахом. Этот материал полезен в качестве исходного материала для синтеза благодаря разнообразию функциональных групп и химической активности. [ 2 ]
Производство
[ редактировать ]Этилцианоацетат можно получить различными способами:
- Синтез нитрила Кольбе с использованием этилхлорацетата и цианида натрия . [ 3 ]
- Этерификация цианоуксусной кислоты по Фишеру этанолом в присутствии сильных минеральных кислот (например, концентрированной серной кислоты ). Цианоуксусную кислоту можно получить путем синтеза нитрила Кольбе с использованием хлорацетата натрия и цианида натрия. [ 3 ]
- Реакция цианоацетата натрия с бромистым этилом в водно-органической двухфазной системе в присутствии катализатора межфазного переноса . [ 4 ]
- Окисление 3-этоксипропионитрила простого эфира кислородом под давлением в присутствии тетрагидрата ацетата кобальта(II) в качестве катализатора и N -гидроксифталимида в качестве генератора радикалов. [ 5 ]
Характеристики
[ редактировать ]Физические свойства
[ редактировать ]
Давление пара соответствует уравнению Антуана log 10 (P) = A−(B/(T+C)) (P в барах, T в К) с A = 7,46724, B = 3693,663 и C = 16,138 в диапазоне температур от от 341 до 479 К [ 6 ] две полиморфные формы . Встречаются [ 7 ] [ нужна полная цитата ] При температуре ниже -111 ° C преобладает кристаллическая форма II. [ 7 ] Выше этой температуры образуется кристаллическая форма I, которая плавится при -22 °C. [ 8 ] Теплоемкость при 25 °C составляет 220,22 Дж К. −1 моль −1 . [ 7 ]
Химические свойства
[ редактировать ]Благодаря трем различным реакционным центрам — нитрильному, эфирному и кислому метиленовому центру — этилцианоацетат является универсальным синтетическим строительным блоком для множества функциональных и фармакологически активных веществ. Он содержит кислую метиленовую группу, окруженную нитрилом и карбонилом , и поэтому может использоваться в реакциях конденсации, таких как конденсация Кнёвенагеля или присоединение Михаэля . Эта реакционная способность аналогична реакционной способности эфиров кислоты малоновой . В качестве примера реакционной способности нитрила можно привести диэтилмалонат, полученный из этилового эфира цианоуксусной кислоты реакцией с этанолом в присутствии сильных кислот . [ 3 ] При нагревании в присутствии этоксида натрия образуется димерный диэтиловый эфир 3-амино-2-циано-2-пентендикислоты. [ 9 ]
Использовать
[ редактировать ]Благодаря своей функциональности цианоацетат реагирует:
- По нитрильной группе по-разному:
- Гидрирование приводит к образованию β-аминокислоты β-аланина.
- Нуклеофильная атака на углерод как этап синтеза многих гетероциклов (см. ниже) и других продуктов.
- В качестве безопасного реагента-донора цианидов. [ 10 ]
- Нуклеофильная атака по сложноэфирной группе в рамках ацильного замещения: реакция с аммиаком приводит к цианоацетамиду, который можно превратить дегидратацией с помощью PCl 5 или POCl 3 в малононитрил. [ 11 ]
- Через кислую метиленовую группу в качестве нуклеофила
Этилцианоацетат является строительным блоком для синтеза гетероциклов , которые используются, например, в качестве лекарств:
- Аллопуринол , используемый для лечения хронической подагры, можно синтезировать, начиная с конденсации Кнёвенагеля с триэтилортоформиатом ; продукт конденсации циклизуют с гидразином с образованием замещенного пиразола, а затем с формамидом с образованием аллопуринола, замещенного пиразолопиримидина. [ 12 ]
- Производные пурина теофиллин , кофеин и мочевая кислота синтетически доступны из этилцианоацетата и N,N' -диметилмочевины . [ 13 ]
- птеридина относится Производное фолиевой кислоты к комплексу витаминов B ; Этилцианоацетат и гуанидин могут быть использованы в качестве исходного материала в многостадийном конвергентном синтезе .
- Пиррол эпилепсии этосуксимид применяется для лечения , его можно получить из этилцианоацетата и бутанона в многостадийном синтезе.
- триметоприм пиримидина Производное используемым используется в качестве ко-тримоксазола в фиксированной комбинации с сульфаметоксазолом, в качестве бактериостатического агента , и синтезируется из этилцианоацетата и 3,4,5-триметоксибензальдегида или его бензилхлорида.
Также многие другие функциональные гетероциклы с хорошими выходами доступны из этилцианоацетата, такие как 3-замещенные производные кумарина. [ 14 ]
Нециклические продукты из этого исходного материала включают:
- Противосудорожное средство вальпроевая кислота
- Этилцианакрилат , используемый в качестве суперклея, в результате реакции с формальдегидом.
Этилцианоацетат также используется для получения 3,3-дифенилпропан-1-амина, который является предшественником, используемым в синтезе прениламина и дропрениламина .
Безопасность
[ редактировать ]Этилцианоацетат имеет LD50 2820 мг/кг (перорально, крыса). [ 15 ]
Ссылки
[ редактировать ]- ^ Запись на Cyanessigsäureester . по адресу: Römpp Online . Георг Тиме Верлаг, получено 15 июня 2016 г.
- ^ Фриман, Филлмор (2001). «Этилцианоацетат». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.re055 . ISBN 0471936235 .
- ^ Перейти обратно: а б с Дж.К.Х. Инглис. «Этилцианоацетат». Органические синтезы . дои : 10.15227/orgsyn.008.0074 .
- ^ Заявка на ЕР 1028105 , Ханзельманн, Пауль и Хильдебранд, Стефан, «Способ получения сложных эфиров цианоуксусной кислоты», опубликована 16 августа 2000 г., передана Lonza AG.
- ^ Патент EP 1208081 , Ханзельманн, Пауль и Хильдебранд, Стефан, «Способ получения эфиров цианоуксусной кислоты», выдан 14 апреля 2004 г., передан Lonza AG.
- ^ Столл, ДР (1947). «Давление пара чистых веществ органических соединений». Индийский англ. Хим . 39 (4): 517–540. дои : 10.1021/ie50448a022 .
- ^ Перейти обратно: а б с Khodzhaeva, M.G.; Bugakov, Yu.V.; Ismailov, T.S.: Heat capacity and thermodynamic functions of ethyl cyanoacetate in Khim.-Farm. Zhur. 21 (1987) 760-762, DOI:10.1007/BF00872889 .
- ^ Запись CAS RN 105-56-6 в базе данных веществ GESTIS Института безопасности и гигиены труда , доступ 3 марта 2011 г.
- ^ Дорохов, В.А.; Баранин С.В.; Диб, А.; Богданов В.С. (1992). « Кодимеры» N- (пирид-2-ил)амидов и этилцианоацетата». Расс. хим. Бык . 41 (2): 287–291. дои : 10.1007/bf00869516 . S2CID 95912295 .
- ^ Чжэн, Шуян; Ю, Чуньхуэй; Шен, Чжэнву (2012). «Этилцианоацетат: новый цианирующий агент для катализируемого палладием цианирования арилгалогенидов». Орг. Летт . 14 (14): 3644–3647. дои : 10.1021/ol3014914 . ПМИД 22783893 .
- ^ Мэри Иглсон: Краткая энциклопедия по химии , Вальтер де Грюйтер, Берлин – Нью-Йорк, 1994, ISBN 3-11-011451-8 .
- ^ Аксель Клеманн , Юрген Энгель: «Фармацевтические активные ингредиенты», 2-е изд., Георг Тиме, Штутгарт - Нью-Йорк, 1982, ISBN 3-13-558402-X .
- ^ Бейер-Вальтер: «Учебник органической химии», 24-е издание, С. Хирцель, Штутгарт - Лейпциг, 2004 г.
- ^ Аветисян А.А.; Ванян, Э. В.; Дангян, Монтана (1980). «Синтез функционально замещенных кумаринов». хим. Гетероцикл. Соединения . 15 (9): 959–960. дои : 10.1007/BF00473834 . S2CID 102024617 .
- ^ Харальд Стриттматтер, Стефан Хильдбранд и Питер Поллак «Малоновая кислота и ее производные» в Энциклопедии промышленной химии Ульмана, 2007, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a16_063.pub2
