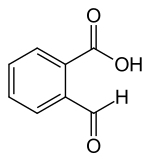
2-карбоксибензальдегид
Эта статья имеет несколько вопросов. Пожалуйста, помогите улучшить его или обсудить эти вопросы на странице разговоров . ( Узнайте, как и когда удалить эти сообщения )
|
| |
| Имена | |
|---|---|
| Предпочтительное имя IUPAC
2-формалбензойная кислота | |
| Другие имена
2-фтальдегидическая кислота
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 742381 | |
| Чеби | |
| Химический | |
| Chemspider | |
| Echa Infocard | 100.003.948 |
| ЕС номер |
|
PubChem CID
|
|
| НЕКОТОРЫЙ | |
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| C 8 H 6 O 3 | |
| растворимый [ 1 ] | |
| Растворимость | растворимый в диэтилтере , этанол [ 1 ] |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
2-карбоксибензальдегид является химическим соединением . Он состоит из бензольного кольца, с альдегидом и карбоновой кислотой в качестве заместителей , которые являются ортонами друг для друга. Соединение демонстрирует таутомеризм кольца-гейна : два заместителя могут реагировать друг с другом с образованием 3-гидроксифталида, циклического лактола . Этот лактол легко реагирует с реагентами Grignard , образуя алкил - и арил -обозначенные фталиды . [ 2 ] Другие бензой с гетероциклические соединения могут быть получены из 2 -карбоксибензальдегида, включая изоиндолиноны и фталазиноны , с различными фармакологическими свойствами, такими как антигистаминный азеластин .
Синтез
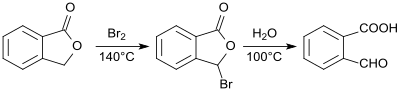
[ редактировать ]2-карбоксибензальдегид был впервые приготовлен из фталида и охарактеризован в 1887 году. [ 3 ] Реакция брома с фталидом продуцирует 2-бромфталид, который превращается в 2-формалбензойную кислоту путем нагревания водой с общим выходом от 78 до 83%. [ 4 ]
аналогичный процесс, основанный на реакции хлорирования : Также можно использовать [ 5 ]
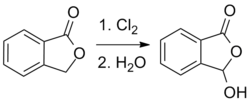
Синтез 1-дихлорметил-2- (трихлорметил) бензола с помощью также сообщалось фотохлорирования оксилола в 1887 году. [ 6 ]

Гидролиз пентахлорсилена до 2 -карбоксибензальдегида проводится путем кипячения с помощью FECL 3 -содержащей соляной кислоты. [ 7 ]
В реакции фталического ангидрида с тетракарбонилферратом натрия только одна из карбоксильных групп уменьшается до альдегида, второе остается неизменным. [ 8 ]
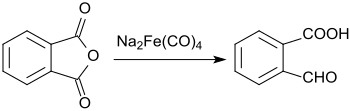
Это дает 2-карбоксибензальдегид с доходностью 61%.
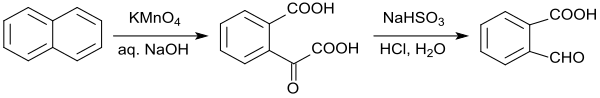
В лабораторной процедуре дано окисление нафталина щелочным перманганатом калия , которое, однако, дает только выход 39% 2-карбоксибензальдегида. [ 9 ] Также окисление нафталина озоном . до 2-формалбензойной кислоты не дает существенных преимуществ [ 10 ]
Характеристики
[ редактировать ]Чистый 2-карбоксибензальдегид представляет собой белый кристаллический порошок, который растворяется в воде и в короткоцепочечных спиртах . В твердой форме и в большинстве растворителей это вещество присутствует в качестве рацемического 3-гидроксифталида (лактола) в результате тавтомеризма кольца-гейна. [ 7 ]

Индекс преломления составляет = 1,4500 (при 25 ° C, 589 нм). [ 11 ]
Приложение
[ редактировать ]В форме лактола 2-карбоксибензальдегид ведет себя как ангидрид карбоновой кислоты и гладко реагирует с спиртами, образующими 3-алкоксифталиды. [ 7 ]

Также с другими нуклеофильными соединениями, такими как тиолы , амины , амиды и т. Д., 3-гидроксифталид реагирует без катализатора с получением соответствующих производных. [ 7 ] Например, он реагирует с морфолином с выходом 91% до 3-морфолинилфталида. [ 12 ] 3-гидроксифталид реагирует с тионилхлоридом в гидроксильной группе (выход 80-90%) до 3-хлорфталида . [ 12 ] С реагентами Grignard гидрокси группа может быть обменена на соответствующую алкильную или арильную группу: [ 2 ]

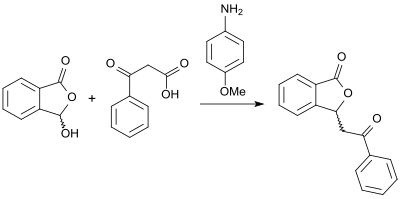
При наличии (+)- кинченина в реакции (рацемических) 3-гидроксифталиде с ангидридами карбоновой кислоты на соответствующие хиральные 3-замещенные фталиды могут быть достигнуты , помимо высоких выходов продукта. [ 13 ] Альтернативный подход к (рацемическому) 3-замещенным фталидам с высокой выходом открывается реакцией 2-карбоксибензальдегида и β-кето кислоты в присутствии основания 4-анисидина в глицерине в качестве растворителя . [ 14 ]
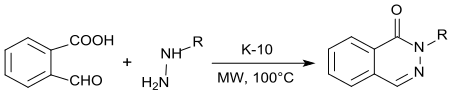
2-карбоксибензальдегид поднята двойная реакция конденсации с гидразином или алкилгидразинами, 1 (2 часа ) -фталеназиноны получают при кислотном катализе с K10- монмориллонитом и микроволновым облучением при высоком урожайном. [ 15 ]
Фталазиноны (1 (2 ч ) -фталеназиноны) являются важными строительными блоками для натуральных продуктов , тонких химических веществ и фармацевтических активных ингредиентов, [ 16 ] такие как антигипертензивный вазодилататор гидралазин . [ 5 ]
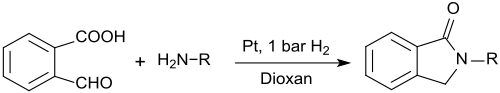
2-карбоксибензальдегид также может использоваться для приготовления N-замещенных изоиндолинонов (1-изоиндолиноны, 2,3-дигидроиндол-1-оон), которые образуются при реагировании 2-карбоксибензальдегида с первичными аминами в присутствии нановилов платиновых давление в 1,4-диоксане с очень высокой урожайностью: [ 16 ]
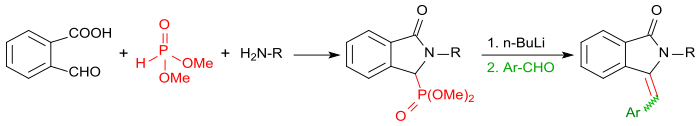
Когда реакция 2-карбоксибензальдегида проводится с первичными аминами в присутствии диметилфосфита , первыми получают соответствующие изоиндолин-1-один-3-фосфонаты. После активации бутиллитом с ароматическими альдегидами (например, бензальдегид в реакции Хорнер-Уодсворт-Эммоны ), они могут быть преобразованы с очень высокими выходами в 3- (арилметилен) изоиндолин-1-оны. [ 17 ]
Совсем недавно 2-формалбензойная кислота стала из-за ее реакционной способности, представляющей некоторый интерес, как универсальный молекулярный строительный блок в многокомпонентных реакциях , например, реакции UGI , для синтеза гетероциклической аннолитированной ароматики. Функционализированные изоиндолиноны доступны на высоких выходах в трехкомпонентной реакции с 2-формалбензойной кислотой и 2-броманилинами с помощью , катализируемого палладием карбонилирования . [ 18 ]

Еще одна трехкомпонентная реакция (здесь проводимая как синтез Strecker ) с 2-карбоксибензальдегидом, первичными аминами и цианидом калия в выходе метанола в кистной среде. N-замещенная изоиндолинон-1-карбонитрил, формально аминоацетонитронный деривация изоиндона с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя молероном с двумя HCN. [ 19 ]

При замене 2-формалбензойной кислоты используются цианид калия и эквимолярные количества первичных ароматических аминов и уксусной кислоты, заменяют изохромы-1-оны ( изокумарины , 1H-2-бензопиран-1-оны) получены на хороших выходах. [ 20 ]

Полученные изохромены количественно превращаются в изоиндолиноны путем реагирования в ДМСО при сужении кольца в замещенные изобензофураны или с каталитическими количествами йода в триэтиламине. [ 21 ]
С изонитрилами вместо цианида калия 2-карбоксибензальдегид и первичные ароматические амины реагируют в метаноле, образуя замещенные изохромен-1-оны, которые преобразуются в изоиндолиноны со следами кислоты. [ 22 ]

Пути синтеза для производного изохинолина [ 23 ] Quinisocaine [ 24 ] (действуя как местный анестетик) и антигистаминный азеластин [ 25 ] также основаны на 2-карбоксибензальдегиде в качестве начального материала.
Ссылки
[ редактировать ]- ^ Jump up to: а беременный Уильям М. Хейнс (2016), Справочник по химии и физике CRC, 97 -е издание , Бока -Ратон, Флорида, США: CRC Press, стр. 3–278, ISBN 978-1-4987-5429-3
- ^ Jump up to: а беременный П. Каннон; Дж. Пламондон; Г-н Акссира (1988), «Селективные реакции органомагнков с лактолами и лактонами. Синтез первичных диолов», Tetrahedron , vol. 44, нет. 10, с. 2903–2912, doi : 10.1016/s0040-4020 (88) 90027-0
- ^ С. Расин (1887), «VIII. UEBER PHTHALALDEHYDSäure» , JUSUUS LIEBIGS ANN. Химический (на немецком языке), вып. 239, нет. 1, с. 78–91, doi : 10.1002/jlac.18872390106
- ^ «Фталальдегидическая кислота», Органические синтезы , doi : 10.15227/orgsyn.023.0074
{{cite journal}}: Cs1 maint: postscript ( ссылка ) . - ^ Jump up to: а беременный J. Druey; BH Ringier (1951), «21. Гидрифоревты серии фталазина и пиридазина», Helv. Acta (in German), 34 (1): 195–210, doi : 10.1002/hlca.19510340122
- ^ А. Колсон; H. Gautier (1887), «Новый режим хлорирующих карбидов», Ann. Чим. Физический , полет. 6, нет. 11, с. 19–32
- ^ Jump up to: а беременный в дюймовый DD Wheeler; DC Young; DS Erley (1957), «Реакции фталальдегидической кислоты», J. Org. Химический Vol. 22, нет. 5, с. 547–556, doi : 10.1021/jo01356a022
- ^ Ю. Ватанабе; М. Ямашита; ТА Mitsudo; М. Танака; Y. Takegami (1973), «Облегченный синтез альдегидов и альдегидических кислот из ангидридов карбоновой кислоты с использованием тетракарбонилферрата натрия», тетраэдр Lett. Vol. 14, нет. 37, с. 3535–3536, doi : 10.1016/s0040-4039 (01) 86963-x
- ^ «Фталальдегидическая кислота», Органические синтезы , doi : 10.15227/orgsyn.016.0068
{{cite journal}}: Cs1 maint: postscript ( ссылка ) . - ^ L. Seekles (1924), «Орто -фталальдегидическая кислота», Rec. Трав. Чим. Vol. 43, нет. 5, с. 329–340, doi : 10.1002/recl.19240430506
- ^ Carl L. Yaws (2015), Термофизические свойства химических веществ и углеводородов, 2 -е издание , Оксфорд, Великобритания: Elsevier Inc., p. 183, ISBN 978-0-323-28659-6
- ^ Jump up to: а беременный КБ Слоан; Сэм Кох (1983), «Влияние нуклеофильности и ухода групп способности на реакции S N 2 аминов с (ацилокси) алкил-галидами: исследование распределения продуктов», J. Org. Химический Vol. 48, нет. 5, с. 635–640, doi : 10.1021/jo00153a002
- ^ Д. Нидек; SMM Schuler; C. Eschmann; RC Wende; А. Зейтц; Ф. Кеул; PR Schreiner (2017), «Синтез энантиоэнированных фталидов и производных изоиндолинона из 2-формалбензойной кислоты», Synthesis , vol. 49, нет. 2, с. 371–382, doi : 10.1055/s-0036-1589404 , s2cid 100313676
- ^ Л. Цзя; Ф. Хан (2017), «Устойчивый синтез 3-замещенных фталидов посредством каталитической стратегии каскада с одной однопотной из 2-формалбензойной кислоты с β-кето кислотами в глицерине», Beilstein J. Org. Химический Vol. 13, с. 1425–1429, doi : 10.3762/bjoc.13.139 , pmc 5530723 , pmid 28781708
- ^ VM Outerbridge; SM Landge; Х. Тамаки; B. Török (2009), «Микроволновая профессиональная твердоаталяция, катализируемое синтезом однополосных фталазинонов», Synthesis , vol. 2009, нет. 11, с. 1801–1806, doi : 10.1055/s-0028-1088074
- ^ Jump up to: а беременный Л. Ши; Л. Ху; Дж. Ван; X. Cao; H. Gu (2012), «Высокоэффективный синтез N-замещенных изоиндолинонов и фталазинонов с использованием нанопроволок PT в качестве катализаторов», Org. Летал Vol. 14, нет. 7, с. 1876–1879, doi : 10.1021/ol300471a , pmid 22420427
- ^ Ма Рейес-Гонзалес; А. Замундио-Медина; M. Ordónez (2012), «Практический и высокоселективный синтез 3- (арилметилен) изоиндолин-1-оон из 2-формалбензойной кислоты», Tetrahedron Lett. Vol. 53, нет. 43, с. 5756–5758, doi : 10.1016/j.tetlet.2012.08.040
- ^ К. Натте; Дж. Чен; Х. Ли; Х. Нейман; М. Беллер; XF WU (2014), «Катализируемое палладием карбонилирование 2-бромаанилинов с 2-формалбензойной кислотой и 2-халобензальдегидами: эффективный синтез функционализированных изоиндолинонов», Chem. Евро. J. , Vol. 20, нет. 44, с. 14184–14188, doi : 10.1002/chem.201404446 , pmid 25212125
- ^ T. Opatz; D. Ferenc (2004), "An unexpected three-component condensation leading to amino-(3-oxo-2,3-dihydro-1H-isoindol-1-ylidene)-acetonitriles", J. Org. Chem., vol. 69, no. 24, pp. 8496–8499, doi:10.1021/jo0486802, PMID 15549828
- ^ T. Opatz; D. Ferenc (2005), "Facile preparation of 3-amino-4-(arylamino)-1H-isochromen-1-ones by a new multi-component reaction", Eur. J. Org. Chem., vol. 2005, no. 5, pp. 817–821, doi:10.1002/ejoc.200400685
- ^ T. Opatz; D. Ferenc (2006), "Ring contracting rearrangements of 3-amino-4-(arylamino)-1H-isochromen-1-ones", Eur. J. Org. Chem., vol. 1, pp. 121–126, doi:10.1002/ejoc.200500575
- ^ C. Faggi; M. Garcia-Valverde; S. Macaccini; G. Menchi (2010), "Isolation of Ugi four-component condensation primary adducts: A straightforward route to isocoumarins", Org. Lett., vol. 12, no. 4, pp. 788–791, doi:10.1021/ol9028622, PMID 20104888
- ^ J.W. Wilson; N.D. Dawson; W. Brooks; G.E. Ullyot (1949), "Local anesthetics. Aminoalkoxyisoquinoline derivatives", J. Am. Chem. Soc., vol. 71, no. 3, pp. 937–938, doi:10.1021/ja01171a047, PMID 18129083
- ^ F. v. Bruchhausen; et al., eds. (1994), Hagers Handbuch der Pharmazeutischen Praxis, 5. Aufl. (in German), Berlin: Springer, p. 482, doi:10.1007/978-3-642-57880-9, ISBN 978-3-642-63389-8
- ^ G. Scheffler; J. Engel; B. Kutscher; W.S. Sheldrick; P. Bell (1988), "Synthese und Kristallstrukturanalyse von Azelastin", Arch. Pharm. (in German), vol. 321, no. 4, pp. 205–208, doi:10.1002/ardp.19883210406, S2CID 96004319