Хорнер -Уодсворт -Эммонс Реакция
| Хорнер -Уодсворт -Эммонс Реакция | |
|---|---|
| Назван в честь | Леопольд Хорнер Уильям С. Уодсворт Уильям Д. Эммонс |
| Тип реакции | Реакция связи |
| Идентификаторы | |
| Органическая химическая портал | Виттиг-Хорнера-реакция |
| RSC Ontology Id | Rxno: 0000056 |
Реакция Хорнера -Вадсворт-Эммонов (HWE) является химической реакцией, используемой в органической химии стабилизированных фосфонатных карбанионов с альдегидами (или кетонами ) для получения преимущественно электронных алкенов . [ 1 ]
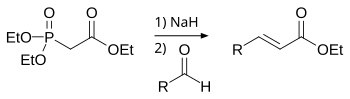
В 1958 году Леопольд Хорнер опубликовал модифицированную реакцию Wittig с использованием фосфонат-стабилизированных Carbanions. [ 2 ] [ 3 ] Уильям С. Уодсворт и Уильям Д. Эммонс также определили реакцию. [ 4 ] [ 5 ]
В отличие от фосфонии, используемых в реакции Wittig , карбанины, стабилизированные фосфонатом, являются более нуклеофильными , но менее основными. Аналогично, карбанины, стабилизированные фосфонатом, могут быть алкилированными. В отличие от фосфонии илидов, побочный продукт диалкилфосфатной соли легко удаляется водной экстракцией .
Несколько обзоров были опубликованы. [ 6 ] [ 7 ] [ 8 ] [ 9 ] [ 10 ] [ 11 ]
Механизм реакции
[ редактировать ]
Реакция Хорнера -Вадсворта -Эммона начинается с депротонирования фосфоната с получением фосфоната Карбаниона 1 . Нуклеофильное добавление карбаниона на альдегид 2 (или кетон), производящий 3A или 3B, является ограничивающим скоростью . [ 12 ] Если р 2 = H, затем промежуточные 3A и 4A и интермедиаты 3B и 4B могут взаимодействовать друг с другом. [ 13 ] Окончательная элиминация oxaphoshetanes , 4a и 4b выход ( e ) -алкен 5 и ( z ) -алкен 6 причем побочный продукт является диалкилфосфатом .

Соотношение алкеновых изомеров 5 и 6 не зависит от стереохимического исхода первоначального добавления Карбаниона и от способности промежуточных соединений уравновешивать .
Электроно -гибельская группа (EWG) альфа для фосфоната необходима для окончательного устранения. В отсутствие группы электронов, конечным продуктом является β-гидроксифосфонат 3A и 3B . [ 14 ] Однако эти β-гидроксифосфонаты могут быть трансформированы в алкены путем реакции с дизопропилкарбодимидом . [ 15 ]
Стереоселективность
[ редактировать ]Реакция Хорнера-Вадсворт-Эммонс способствует образованию ( E ) -лкен. В целом, чем более уравновешивание среди промежуточных соединений, тем выше селективность для ( E формирования ) -алкена.
Разрушенные алкены
[ редактировать ]Томпсон и Хиткок провели систематическое исследование реакции ацетата метила 2- (диметилфосфоно) с различными альдегидами. [ 16 ] В то время как каждый эффект был небольшим, они имели кумулятивный эффект, что позволило модифицировать стереохимический результат без модификации структуры фосфоната. Они обнаружили большую ( E ) -стереоселективность со следующими условиями:
- Увеличение стерической основной массы альдегида
- Более высокие температуры реакции (23 ° С на -78 ° С)
- Li > Na > K salts
В отдельном исследовании было обнаружено, что громоздкий фосфонат и громоздкие группы электронов повышают селективность E-alkene.
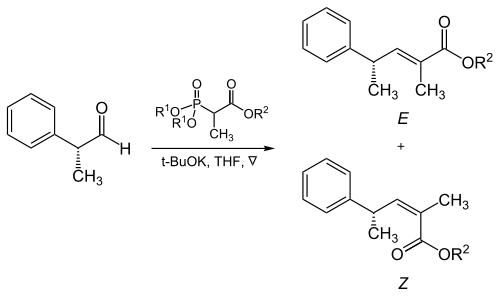
Трисубстационные алкены
[ редактировать ]Стерическая основная часть групп фосфоната и электронов, общечитывающих, играет критическую роль в реакции α-разветвленных фосфонатов с алифатическими альдегидами. [ 17 ]
| Ведущий 1 | Ведущий 2 | Соотношение алкенов (E: Z) |
|---|---|---|
| Метил | Метил | 5 : 95 |
| Метил | Этил | 10 : 90 |
| Этил | Этил | 40 : 60 |
| Изопропил | Этил | 90 : 10 |
| Изопропил | Изопропил | 95 : 5 |
Ароматические альдегиды производят почти исключительно ( E ) -алкена. В случае необходимости ( z ) -лкен из ароматических альдегидов можно использовать модификацию неподвижной веннари (см. Ниже).
Олефинация кетонов
[ редактировать ]Хорнера -Вадсворта - Стереоселективность реакции кетонов плохая или скромная.
Вариации
[ редактировать ]Базовые чувствительные субстраты
[ редактировать ]Поскольку многие субстраты не являются стабильными до гидрида натрия , было разработано несколько процедур с использованием более мягких оснований. Masamune и Roush разработали легкие условия, используя хлорид лития и DBU . [ 18 ] Ратке расширил это до лития или магния галогенидов с триэтиламином . [ 19 ] Несколько других оснований были найдены эффективными. [ 20 ] [ 21 ] [ 22 ]
Все еще модификация
[ редактировать ]W. Clark Still и C. gennari разработали условия, которые дают Z -Alckenes с отличной стереоселективностью. [ 23 ] [ 24 ] Использование фосфонатов с группами электронов (трифторэтил [ 25 ] ) вместе с сильно диссоциирующими условиями ( KHMDS и 18-Crown-6 в THF ) может быть достигнуто почти эксклюзивное производство Z-Alkene.
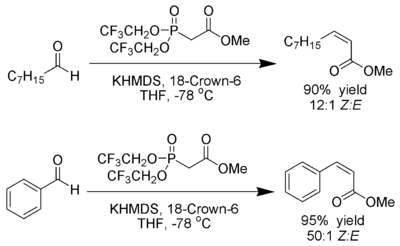
ANDO предположил, что использование электронных дефицитных фосфонатов ускоряет элиминацию оксафосфеттановых промежуточных продуктов. [ 26 ]
Смотрите также
[ редактировать ]- Реакция остроумия
- Michaelis–Arbuzov reaction
- Михаэлис - Бекерская реакция
- Петерсон реакция
- Tebbe Olefination
Ссылки
[ редактировать ]- ^ Wadsworth, W. Org. Реагировать. 1977, 25 , 73. Два : 10.1002/0471264180.or025.02
- ^ Леопольд Хорнер ; Хоффманн, HMR; Wippel, Hg Ber. 1958, 91 , 61–63.
- ^ Horner, L.; Хоффманн, HMR; Wippel, Hg; Клар, Г. Бер. 1959, 92 , 2499–2505.
- ^ Wadsworth, WS, Jr.; Эммонс, WD J. Am. Химический Соц 1961, 83 , 1733. ( два : 10.1021/ja01468a042 )
- ^ Wadsworth, WS, Jr.; Emmons, WD Organic Syntheses , Coll. Тол. 5, с. 547 (1973); Тол. 45, с. 44 (1965). ( Статья )
- ^ Wadsworth, WS, Jr. Org. Реагировать. 1977, 25 , 73–253. (Обзор)
- ^ Boutagy, J.; Томас, Р. Хим. Rev. 1974, 74 , 87–99. (Обзор, Два : 10.1021/cr60287a005 )
- ^ Kelly, SE COCR. Орг Синтезатор 1991, 1 , 729–817. (Обзор)
- ^ Будь Мэрианофф ; Рейтц, AB Chem. Rev. 1989, 89 , 863–927. (Обзор, два : 10.1021/cr00094a007 )
- ^ Bisceglia, JA, Orelli, LR Curr. Орг Химический 2012, 16 , 2206–2230 (обзор)
- ^ Bisceglia, JA, Orelli, LR Curr. Орг Химический 2015, 19 , 744–775 (обзор)
- ^ Ларсен, Ro; Aksnes, G. Phosphorus Sulfur 1983, 15 , 218–219.
- ^ Lefèbvre, G.; Seyden-Penne, J. J. Chem Soc., Chem. Commun. 1970, 1308–09.
- ^ Кори, EJ ; Kwiatkowski, GT J. Am. Химический Соц 1966, 88 , 5654–56. ( Два : 10.1021/ja00975a057 )
- ^ Рейхвейн, JF; Pagenkopf, Bl J. Am. Хим. 2003, 125 , 1821–24. (( два : 10.1021/ja027658s )
- ^ Томпсон, SK; Хиткок, Ч. Дж. Орг. Химический 1990, 55 , 3386–88. ( doi : 10.1021/jo00297a076 )
- ^ ^ Kishi, Y. Isitored 1981, 37 , 3873–3888888.
- ^ Бланшетт, Массачусетс; Choy, W.; Дэвис, JT; Essenfeld, AP; Masamune, S.; Roush, WR; Сакай, Т. Тетраэдрон Письма 1984, 25 , 2183–2186.
- ^ Rathke, MW; Новак, М. Дж. Орг. Химический 1985, 50 , 2624–2626. ( два : 10.1021/jo00215a004 )
- ^ Патерсон, я.; Yeung, K.-S.; Smaill, JB Synlett 1993, 774.
- ^ Simoni, D.; Росси, М.; Ронданин, Р.; Mazzali, A.; Baruchello, R.; Malagutti, C.; Роберти, М.; Завидовал, FP Org. Письма 2000, 2 , 3765–3768.
- ^ Blasdel, LK; Майерс, Ag Org. Письма 2005, 7 , 4281–4283.
- ^ Все еще, WC; Gennari, C. Tetrahedron Letters 1983, 24 , 4405–4408.
- ^ Яницки, Igsancy; Килбасиньский, Петр (2020). «Все еще -геннари олефинация и ее применение в органическом синтезе» . Расширенный синтез и катализ . 362 (13): 2552–2596. doi : 10.1002/adsc.201901591 . ISSN 1615-4169 . S2CID 216228029 .
- ^ Potois, c.; Savignac, P.; About-Jaudet, E.; Collignon, N. Organic Syntheses , Coll. Том 9, с. 88 (1998); Том. 152 (1996). ( Статья )
- ^ Индо, К. Дж. Орг. Химический 1997, 62 , 1934–1939. ( Два : 10.1021/jo970057c )