Трансферное гидрирование
В химии . переносное гидрирование — это химическая реакция, включающая присоединение водорода к соединению из источника, отличного от молекулярного Н 2 . Применяется в лабораторном и промышленном органическом синтезе для насыщения органических соединений и восстановления кетонов до спиртов , иминов до аминов . Это позволяет избежать необходимости в молекулярном методе высокого давления. H 2 используется при обычном гидрировании . Трансферное гидрирование обычно происходит при мягких условиях температуры и давления с использованием органических или металлорганических катализаторов, многие из которых являются хиральными , что обеспечивает эффективный асимметричный синтез . Он использует соединения-доноры водорода, такие как муравьиная кислота , изопропанол или дигидроантрацен , дегидрируя их до CO 2 , ацетон или антрацен соответственно. [1] Часто молекулы-доноры также действуют как растворители реакции. Широкомасштабным применением трансферного гидрирования является сжижение угля с использованием «донорных растворителей», таких как тетралин . [2] [3]
Металлоорганические катализаторы
[ редактировать ]В области органического синтеза было разработано полезное семейство катализаторов переноса водорода на основе комплексов рутения и родия , часто с диаминовыми и фосфиновыми лигандами. [4] Типичный предшественник катализатора получают из димера дихлорида (цимол)рутения и тозилированного дифенилэтилендиамина . Эти катализаторы используются для восстановления кетонов аминов и иминов до спиртов и в основном соответственно. Донором водорода (переносчиком) обычно является изопропанол , который превращается в ацетон при отдаче водорода. Трансферное гидрирование может протекать с высокой энантиоселективностью, если исходный материал является прохиральным :
где RR'C*H-OH представляет собой хиральный продукт. Типичный катализатор (цимен) R,R -HNCPHCHPhNTs , где Ts относится к тозильной группе ( SO 2 C 6 H 4 Me ), а R,R относится к абсолютной конфигурации двух хиральных углеродных центров. Эта работа была отмечена Нобелевской премией по химии 2001 года Рёдзи Ноёри . [5]
Другое семейство агентов переноса водорода основано на алкоксидах алюминия, таких как изопропоксид алюминия при восстановлении MPV ; однако их активность относительно низка по сравнению с системами на основе переходных металлов.

Каталитическое асимметрическое гидрирование кетонов на основе рутения было продемонстрировано на комплексах BINAP . [6] [7]
Несмотря на то, что дигалогенидный катализатор БИНАП-Ru мог восстанавливать функционализированные кетоны, вопрос гидрирования простых кетонов оставался нерешенным. Эта проблема была решена с помощью прекатализаторов типа RuCl 2 ( дифосфан ) (диамин). [8] Эти катализаторы преимущественно восстанавливают кетоны и альдегиды, не затрагивая олефины и многие другие заместители.

Безметалловые маршруты
[ редактировать ]До развития каталитического гидрирования было разработано множество методов гидрирования ненасыщенных субстратов. Многие из этих методов представляют лишь историко-педагогический интерес. Одним из известных агентов гидрогенизации является диимид или (NH) 2 , также называемый диазеном. Он окисляется до очень стабильного N 2 :
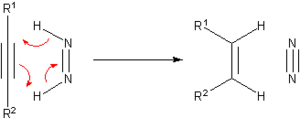
Диимид можно получить из гидразина или некоторых других органических предшественников.
Двумя углеводородами, которые могут служить донорами водорода, являются циклогексен и циклогексадиен . В этом случае алкан образуется вместе с бензолом . Прирост энергии стабилизации ароматических соединений при образовании бензола является движущей силой реакции. Pd можно использовать в качестве катализатора при температуре 100 °C. Сообщалось о более экзотических трансферных гидрированиях, включая внутримолекулярное:

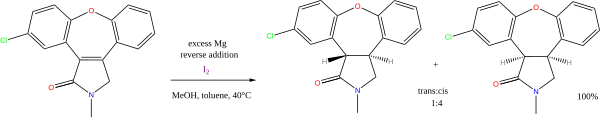
Многие реакции существуют с алкоголем или аминами в качестве доноров протонов и щелочными металлами в качестве доноров электронов. с помощью металлического натрия Непреходящее значение имеет восстановление аренов по Берчу ( другое название ароматических углеводородов ) . Менее важным в настоящее время является восстановление сложных эфиров по Буво-Блану . Комбинация магния и метанола используется при восстановлении алкенов, например, при синтезе азенапина : [11]
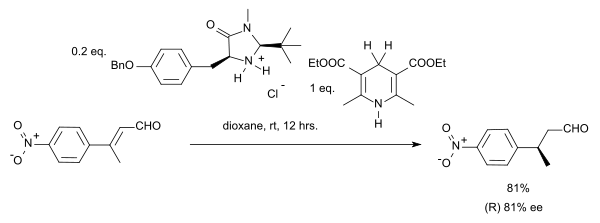
Органокаталитическое трансферное гидрирование
[ редактировать ]Органокаталитическое гидрирование с переносом было описано группой Листа в 2004 году в системе с эфиром Ганча в качестве донора гидрида и аминным катализатором: [12]
В этой конкретной реакции субстратом является α,β-ненасыщенное карбонильное соединение . Донор протона окисляется до пиридиновой формы и напоминает биохимически значимый кофермент НАДН . В каталитическом цикле этой реакции амин и альдегид сначала образуют иминий-ион , затем за переносом протона следует гидролиз иминиевой связи, регенерирующий катализатор. Путем применения хирального имидазолидинонового органокатализатора Макмиллана была получена энантиоселективность энантиоселективности 81% ее :
В случае стереоконвергенции , так как E-изомер и Z-изомер в этой реакции дают (S) -энантиомер .
Расширение масштабов этой реакции на кетоны или, скорее, еноны требует тонкой настройки катализатора (добавление бензильной группы и замена трет-бутильной группы на фуран ) и сложного эфира Ганча (добавление более объемных трет-бутильных групп): [14]
также можно провести с использованием другого органокатализатора Гидрирование иминов . Одна каскадная реакция катализируется хиральной фосфорной кислотой : [15]
Реакция протекает через хиральный иминий-ион . Традиционные катализаторы на основе металлов, гидрирование ароматических или гетероароматических субстратов, как правило, не дают результатов.
См. также
[ редактировать ]- Редукция Меервейна – Понндорфа – Верли
- Окисление Оппенауэра
- Дегидрирование
- гидрирование
- Гидрогенолиз
- Заимствование водорода
Ссылки
[ редактировать ]- ^ Ван, Донг; Астрюк, Дидье (2015). «Золотой век трансферного гидрирования». хим. Преподобный . 115 (13): 6621–6686. doi : 10.1021/acs.chemrev.5b00203 . ISSN 0009-2665 .
- ^ Спейт, Дж. Г. «Химия и технология угля» Марсель Деккер; Нью-Йорк, 1983 год; п. 226 и далее. ISBN 0-8247-1915-8 .
- ^ Муньис, Килиан (2005). «Бифункциональный металл-лигандный катализ: гидрирование и новые реакции внутри металл-(ди)аминного каркаса13». Angewandte Chemie, международное издание . 44 (41): 6622–6627. дои : 10.1002/anie.200501787 . ПМИД 16187395 .
- ^ Т. Икария, К. Мурата, Р. Нойори «Бифункциональные молекулярные катализаторы на основе переходных металлов для асимметричного синтеза» Org. Биомол. Хим., 2006, том 4, 393–406.
- ^ Симидзу Х., Нагасаки И., Мацумура К., Сайо Н. и Сайто Т. «Развитие асимметричного гидрирования с промышленной точки зрения» Acc. хим. Рез. 2007, вып. 40, стр. 1385–1393. два : 10.1021/ar700101x
- ^ Машима, К.; Кусано, К.-х.; Сато, Н.; Мацумура, Ю.-и.; Нодзаки, К.; Кумобаяши, Х.; Сайо, Н.; Хори, Ю.; Ишизаки, Т. (1994), «Катионные галогенидные комплексы BINAP -Ru(II): высокоэффективные катализаторы для стереоселективного асимметричного гидрирования α- и β-функционализированных кетонов», Журнал органической химии , 59 (11): 3064–3076 , дои : 10.1021/jo00090a026
- ^ Китамура, М.; Окума, Т.; Иноуэ, С.; Сайо, Н.; Кумобаяши, Х.; Акутагава, С.; Охта, Т.; Такая, Х.; Нойори, Р. (1988), «Гомогенное асимметричное гидрирование функционализированных кетонов», Журнал Американского химического общества , 110 (2): 629–631, doi : 10.1021/ja00210a070.
- ^ Ноёри, Р.; Окума, Т. (2001), «Асимметричный катализ с помощью архитектурной и функциональной молекулярной инженерии: практическое химио- и стереоселективное гидрирование кетонов», Angewandte Chemie International Edition , 40 (1): 40–73, doi : 10.1002/1521-3773( 20010105)40:1<40::aid-anie40>3.0.co;2-5 , PMID 11169691
- ^ Дуб, Павел А.; Гордон, Джон К. (2018). «Роль связанной с металлом функциональности N – H в молекулярных катализаторах типа Нойори». Обзоры природы Химия . 2 (12): 396–408. дои : 10.1038/s41570-018-0049-z . S2CID 106394152 .
- ^ ММ Мидленд (1989). «Асимметричное восстановление с органоборановыми реагентами». Химические обзоры . 89 (7): 1553–1561. дои : 10.1021/cr00097a010 .
- ^ Линден, МВД; Ретерс, Т.; Хартинг, Р.; Стоккингриф, Э.; Гелпке, А.С.; Кемперман, Г. (2008). «Устранение узких мест на пути синтеза азенапина». Исследования и разработки органических процессов . 12 (2): 196–201. дои : 10.1021/op700240c .
- ^ Ян; Хечаваррия Фонсека, М.; Лист, Б. (2004). «Безметалловое трансферное гидрирование: органокаталитическое сопряженное восстановление альфа, бета-ненасыщенных альдегидов» . Angewandte Chemie International Edition на английском языке . 43 (48): 6660–6662. дои : 10.1002/anie.200461816 . ПМИД 15540245 .
- ^ Уэлле; Таттл, Дж.; Макмиллан, Д. (2005). «Энантиоселективное органокаталитическое восстановление гидридов». Журнал Американского химического общества . 127 (1): 32–33. дои : 10.1021/ja043834g . ПМИД 15631434 .
- ^ Таттл; Уэлле, С.; Макмиллан, Д. (2006). «Органокаталитическое трансферное гидрирование циклических енонов» (PDF) . Журнал Американского химического общества . 128 (39): 12662–12663. дои : 10.1021/ja0653066 . ПМИД 17002356 . S2CID 12456921 .
- ^ Рюпинг; Антончик, А.; Тайссманн, Т. (2006). «Высокоэнантиоселективная каскадная реакция, катализируемая кислотой Бренстеда: органокаталитическое трансферное гидрирование хинолинов и их применение в синтезе алкалоидов». Angewandte Chemie International Edition на английском языке . 45 (22): 3683–3686. дои : 10.1002/anie.200600191 . ПМИД 16639754 .