Клеточные соединения
| Клеточные соединения | |
|---|---|
 Плотный контакт между двумя клетками | |
| Подробности | |
| Идентификаторы | |
| латинский | клеточные соединения |
| ТД | Х1.00.01.0.00012 |
| ФМА | 67394 |
| Анатомическая терминология | |
Клеточные соединения [1] или соединительные комплексы — это класс клеточных структур, состоящий из мультибелковых комплексов , которые обеспечивают контакт или адгезию между соседними клетками или между клеткой и внеклеточным матриксом у животных. [2] Они также поддерживают параклеточный барьер эпителия и контролируют парацеллюлярный транспорт . Клеточные соединения особенно богаты в эпителиальных тканях. В сочетании с молекулами клеточной адгезии и внеклеточным матриксом клеточные соединения помогают удерживать клетки животных вместе.
Клеточные соединения также особенно важны для обеспечения связи между соседними клетками через специализированные белковые комплексы, называемые сообщающимися (щелевыми) соединениями . Клеточные соединения также важны для снижения стресса, оказываемого клеткам.
У растений подобные каналы связи известны как плазмодесмы , а у грибов — септальные поры . [3]
Типы
[ редактировать ]
У позвоночных существует три основных типа клеточных соединений:
- Адгеренсные соединения , десмосомы и гемидесмосомы (якорные соединения)
- Щелевые соединения [4] (сообщающийся узел)
- Плотные соединения (закрывающие соединения)
У беспозвоночных есть несколько других типов специфических соединений, например, перегородчатые соединения или апикальное соединение C. elegans . У многоклеточных растений структурные функции клеточных соединений выполняются клеточными стенками . Аналоги коммуникативных клеточных соединений у растений называются плазмодесмами .
Анкеровка соединений
[ редактировать ]Клетки в тканях и органах должны быть прикреплены друг к другу и прикреплены к компонентам внеклеточного матрикса . Клетки развили несколько типов соединительных комплексов, выполняющих эти функции, и в каждом случае якорные белки проходят через плазматическую мембрану, связывая белки цитоскелета в одной клетке с белками цитоскелета в соседних клетках, а также с белками во внеклеточном матриксе. [5]
Наблюдаются три типа якорных соединений , которые отличаются друг от друга якорем цитоскелетного белка, а также трансмембранным линкерным белком, который проходит через мембрану:
| перекресток | Цитоскелетный якорь | Трансмембранный линкер | Связывает ячейку с: |
|---|---|---|---|
| Десмосомы | Промежуточные нити | Кагерин | Другие ячейки |
| полудесмосомы | Промежуточные нити | Интегрины | Матрица ЕС |
| Адгезионные соединения (адгезионный пояс, фокальная адгезия) | Актиновые нити | Кадгерин /Интегрин/ Нектины | Другие ячейки/ матрица ЕС |
Соединения якорного типа не только удерживают клетки вместе, но и обеспечивают тканям структурную сплоченность. Эти соединения наиболее распространены в тканях, которые подвергаются постоянным механическим нагрузкам, таких как кожа и сердце. [5]
Десмосомы
[ редактировать ]
Десмосомы, также называемые прилипшими пятнами, можно визуализировать как заклепки, проходящие через плазматическую мембрану соседних клеток. Промежуточные нити, состоящие из кератина или десмина, прикрепляются к связанным с мембраной белкам прикрепления, которые образуют плотную бляшку на цитоплазматической поверхности мембраны. Молекулы кадгерина образуют настоящий якорь, прикрепляясь к цитоплазматической бляшке, проходя через мембрану и прочно связываясь с кадгеринами, проходящими через мембрану соседней клетки. [6]
полудесмосомы
[ редактировать ]Гемидесмосомы образуют заклепочные связи между цитоскелетом и компонентами внеклеточного матрикса, такими как базальные пластинки , которые лежат в основе эпителия. Подобно десмосомам, они прикрепляются к промежуточным нитям цитоплазмы, но в отличие от десмосом их трансмембранными якорями являются интегрины, а не кадгерины. [7]
Прилегающие соединения
[ редактировать ]Адгерентные соединения имеют общие характеристики закрепления клеток посредством цитоплазматических актиновых филаментов . Подобно десмосомам и гемидесмосомам, их трансмембранные якоря состоят из кадгеринов в тех, которые прикрепляются к другим клеткам, и интегринов (фокальная адгезия) в тех, которые прикрепляются к внеклеточному матриксу. Среди слипчивых соединений имеется значительное морфологическое разнообразие . Те, которые связывают клетки друг с другом, выглядят как изолированные полосы или пятна или как полосы, полностью окружающие клетку. Ленточный тип слипчивых соединений связан с пучками актиновых нитей, которые также окружают клетку чуть ниже плазматической мембраны. Пятнистые слипчивые соединения, называемые фокальными спайками, помогают клеткам прикрепляться к внеклеточному матриксу. Цитоскелетные актиновые филаменты, которые соединяются в слипчивые соединения, представляют собой сократительные белки и, помимо обеспечения функции закрепления, слипчивые соединения, как полагают, участвуют в складывании и изгибе листов эпителиальных клеток. Представление о полосах актиновых нитей как о «шнурках» позволяет представить, как сокращение полос внутри группы клеток искажает лист, образуя интересные узоры. [5]
Щелевые соединения
[ редактировать ]Щелевые соединения или сообщающиеся соединения обеспечивают прямую химическую связь между соседней клеточной цитоплазмой посредством диффузии без контакта с внеклеточной жидкостью. [8] Это возможно благодаря шести белкам коннексина , взаимодействующим с образованием цилиндра с порой в центре, называемого коннексоном . [9] Комплексы коннексонов простираются через клеточную мембрану, и когда два соседних клеточных коннексона взаимодействуют, они образуют полный канал щелевого соединения. [8] [9] Поры коннексона различаются по размеру, полярности и, следовательно, могут быть специфичными в зависимости от белков коннексина, которые составляют каждый отдельный коннексон. [8] [9] Хотя изменения в каналах щелевых соединений действительно происходят, их структура остается относительно стандартной, и это взаимодействие обеспечивает эффективную связь без выхода молекул или ионов во внеклеточную жидкость. [9]
Щелевые соединения играют жизненно важную роль в организме человека. [10] в том числе их роль в равномерном сокращении сердечной мышцы . [10] Они также важны для передачи сигналов в мозге , а их отсутствие указывает на снижение плотности клеток в мозге. [11] Клетки сетчатки и кожи также зависят от щелевых соединений в дифференцировке и пролиферации клеток. [10] [11]
Плотные соединения
[ редактировать ]Плотные соединения , обнаруженные в эпителии позвоночных , действуют как барьеры, регулирующие движение воды и растворенных веществ между слоями эпителия. Плотные соединения классифицируются как парацеллюлярный барьер, который определяется как не имеющий направленной дискриминации; однако движение растворенного вещества во многом зависит от размера и заряда. Есть основания полагать, что структуры, через которые проходят растворенные вещества, чем-то напоминают поры.
Физиологический pH играет роль в селективности прохождения растворенных веществ через плотные контакты, при этом большинство плотных контактов слегка селективны по отношению к катионам. Плотные контакты, присутствующие в разных типах эпителия, избирательны к растворенным веществам разного размера, заряда и полярности.
Белки
[ редактировать ]Было идентифицировано около 40 белков, участвующих в плотных соединениях. Эти белки можно разделить на четыре основные категории: сигнальные белки.
Роли
[ редактировать ]- Белки-каркасы - организуют трансмембранные белки, соединяют трансмембранные белки с другими цитоплазматическими белками, а также с актиновыми нитями.
- Сигнальные белки – участвуют в сборке соединений, регуляции барьера и транскрипции генов.
- Регуляторные белки – регулируют нацеливание на мембранные пузырьки.
- Трансмембранные белки , включая молекулы соединительной адгезии , окклюдин и клаудин .
Считается, что клаудин — это белковая молекула, ответственная за избирательную проницаемость между слоями эпителия.
Трехмерное изображение еще предстоит получить, и поэтому конкретная информация о функции плотных контактов еще не определена.
Трехклеточные соединения
[ редактировать ]Трехклеточные соединения уплотняют эпителий по углам трех клеток. Из-за геометрии трехклеточных вершин запечатывание клеток в этих местах требует специфической организации соединений, отличной от таковой в двухклеточных соединениях. У позвоночных компонентами трехклеточных соединений являются трицеллюлиновые и стимулируемые липолизом липопротеиновые рецепторы. У беспозвоночных компонентами являются глиотактин и анаконда. [12]
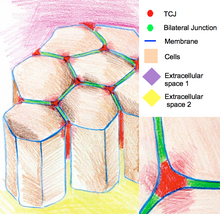
Трехклеточные соединения также участвуют в регуляции цитоскелетной организации и клеточных делений. В частности, они обеспечивают деление клеток по правилу Гертвига . У некоторых эпителиев дрозофилы во время клеточных делений трехклеточные соединения устанавливают физический контакт с веретенообразным аппаратом через астральные микротрубочки. Трехклеточные соединения оказывают тянущее усилие на веретенообразный аппарат и служат геометрическим ключом к определению ориентации клеточных делений. [13]
Молекулы клеточного соединения
[ редактировать ]Молекулы, ответственные за создание клеточных соединений, включают различные молекулы клеточной адгезии . Существует четыре основных типа: селектины , кадгерины , интегрины и суперсемейство иммуноглобулинов . [14]
Селектины – молекулы клеточной адгезии, играющие важную роль в инициации воспалительных процессов. [15] Функциональная способность селектина ограничена сотрудничеством лейкоцитов с сосудистым эндотелием. У человека обнаружено три типа селектинов; L-селектин, Р-селектин и Е-селектин. L-селектин взаимодействует с лимфоцитами, моноцитами и нейтрофилами, P-селектин — с тромбоцитами и эндотелием, а E-селектин — только с эндотелием. У них есть внеклеточные области, состоящие из аминоконцевого лектинового домена, присоединенного к углеводному лиганду, домена, подобного фактору роста, и коротких повторяющихся единиц (пронумерованные кружки), которые соответствуют доменам комплементарного связывающего белка. [16]
Кадгерины представляют собой кальций-зависимые молекулы адгезии. Кадгерины чрезвычайно важны в процессе морфогенеза – развития плода . Вместе с альфа-бета -катениновым комплексом кадгерин может связываться с микрофиламентами цитоскелета клетки. Это обеспечивает гомофильную межклеточную адгезию. [17] Связанный комплекс β -катенин - α-катенин в адгезионных соединениях позволяет формировать динамическую связь с актиновым цитоскелетом. [18]
Интегрины действуют как рецепторы адгезии, транспортируя сигналы через плазматическую мембрану во многих направлениях. Эти молекулы являются неоценимой частью клеточной коммуникации, поскольку один лиганд может использоваться для многих интегринов. К сожалению, этим молекулам еще предстоит пройти долгий путь исследований. [19]
Суперсемейство иммуноглобулинов представляет собой группу кальций-независимых белков, способных к гомофильной и гетерофильной адгезии. Гомофильная адгезия предполагает связывание иммуноглобулиноподобных доменов на поверхности клетки с иммуноглобулиноподобными доменами на поверхности противоположной клетки, тогда как гетерофильная адгезия означает связывание иммуноглобулиноподобных доменов с интегринами и углеводами. [20]
Клеточная адгезия является жизненно важным компонентом организма. Потеря этой адгезии влияет на структуру клеток, их функционирование и связь с другими клетками и внеклеточным матриксом и может привести к серьезным проблемам со здоровьем и заболеваниям.
Ссылки
[ редактировать ]- ^ Митчелл, Ричард Шеппард; Кумар, Винай; Аббас, Абул К.; Фаусто, Нельсон (2007). «Глава 13: Вставка по морфологии плоскоклеточного рака». Основная патология Роббинса (8-е изд.). Филадельфия: Сондерс. ISBN 978-1-4160-2973-1 .
- ^ Фу, Ронг; Цзян, Сяовань; Ли, Банда; Чжу, И; Чжан, Хуэйминь (декабрь 2022 г.). «Соединительные комплексы в эпителиальных клетках: стражи внеклеточных повреждений и внутриклеточный гомеостаз» . Журнал ФЭБС . 289 (23): 7314–7333. дои : 10.1111/февраль 16174 . ПМИД 34453866 . S2CID 237347708 . Проверено 23 января 2023 г.
- ^ Блумендаль, С; Кюк, У (январь 2013 г.). «Межклеточная связь у растений, животных и грибов: сравнительный обзор». Die Naturwissenschaften . 100 (1): 3–19. Бибкод : 2013NW....100....3B . дои : 10.1007/s00114-012-0988-z . ПМИД 23128987 . S2CID 11991859 .
- ^ Эндрю Л. Харрис; Даррен Локк (2009). Коннексины, Руководство . Нью-Йорк: Спрингер. п. 574. ИСБН 978-1-934115-46-6 .
- ^ Jump up to: а б с Ян Х.Х., Мрук Д.Д., Ли В.М., Ченг С.И. (2009). «Перекрестный разговор между плотными и якорными соединениями — урок яичка» . Молекулярные механизмы сперматогенеза . Достижения экспериментальной медицины и биологии. Том. 636. Нью-Йорк, штат Нью-Йорк: Springer-Verlag New York. стр. 234–54 . дои : 10.1007/978-0-387-09597-4_13 . ISBN 978-0-387-79990-2 . ПМК 4080640 . ПМИД 19856171 .
- ^ Ли П.П., Ченг С.И., Мрук Д.Д. (2011). Биология десмосомоподобного соединения — универсального закрепляющего соединения и преобразователя сигнала в семенном эпителии . Том. 286. стр. 223–69. дои : 10.1016/B978-0-12-385859-7.00005-7 . ISBN 9780123858597 . ПМК 4381909 . ПМИД 21199783 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Гипсон И.К., Сперр-Мишо С.Дж., Тисдейл А.С. (апрель 1988 г.). «Полудесмосомы и коллаген, закрепляющий фибриллы, появляются синхронно во время развития и заживления ран». Биология развития . 126 (2): 253–62. дои : 10.1016/0012-1606(88)90136-4 . ПМИД 3350210 .
- ^ Jump up to: а б с Эванс WH, Мартин PE (2002). «Щелевые соединения: строение и функции (Обзор)» . Молекулярная мембранная биология . 19 (2): 121–36. дои : 10.1080/09687680210139839 . ПМИД 12126230 . S2CID 20806078 .
- ^ Jump up to: а б с д Лампе П.Д., Лау А.Ф. (июль 2004 г.). «Влияние фосфорилирования коннексина на связь по щелевым соединениям» . Международный журнал биохимии и клеточной биологии . 36 (7): 1171–86. дои : 10.1016/S1357-2725(03)00264-4 . ПМК 2878204 . ПМИД 15109565 .
- ^ Jump up to: а б с «Тезисы: материалы Международной конференции Gap Junction. 5–9 августа 2007 г. Эльсинор, Дания». Клеточная связь и адгезия . 14 (6): 275–346. 2007. дои : 10.1080/15419060801891042 . ПМИД 18392995 .
- ^ Jump up to: а б Вэй CJ, Сюй X, Ло CW (2004). «Коннексины и клеточная передача сигналов в развитии и заболеваниях». Ежегодный обзор клеточной биологии и биологии развития . 20 : 811–38. doi : 10.1146/annurev.cellbio.19.111301.144309 . ПМИД 15473861 .
- ^ Байри С., Мисра Т., Сайед З.А., Бац Т., Шах Дж., Борил Л., Глашаузер Дж., Эгертер-Вильмсен Т., Мацат Т., Муссиан Б., Ув А., Лушниг С. (2015). «Белок Anakonda с тройным повторением контролирует образование эпителиальных трехклеточных соединений у дрозофилы» . Развивающая клетка . 33 (5): 535–48. дои : 10.1016/j.devcel.2015.03.023 . ПМИД 25982676 .
- ^ Босвельд Ф., Маркова О., Гирао Б., Мартин С., Ван З., Пьер А., Балакирева М., Гог И., Эйнсли А., Кристофору Н., Лубенский Д.К., Минк Н., Беллаиш Ю. (2016). «Эпителиальные трехклеточные соединения действуют как датчики формы интерфазных клеток, ориентируя митоз» . Природа . 530 (7591): 496–8. Бибкод : 2016Natur.530..495B . дои : 10.1038/nature16970 . ПМК 5450930 . ПМИД 26886796 .
- ^ Лодиш; и др. (2007). Молекулярно-клеточная биология (6-е изд.). WH Фриман и компания. п. 803. ИСБН 978-1429203142 .
- ^ Теддер Т.Ф., Стибер Д.А., Чен А., Энгель П. (июль 1995 г.). «Селектины: молекулы сосудистой адгезии» . Журнал ФАСЭБ . 9 (10): 866–73. дои : 10.1096/fasebj.9.10.7542213 . ПМИД 7542213 . S2CID 8315194 .
- ^ Член парламента Бевилаква, Нельсон Р.М. (февраль 1993 г.). «Селектины» . Журнал клинических исследований . 91 (2): 379–87. дои : 10.1172/JCI116210 . ПМК 287934 . ПМИД 7679406 .
- ^ Роулендс Т.М., Саймондс Дж.М., Фарухи Р., Блащук О.В. (январь 2000 г.). «Кадгерины: важнейшие регуляторы структуры и функции репродуктивных тканей» . Отзывы о репродукции . 5 (1): 53–61. дои : 10.1530/revreprod/5.1.53 . ПМИД 10711736 .
- ^ Брембек Ф.Х., Росарио М., Бирчмайер В. (февраль 2006 г.). «Балансирование клеточной адгезии и передачи сигналов Wnt, ключевая роль β-катенина». Текущее мнение в области генетики и развития . 16 (1): 51–9. дои : 10.1016/j.где.2005.12.007 . ПМИД 16377174 .
- ^ Хайнс Р.О. (сентябрь 2002 г.). «Интегрины: двунаправленные аллостерические сигнальные машины» . Клетка . 110 (6): 673–87. дои : 10.1016/S0092-8674(02)00971-6 . ПМИД 12297042 . S2CID 30326350 .
- ^ Вай Вонг С., Дай Д.Э., Кумб Д.Р. (2012). «Роль молекул клеточной адгезии суперсемейства иммуноглобулинов в метастазах рака» . Международный журнал клеточной биологии . 2012 : 1–9. дои : 10.1155/2012/340296 . ПМЦ 3261479 . ПМИД 22272201 .
Внешние ссылки
[ редактировать ]- Альбертс, Брюс; Джонсон, Александр; Льюис, Джулиан; Рафф, Мартин; Робертс, Кейт; Уолтер, Питер (2002). «Клеточные соединения» . Молекулярная биология клетки (4-е изд.). Нью-Йорк: Garland Science. ISBN 978-0-8153-3218-3 .
- Межклеточные + соединения Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Клеточная матрица + соединения в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)