Кинетическое разрешение
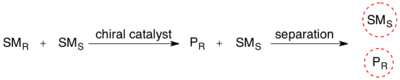
В органической химии кинетическое разрешение является средством дифференциации двух энантиомеров в раковой смеси . В кинетическом разрешении два энантиомера реагируют с различными скоростями реакции в химической реакции с хиральным катализатором или реагентом, что приводит к энантиоэгнированному образцу менее реактивного энантиомера. [ 1 ] В отличие от хирального разрешения , кинетическое разрешение не полагается на различные физические свойства диастереомерных продуктов, а скорее на различные химические свойства раковых начальных материалов. Энантиомерное избыток (EE) непостижимого начального материала постоянно повышается по мере формирования большего количества продукта, достигая 100% незадолго до полного завершения реакции. Кинетическое разрешение зависит от различий в реакционной способности между энантиомерами или энантиомерными комплексами.
Кинетическое разрешение может быть использовано для приготовления хиральных молекул в органическом синтезе . Реакции кинетического разрешения, использующие чисто синтетические реагенты и катализаторы, встречаются гораздо реже, чем использование ферментативного кинетического разрешения в применении к органическому синтезу, хотя за последние 30 лет был разработан ряд полезных синтетических методов. [ 2 ]
История
[ редактировать ]Первое зарегистрированное кинетическое разрешение было достигнуто Луи Пастером . После реагирования водного рацемического аммония с помощью плесени из Penicillium glaucum он определил оставшийся тартрат и обнаружил, что он леворотатор . [ 3 ] Хиральные микроорганизмы, присутствующие в плесени, катализировали метаболизацию ( r , r ) -тартрат избирательно, оставив избыток ( S , S ) -артрат.
в 1899 году сообщили о кинетическом разрешении с помощью синтетических средств Марквальд и Маккензи в 1899 году в эфирировании расической манделиновой кислоты с оптически активным (-)- ментолом . При наличии избытка расичной кислоты они наблюдали образование эфира, полученного из (+)- мандлюновой кислоты , чтобы быстрее, чем образование сложного эфира из (-)- манделиновой кислоты. Было обнаружено, что непрореагированная кислота имеет небольшой избыток (-)-манделиновой кислоты, а позже было показано, что эфир дает (+)-манделиновую кислоту при опонировании. Важность этого наблюдения заключалась в том, что, теоретически, если бы была использована половина эквивалента (-)-ментола, могла быть приготовлена высокоэнантированная образец (-)-мандлюновой кислоты. Это наблюдение привело к успешному кинетическому разрешению других хиральных кислот, что начало использования кинетического разрешения в органической химии. [ 4 ] [ 5 ]
Теория
[ редактировать ]Кинетическое разрешение является возможным методом необратимого дифференциации пары энантиомеров из -за (потенциально) различных энергий активации. В то время как оба энантиомера находятся на одном уровне свободной энергии Гиббса по определению, а продукты реакции с обоими энантиомерами также находятся на равных уровнях, , или переходное состояние энергии, может отличаться. На рисунке ниже у R Enantiomer нижний и, таким образом, будет реагировать быстрее, чем S Enantiomer.
Идеальное кинетическое разрешение - это то, в котором реагирует только один энантиомер, то есть k r >> k s . Селективность R (ы) кинетического разрешения связана с констант скорости реакции R и S Enantiomers, K K S соответственно , S = K R /K S , для K R > K S. и Эта селективность также может быть названа относительной скоростью реакции . Это может быть написано с точки зрения разницы в свободной энергии между состояниями с высокой и низкой энергией переходов, . [ 6 ]
Селективность также может быть выражена в терминах EE извлеченного начального материала и преобразования (C), если предполагается кинетика первого порядка (в субстрате). Если предполагается, что S Enantiomer стартового материального ракемата будет восстановлен в избытке, можно выразить концентрации (кроты) S и R Enantiomers как
где EE является EE стартового материала. Обратите внимание, что для c = 0, что означает начало реакции, , где они означают начальные концентрации энантиомеров. Затем для стехиометрического хирального разрешающего агента B*,
Обратите внимание, что, если решающий агент является стехиометрическим и ахиральным, с хиральным катализатором, термин [B*] не появляется. Независимо от того, с аналогичным выражением для R мы можем выразить S как
Если мы хотим выразить это с точки зрения энантиомерного избытка продукта, EE », мы должны использовать тот факт, что для продуктов R 'и S' из R и S соответственно
Отсюда мы видим это
что дает нам
который, когда мы подключаемся к нашему выражению для получения S, выход, урожайность
Конверсия ( C ) и коэффициент селективности ( S ) могут быть выражены только в терминах начальных материалов и энантиомерных излишек продукта (EE и EE '', соответственно):
Кроме того, выражения для C и EE могут быть параметризованы, чтобы дать явные выражения для C и EE с точки зрения t. Во -первых, явное решение для [s] и [r] в качестве функций t
который, подключенный к выражениям для EE и C, дает
Без потери общности мы можем разрешить k s = 1, что дает k r = s, упрощая вышеупомянутые выражения. Точно так же выражение для EE ″ как функция T может быть получено
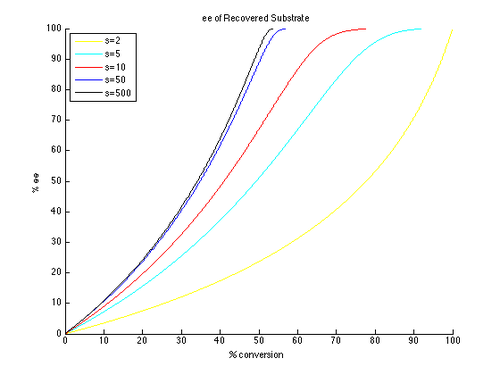
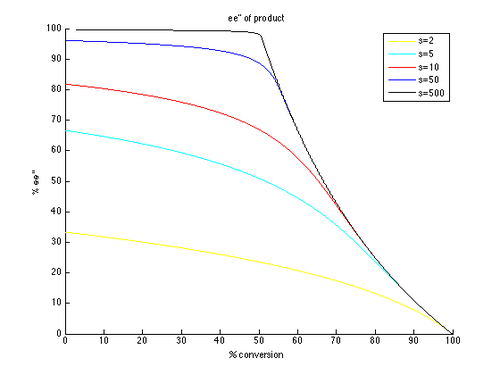
Таким образом, графики EE и EE ″ против C могут быть сгенерированы с помощью T в качестве параметра и различных значений S, генерирующих различные кривые, как показано ниже.
Как видно, высокие энантиомерные излишки гораздо более легко достижимы для непрореагированного начального материала. Однако существует компромисс между EE и конверсией, с более высоким EE (из восстановленного субстрата), полученным при более высокой конверсии, и, следовательно, более низким изолированным выходом. Например, с коэффициентом селективности всего 10, 99% ЭЭ возможен с приблизительно 70% конверсией, что приводит к выходу около 30%. Напротив, для того, чтобы получить хорошие EE и урожайность продукта, необходимы очень высокие коэффициенты селективности. Например, с коэффициентом селективности 10, EE ″ выше приблизительно 80% недостижимо, и значительно более низкие значения EE ″ получают для более реалистичных конверсий. Селективность, превышающая 50, требуется для высокоэнергированного продукта, в разумной урожайности.
Это упрощенная версия истинной кинетики кинетического разрешения. Предположение о том, что реакция является первым порядком в субстрате, ограничивается, и возможно, что зависимость от субстрата может зависеть от конверсии, что приводит к гораздо более сложной картине. В результате общим подходом является измерение и сообщать только доходность и EE, поскольку формула для K REL применима только к идеализированному кинетическому разрешению. Легко рассмотреть начальное формирование комплекса катализатора субстрата, которое может отрицать кинетику первого порядка. Тем не менее, общие выводы все еще полезны для понимания влияния селективности и конверсии на EE.
Практичность
[ редактировать ]С появлением асимметричного катализа необходимо рассмотреть практичность использования кинетического разрешения для приготовления продуктов энантиопов. Даже для продукта, который может быть достигнут через асимметричный каталитический или вспомогательный маршрут, RACEMATE может быть значительно дешевле, чем материал энантиопы, что приведет к повышенной экономической эффективности даже при присущей «потерю» 50% материала. Следующее было предложено в качестве необходимых условий для практического кинетического разрешения: [ 6 ]
- Недорогой Racemate и Catalyst
- подходящего энантиоселективного, хирального пула или классического разрешения. Невозможно
- Разрешение выбирается при низких нагрузках по катализатору
- Разделение начального материала и продукта легко
На сегодняшний день был разработан ряд катализаторов кинетического разрешения, которые удовлетворяют большинству, если не все вышеперечисленные критерии, что делает их очень практичными для использования в органическом синтезе. В следующих разделах будет обсуждаться ряд ключевых примеров.
Реакции, использующие синтетические реагенты
[ редактировать ]Реакции ацилирования
[ редактировать ]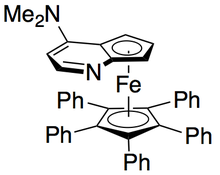
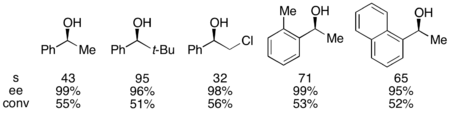
Грегори Фу и его коллеги разработали методологию, использующую хиральный аналог DMAP для достижения превосходного кинетического разрешения вторичных спиртов. [ 7 ] Первоначальные исследования, использующие эфир в качестве растворителя, низкие нагрузки на катализатор (2 моль %), уксусной ангидрид в качестве ацилирующего агента, а триэтиламин при комнатной температуре давал селективность в диапазоне от 14 до 52, что соответствует EE из обнаруженного алкогольного продукта до 99,2 %до 99,2 %, что соответствует EE извлеченного спирта до 99,2 %, что соответствует ЕЭ Полем [ 8 ] Тем не менее, скрининг растворителя доказал, что использование трет-амилового алкоголя увеличивало как реактивность, так и селективность. [ 9 ]

С эталонным субстратом 1-фенилетанола это соответствовало 99% EE непрореагированного спирта при конверсии 55% при запуске при 0 ° C. Эта система оказалась искусной при разрешении ряда арилалкилкарбинолов, с селективностью до 95 и низким нагрузкой катализатора 1%, как показано ниже, используя (-)-энантиомер катализатора. Это привело к высокоэнасионированным спиртам при очень низких конверсиях, что также дает отличную урожайность. Кроме того, высокая селективность приводит к высокоэнантиоэнированным ацилированным продуктам, с 90% EE-образцом ацилированного спирта для о-толилметилкарбинола, с S = 71.
Кроме того, FU сообщил о первом высокоселективном ацилировании расических диолов (а также десимметризация мезо диолов). При низкой загрузке катализатора 1% Enantioenriched Diol был извлечен с выходом 98% и 43%, при этом диацетат с выходом 39% и 99% EE. Остальная часть материала была извлечена в виде смесью моноацетата.

Планарный хиральный катализатор DMAP также был показан эффективным при кинетически разрешающих пропраргиловые спирты. [ 10 ] В этом случае, однако, было обнаружено, что селективность была самой высокой без каких -либо базовых. При запуске с 1 моль% катализатора при 0 ° C можно достичь селективности до 20. Ограничения этого метода включают требование ненасыщенной функциональности, такой как карбонил или алкены, в удаленной позиции алкинила. Спирты, разрешенные с использованием (+)-энантиомер катализатора DMAP, показаны ниже.

Фу также показал способность своего хирального DMAP -катализатора разрешать аллильные спирты. [ 11 ] Эффективная селективность зависела от наличия либо геминального, либо цис-заместителя в группу с алкоголем, за исключением трансфенилового спирта, который демонстрировал самую высокую селективность. Используя 1-2,5 моль% от (+)-энантиомера катализатора DMAP, спирты, показанные ниже, были разрешены в присутствии триэтиламина.


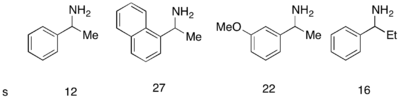
В то время как аналоговый катализатор FU DMAP исключительно хорошо работал для кинетически разрешения рацемических спиртов, он не был успешным в использовании для кинетического разрешения аминов. Был разработан аналогичный катализатор, PPY*, который, используемый с новым ацилирующим агентом, позволил успешно ацилирование аминов кинетического разрешения. При 10 моль% (-)-PPY* в хлороформе при –50 ° C хорошие или очень хорошую селективность наблюдались при ацилировании аминов, показанных ниже. [ 12 ] Аналогичный протокол был разработан для кинетического разрешения индолинов. [ 13 ]
Эпоксидации и дигидроксилиции
[ редактировать ]Эпоксидирование Sharpless , разработанное К. Барри Шарплесс в 1980 году, [ 14 ] был использован для кинетического разрешения раковой смеси аллильных спиртов. [ 15 ] [ 16 ] Хотя этот метод чрезвычайно эффективен в разрешении ряда аллильных спиртов, имеет ряд недостатков. Время реакции может проходить до 6 дней, а катализатор не подлежит переработке. Тем не менее, кинетическое разрешение асимметричного эпоксидирования Sharpless остается одной из наиболее эффективных синтетических кинетических разрешений на сегодняшний день. Для катализатора можно использовать ряд различных тартратов; Репрезентативная схема показана ниже с использованием диизопропилтрата . Этот метод наблюдал общее использование в ряде вторичных аллиловых спиртов. [ 17 ]

Асимметричное дигидроксилирование Sharpless также рассматривало использование в качестве метода кинетического разрешения. [ 18 ] [ 19 ] Однако этот метод широко используется, поскольку одно и то же разрешение может быть выполнено в разных манерах, которые являются более экономичными. Кроме того, было показано, что эпоксидирование SHI влияет на кинетическое разрешение ограниченного выбора олефинов. [ 20 ] Этот метод также не широко используется, но представляет механистический интерес.
Эпоксидные отверстия
[ редактировать ]
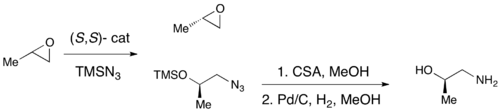
В то время как энантиоселективные эпоксидные эпоксиды были успешно достигнуты с использованием эпоксидирования Sharpless, эпоксида SHI и эпоксидирования Jacobsen , ни один из этих методов не допускает эффективного асимметричного синтеза терминальных эпоксидов, которые являются ключевыми хиральными строительными блоками. Из -за недорогих эпоксидов расического терминала и их неспособности быть в целом подвергаться классическому разрешению, эффективное кинетическое разрешение терминальных эпоксидов будет служить очень важной синтетической методологией. В 1996 году Якобсен и его коллеги разработали методологию кинетического разрешения эпоксидов посредством нуклеофильного открытия кольца с атакой азидным анионом. Катализатор (R, R) показан. [ 21 ] Катализатор может эффективно, с нагрузками всего 0,5 моль%, откройте эпоксид в терминальном положении энантиоселективно, что дает энантиоэнированные исходные эпоксидные материалы и 1,2-азидо-спирты. Выходы почти количественные, а EE были превосходны (≥95% почти во всех случаях). 1,2-азидо-спирты могут быть гидрогенизированы, чтобы дать 1,2-амино-спирты, как показано ниже.

В 1997 году группа Jacobsen опубликовала методологию, которая улучшилась после их более ранней работы, позволяя использовать воду в качестве нуклеофила в открытии эпоксидного эпохи. Используя почти идентичный катализатор, наблюдалось EE, превышающее 98% как для извлеченного эпоксида исходного материала, так и для продукта 1,2-диола. В приведенном ниже примере гидролитическое кинетическое разрешение (HKR) проводилось по 58 -граммовым масштабам, что привело к 26 г (44%) из энатиориханного эпоксида в> 99%EE и 38 г (50%) диола в 98% EE. [ 22 ]

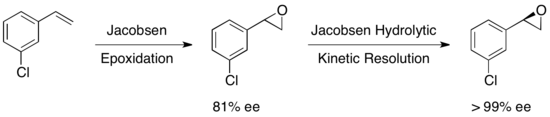
Было исследовано множество других субстратов, с доходностью восстановленного эпоксида в диапазоне от 36-48% для> 99% EE. Гидролитическое кинетическое разрешение Jacobsen может использоваться в тандеме с эпоксидией Jacobsen для получения эпоксидов энантиопов из определенных олефинов, как показано ниже. Первое эпоксидирование дает слегка энатиоэнированную эпоксиду, а последующее кинетическое разрешение дает по существу один энантиомер. Преимущество этого подхода заключается в способности уменьшить количество гидролитического расщепления, необходимого для достижения высокой энантиоселективности, что позволяет получить общую доходность примерно до 90%на основе олефина. [ 23 ]
В конечном счете, кинетические разрешения открытия эпоксида в Якобсене вызывают высокую энантиомерную чистоту в эпоксиде и продукте, в условиях без растворителя или низкого равенства и применимы в больших масштабах. Методология Jacobsen для HKR, в частности, чрезвычайно привлекательна, поскольку ее можно выполнять в многопользовательской масштабе и использовать воду в качестве нуклеофила, что приводит к чрезвычайно экономичным промышленным процессам. Несмотря на впечатляющие достижения, HKR обычно применяется к разрешению простых терминальных эпоксидов с одним стереоцентром. Совсем недавно Da Devalankar et al. сообщил о элегантном протоколе, включающем двухэтеоцензированный коатализируемый HKR эпоксидов рационовских терминальных терминалов, несущих прилегающие заместители, связывающие C-C. [ 24 ]
Окисление
[ редактировать ]
Ryōji Noyori и коллеги разработали методологию кинетического разрешения бензиловых и аллиловых вторичных спиртов посредством гидрирования переноса. Комплекс Ruthenium катализирует окисление более реактивного энантиомера из ацетона , что дает нереагирующий энантиопурный спирт, окисленный кетон и изопропанол. В примере показано ниже, воздействие 1-фенилетанола на (s, s) энантиомера катализатора в присутствии ацетона приводит к выходу 51% 94% EE (R) -1-фенилэтанола, а также 49% ацетофенона и изопропанол как побочный продукт. [ 25 ]
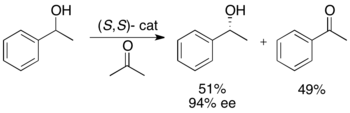
Эта методология, по сути, является обратной задачей асимметричного гидрирования нойори кетонов, [ 26 ] которые дают энантиоэнергированные спирты посредством снижения. Это ограничивает привлекательность метода кинетического разрешения, поскольку существует аналогичный метод для достижения тех же продуктов без потери половины материала. Таким образом, кинетическое разрешение будет осуществляться только в случае, в котором расический алкоголь составлял по крайней мере половину цены кетона или значительно проще в доступе.


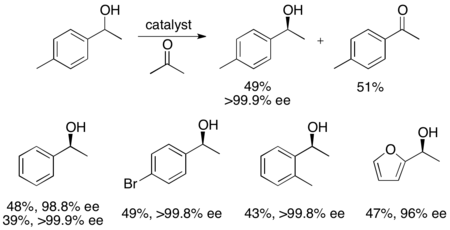
Кроме того, Uemura и Hidai разработали катализатор рутения для кинетического разрешения окисления бензиловых спиртов, что дает высокоэнасиованные спирты с хорошими урожаями. [ 27 ] Комплекс может, как и на катализатор Нойори, повлиять на гидрирование переноса между кетоном и изопропанолом, чтобы дать энантиоонированный алкоголь, а также на кинетическое разрешение рацемического алкоголя, давая энантиопурный алкоголь (> 99% ЭЭ) и окисленный кетон, с ацетоном в качестве продукта Полем Он очень эффективен для энантиоселективного снижения кетонов, давая большинство бензиловых спиртов в> 99% EE и может разрешить ряд раковых бензиловых спиртов, чтобы дать высокую урожайность (до 49%) отдельных энантиомеров, как показано ниже. Этот метод имеет те же недостатки, что и кинетическое разрешение Noyori, а именно, что с спиртами также можно получить доступ путем энантиосективного восстановления кетонов. Кроме того, сообщалось только о одном энантиомере катализатора.
Гидрирование
[ редактировать ]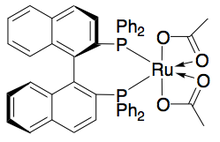
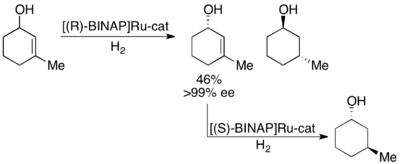
Noyori также продемонстрировал кинетическое разрешение аллиловых спиртов путем асимметричного гидрирования олефина. [ 28 ] Используя комплекс RU [Binap], селективное гидрирование может дать высокий EE ненасыщенного спирта в дополнение к гидрогенизированному спирту, как показано ниже. Таким образом, второе гидрирование оставшегося энантиоонированного аллилового спирта будет проведено энантиометрически чистыми образцами обоих энантиомеров насыщенного спирта. Noyori решил ряд аллильных спиртов с хорошей и превосходной урожайностью и от хорошего или превосходного EE (до> 99%).
Кольцо закрывающего метатезис
[ редактировать ]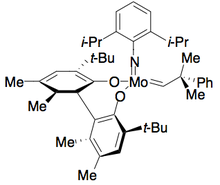
Hoveyda и Schrock разработали катализатор метатезии с закрытием кольца кинетического разрешения диенил-аллиловых спиртов. [ 29 ] Алкилиден -катализатор молибдена избирательно катализирует один энантиомер для выполнения метатезиса закрытия кольца, что приводит к энантиопурному спирту и закрытому кольцу энантиопера, как показано ниже. Катализатор наиболее эффективен при разрешении 1,6-диен. Тем не менее, небольшие структурные изменения в субстрате, такие как увеличение расстояния межклея до 1,7, иногда могут потребовать использования другого катализатора, снижая эффективность этого метода.

Ферментативные реакции
[ редактировать ]Ацилирование
[ редактировать ]Как и в случае с процедурами синтетического кинетического разрешения, кинетические разрешения ферментативного ацилирования наблюдали самое широкое применение в синтетическом контексте. Особенно важным было использование ферментативного кинетического разрешения для эффективного и дешевого приготовления аминокислот. В коммерческом масштабе методология Дегуссы с использованием ацилаз способна разрешить многочисленные природные и неестественные аминокислоты. Рацемические смеси могут быть приготовлены с помощью синтеза Strecker , и использование либо ацилазы кочек свиней (для подложки прямой цепи), либо фермент из Aspergillus oryzae (для подложки с боковой цепью) может эффективно привести к энантиоэнуальному аминокислотам (85- 90%) доходность. Неуреагированный начальный материал может быть растут на месте, что делает это динамическим кинетическим разрешением. [ 30 ]

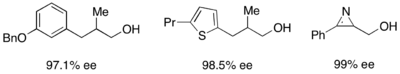
Кроме того, липазы широко используются для кинетического разрешения как в академических, так и в промышленных условиях. [ 31 ] [ 32 ] Липазы использовались для разрешения первичных спиртов, вторичных спиртов, ограниченного количества третичных спиртов, карбоновых кислот, диолов и даже хиральных аллена. Липаза из Pseudomonas cepacia (PSL) является наиболее широко используемой в разрешении первичных спиртов и использовалась с винилацетатом в качестве ацилирующего агента для кинетически разрешения первичных спиртов, показанных ниже.
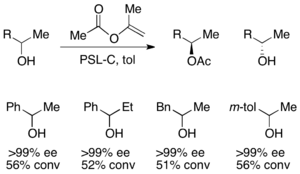
Для разрешения вторичных спиртов Pseudomonas cepecia lipase (PSL-C) была эффективно использована для создания превосходных EE ( R )-Enantiomer алкоголя. [ 33 ] Использование изопропенилацетата в качестве ацилирующего агента приводит к ацетону в качестве побочного продукта, который эффективно удаляется из реакции с использованием молекулярных сит .
Окисление и снижение
[ редактировать ]Бейкерские дрожжи (по) были использованы для кинетического разрешения α-стереогенных карбонильных соединений. [ 34 ] [ 35 ] Фермент избирательно уменьшает один энантиомер, давая очень энантиоочетный алкоголь и кетон, как показано ниже.

Бейкерские дрожжи также использовались в кинетическом разрешении вторичных бензиловых спиртов путем окисления. [ 36 ] Хотя сообщалось о превосходных EE о восстановленном алкоголе, они обычно требуют> 60% конверсии, что приводит к снижению урожайности. Бейкерские дрожжи также использовались в кинетическом разрешении посредством восстановления β-кетоэфиров. [ 37 ] Однако, учитывая успех разрешения Нойори одних и тех же субстратов, подробно описанных позже в этой статье, это не увидела особого использования.
Динамическое кинетическое разрешение
[ редактировать ]Динамическое кинетическое разрешение (DKR) возникает, когда начальный материальный RaceMate способен легко эпимеризировать, что приводит к существенно расическому начальному материалому смесь во всех точках во время реакции. Затем энантиомер с нижним барьером для активации может, теоретически, до 100% выхода. Это в отличие от стандартного кинетического разрешения, которое обязательно имеет максимальный выход 50%. По этой причине динамическое кинетическое разрешение имеет чрезвычайно практическое применение для органического синтеза. Наблюдаемая динамика основана на принципе Кертин-Хамметт . Барьер для реакции любого энантиомера обязательно выше, чем барьер для эпимеризации, что приводит к кинетической скважине, содержащей ракемейт. Это эквивалентно письму, для K R > K S ,

Был опубликован ряд отличных обзоров, в последнее время в 2008 году подробно описывались теория и практические применения DKR. [ 38 ] [ 39 ] [ 40 ]
Нойори асимметричное гидрирование
[ редактировать ]Асимметричное гидрирование Noyori кетонов является отличным примером динамического кинетического разрешения на работе. Энантиомерные β-кетоэфиры могут подвергаться эпимеризации , и выбор хирального катализатора, как правило, из формы ru [(r) -binap] x 2 , где x- галоген , приводит к одному из энантиомеров, реагирующих преимущественно быстрее. Относительная свободная энергия для репрезентативной реакции показана ниже. [ 41 ] [ 42 ] Как видно, промежуточное соединение эпимеризации ниже по свободной энергии, чем переходные состояния для гидрирования, что приводит к быстрой рационизациям и высоким урожаям одного энантиомера продукта.

Enantiomers взаимодействуют через свой общий enol , который является энергетическим минимумом, расположенным между энантиомерами. Показанная реакция дает 93% EE -образец анти -продукта, показанный выше. Выбор растворителя, по -видимому, оказывает большое влияние на диастереоселективность, поскольку дихлорметан и метанол показывают эффективность для определенных субстратов. Noyori и другие также разработали новые катализаторы, которые улучшились как в соотношении EE, так и в диастереомерном соотношении (DR).

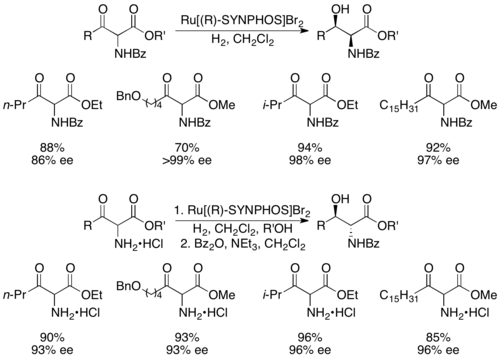
Genêt и его коллеги разработали Synphos , аналог Binap, который образует рутении -комплексы, которые выполняют высокоселективные асимметричные гидрирования. [ 43 ] Было показано, что Enantiopure ru [synphos] br 2 селективно гидрогенизируют рацемические α-амино-β-кетоэфиры для энантиопов аминоалкохол, как показано ниже с использованием (r) -synphos. [ 44 ] 1,2- амино -амино-спирты готовили из защищенных бензоил амино соединений, тогда как анти продукции готовили из солей гидрохлорида амина.
Модификация ацилирования FU
[ редактировать ]
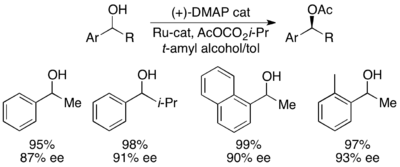
Недавно Грегори Фу и его коллеги сообщили о модификации своей более ранней работы с кинетическим разрешением для получения эффективного динамического кинетического разрешения. [ 45 ] Используя катализатор Ruthenium Racemization, показанный справа, и его плоский катализатор хирального DMAP, FU продемонстрировал динамическое кинетическое разрешение вторичных спиртов, дающих до 99% и 93% EE, как показано ниже. Работа продолжается для дальнейшего развития применения широко используемого катализатора DMAP к динамическому кинетическому разрешению.
Ферментативные динамические кинетические разрешения
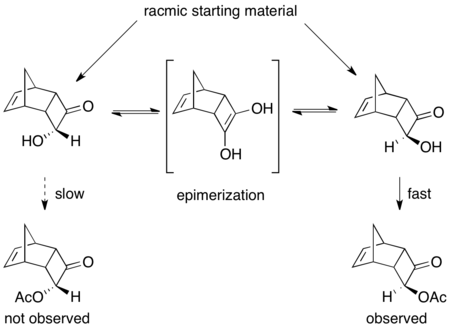
[ редактировать ]Сообщалось о ряде ферментативных динамических кинетических разрешений. [ 46 ] Основной пример с использованием PSL эффективно разрешает рацемические ацилоины в присутствии триэтиламина и винилацетата в качестве ацилирующего агента. [ 47 ] Как показано ниже, продукт был выделен с выходом 75% и 97% EE. Без присутствия основания произошло регулярное кинетическое разрешение, что привело к выходу 45%> 99% ацилированного продукта EE и 53% стартового материала в 92% EE.
Другим превосходным, хотя и не высокодоходным примером является кинетическое разрешение (±) -8-амино-5,6,7,8-тетрагидрохинолин. При воздействии Candida Antarctica Lipase B (CALB) в толуоле и этилацетате в течение 3–24 часов происходит нормальное кинетическое разрешение, что приводит к выходу 45% 97% EE начального материала и 45% выхода> 97% EE -ацилированного амина продукта. Полем Однако, когда реакция позволяет перемешивать в течение 40–48 часов, извлекаются рацемические начальные материалы и> 60% из> 95% ацилированного EE -продукта. [ 48 ]
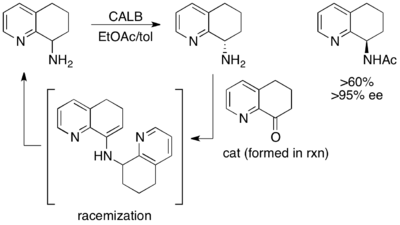
Здесь непрореагированный начальный материал в районе in situ через димерный эрамин, что приводит к восстановлению более 50% выхода энантиопового ацилированного аминового продукта.
Химиоэнзиматические динамические кинетические разрешения
[ редактировать ]Был ряд зарегистрированных процедур, которые используют преимущества химического реагента/катализатора для выполнения расизации начального материала и фермента для избирательного реагирования с одним энантиомером, называемым химиоферментативным динамическим кинетическим разрешением. [ 49 ] PSL-C использовали наряду с катализатором рутения (для расизации) для получения энантиопузы (> 95% EE) Δ-гидроксилактоны. [ 50 ]

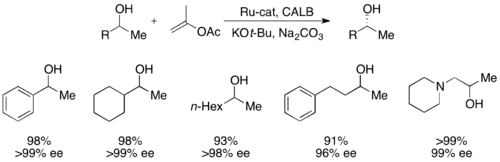
Совсем недавно, вторичные спирты были разрешены Bäckvall с доходностью до 99%, а EE - до> 99% с использованием CALB и комплекса Ruthenium Racemization. [ 51 ]
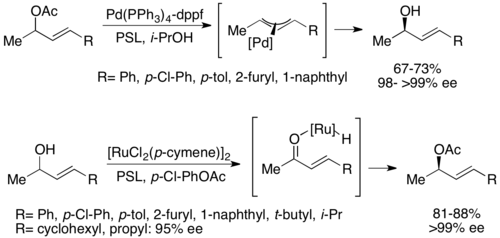
Второй тип химиоэнзимного динамического кинетического разрешения включает в себя π-аллильный комплекс из аллильного ацетата с палладием . Здесь расизация происходит с потерей ацетата, образуя катионный комплекс с центром переходных металлов, как показано ниже. [ 52 ] Было показано, что палладий облегчает эту реакцию, в то время как рутении было показано, что влияет на аналогичную реакцию, также показанную ниже. [ 53 ]
Параллельное кинетическое разрешение
[ редактировать ]В параллельном кинетическом разрешении (PKR) расическая смесь реагирует с образованием двух неэнсиномерных продуктов, часто через совершенно разные пути реакции. С PKR нет компромисса между конверсией и EE, поскольку сформированные продукты не являются энантиомерами. [ 54 ] [ 55 ] Одна стратегия для PKR заключается в удалении менее реактивного энантиомера (к желаемому хиральному катализатору) из реакционной смеси, подвергая его второму набору условий реакции, который преимущественно реагирует с ним, в идеале с приблизительно равной скоростью реакции. Таким образом, оба энантиомеры потребляются в разных путях с одинаковыми скоростями. Эксперименты PKR могут быть стереодивергентными, регентными или структурно дивергентными. [ 56 ] Один из наиболее эффективных PKR, сообщаемых до настоящего времени, был достигнут Йошито Киши в 1998 году; Снижение CBS рацемического стероидного кетона привело к стереоселективному снижению, создавая два диастереомера> 99% EE, как показано ниже. [ 57 ]

PKR также были выполнены с использованием ферментных катализаторов. Используя гриб Mortierella Isabellina NRRL 1757, восстановление рацемических β-кетонитрилов дает два диастереомера, которые можно разделить и перекинуть, чтобы получить высоко энантиопу β-кетонитрилы. [ 58 ] Однако очень синтетически полезные параллельные кинетические разрешения действительно еще предстоит обнаружить. Был обнаружен ряд процедур, которые дают приемлемые EE и урожайность, но примеры очень мало, которые дают очень селективное параллельное кинетическое разрешение, а не просто несколько селективных реакций. Например, параллельное кинетическое разрешение Фу 4-алкеиналь дает очень энантиоэнергированный циклобутанон с низким уровнем урожая и слегка энантиоэгнированным циклопентененоном, как показано ниже. [ 59 ]

Теоретически, параллельное кинетическое разрешение может дать самые высокие продукты EE, поскольку только один энантиомер дает каждому желаемому продукту. Например, для двух дополнительных реакций как с S = 49, 100% конверсия даст продукты с выходом 50% и 96% EE. Эти же значения потребуют S = 200 для простого кинетического разрешения. Таким образом, обещание PKR продолжает привлекать большое внимание. Снижение CSHI CBS остается одним из немногих примеров для выполнения этого обещания.
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Fiaud, JC; Каган, HB (1988). «Кинетическое разрешение». В Элиэле, Эль; Уилен, Ш (ред.). Темы в стереохимии . Тол. 18. Нью -Йорк: John Wiley and Sons, Inc. с. 249–340.
- ^ Робинсон, Деже; Bull, SD (2005). «Стратегии кинетического разрешения с использованием не фензимных катализаторов». Тетраэдр: асимметрия . 14 (11): 1407–1446. doi : 10.1016/s0957-4166 (03) 00209-x .
- ^ Pasteur, LC (1858). «Мемуары о ферментации татарной кислоты». CR Acad. Наука Париж . 46 : 615–618.
- ^ Марквальд, W.; Маккензи, А. (1899). «О в основном новом методе для разделения расических соединений на активные компоненты» . Бер DTSCH. Хим . 32 (2): 2130–2136. Doi : 10.1002/cber.189903202130 .
- ^ Роджер, Р.; Read, J. (1952). «Александр Маккензи: 1869-1951» . Некролог уведомлений о стипендиатах Королевского общества . 8 (21): 206–228. doi : 10.1098/rsbm.1952.0014 .
- ^ Подпрыгнуть до: а беременный Кит, JM; Ларроу, JF; Jacobsen, EN (2001). «Практические соображения в реакциях кинетического разрешения». Адвла Синтезатор Катал . 343 : 5–26. doi : 10.1002/1615-4169 (20010129) 343: 1 <5 :: AID-ADSC5> 3.0.co; 2-I .
- ^ Wurz, RP; Ли, ЕС; Рубл, JC; FU, GC (2007). «Синтез и разрешение плоских хирусных производных 4- (диметиламино) пиридина». Адвла Синтезатор Катал . 349 (14–15): 2345–2352. doi : 10.1002/adsc.200700219 .
- ^ Рубл, JC; Латхэм, ха; FU, GC (1997). «Эффективное кинетическое разрешение вторичных спиртов с плоским хирурским аналогом 4- (диметиламино) пиридина. Использование группы Fe (C 5 pH 5 ) в асимметричном катализе». J. Am. Химический Соц 119 (6): 1492–1493. doi : 10.1021/ja963835b .
- ^ Рубл, JC; Tweddell, J.; FU, GC (1998). «Кинетическое разрешение арилакилкарбинолов, катализируемое плоским хирурным производным DMAP: новый эталон для неферментативного ацилирования». J. Org. Химический 63 (9): 2794–2795. doi : 10.1021/jo980183w .
- ^ Дао, Б.; Рубл, JC; Hoic, да; FU, GC (1999). «Неферментативное кинетическое разрешение пропраргиловых спиртов с помощью планарно -хирального производного DMAP: кристаллографическая характеристика ацилированного катализатора». J. Am. Химический Соц 121 (21): 2091–5092. doi : 10.1021/ja9906958 .
- ^ Bellemin-Laponnaz, S.; Tweddell, J.; Рубл, JC; Брейтлинг, FM; FU, GC (2000). «Кинетическое разрешение аллиловых спиртов с помощью негментативного катализатора ацилирования; применение к синтезу природного продукта». Химический Общение (12): 2091–5092. doi : 10.1039/b002041i .
- ^ Arai, S.; Bellemin-Laponnaz, S.; FU, GC (2001). «Кинетическое разрешение аминов с помощью неферментативного катализатора ацилирования». Angew. Химический Инт. Редакция 133 (1): 240–242. doi : 10.1002/1521-3757 (20010105) 113: 1 <240 :: AID-ange240> 3.0.co; 2-e .
- ^ Arp, fo; FU, GC (2006). «Кинетические решения INOLINES неферматическим катализатором ацилирования» . J. Am. Химический Соц 128 (44): 14264–14265. doi : 10.1021/ja0657859 . PMC 2569996 . PMID 17076493 .
- ^ Кацуки, Т.; Sharpless, KB (1980). «Первый практический метод асимметричного эпоксидации». J. Am. Химический Соц 102 (18): 5974–5976. doi : 10.1021/ja00538a077 .
- ^ Мартин, В.; Woodard, S.; Кацуки, Т.; Yamada, Y.; Ikeda, M.; Sharpless, KB (1981). «Кинетическое разрешение расических аллиловых спиртов путем энантиоселективного эпоксидирования. Путь к веществам абсолютной энантиомерной чистоты?». J. Am. Химический Соц 103 (23): 6237–6240. doi : 10.1021/ja00410a053 .
- ^ Гао, Юн; Klunder, JM; Хансон, RM; Masamune, H.; Ko, sy; Sharpless, KB (1987). «Каталитическое асимметричное эпоксидирование и кинетическое разрешение: модифицированные процедуры, включая дериватизацию in situ». J. Am. Химический Соц 109 (19): 5765–5780. doi : 10.1021/ja00253a032 .
- ^ Kitano, Y.; Matsumoto, T.; Сато, Ф. (1988). «Высокоэффективное кинетическое разрешение γ- и β-триметилсилил вторичных аллиловых спиртов с помощью асимметричного эпоксидирования Sharpless». Тетраэдр . 44 (13): 4073–4086. doi : 10.1016/s0040-4020 (01) 86657-6 .
- ^ Vannieuwenhze, MS; Sharpless, KB (1993). «Кинетическое разрешение расических олефинов через асимметричное дигидроксилирование». J. Am. Химический Соц 115 (17): 7864–7865. doi : 10.1021/ja00070a037 .
- ^ Кори, EJ; Noe, mc; Гусман-Перес, А. (1995). «Кинетическое разрешение энантиоселективным дигидроксилированием вторичного аллильного 4-метоксибензоата эфиров с использованием механистически спроектированного алкалоидного катализатора Cinchona». J. Am. Химический Соц 117 (44): 10817–10824. doi : 10.1021/ja00149a004 .
- ^ Лоренц, JC; Фрон, М.; Чжоу, х.; Zhang, J.-R.; Tang, y.; Берк, C.; Ши, Ю. (2005). «Исследования переходного состояния по диоксираново-опосредованному асимметричному эпоксидированию посредством кинетического разрешения и десимметризации». J. Org. Химический 70 (8): 2904–2911. doi : 10.1021/jo048217p . PMID 15822948 .
- ^ Ларроу, JF; Schaus, SE; Jacobsen, EN (1996). «Кинетическое разрешение терминальных эпоксидов посредством высокорегиоселективного и энантиоселективного кольца с TMSN3. Эффективный, каталитический путь к 1,2-амино-спиртам». J. Am. Химический Соц 118 (31): 7420–7421. doi : 10.1021/ja961708+ .
- ^ Tokunaga, M.; Ларроу, JF; Kakiuchi, F.; Jacobsen, EN (1997). «Асимметричный катализ с водой: эффективное кинетическое разрешение терминальных эпоксидов с помощью каталитического гидролиза». Наука . 277 (5328): 936–938. doi : 10.1126/science.277.5328.936 . PMID 9252321 .
- ^ Брандес, BD; Jacobsen, EN (1997). «Синтез энантиопов 3-хлоростирола через асимметричную последовательность кинетического разрешения кинетического разрешения эпоксидирования» ». Тет Асимм . 8 (23): 3927–3933. doi : 10.1016/s0957-4166 (97) 00568-5 .
- ^ Sudalai, A.; Карабал, Пу; ДеВаланкар, Да (2013). «Оптически чистые γ-бутиролактоны и эпоксидные эфиры посредством двух стереоцентричных HKR 3-замещенных эпоксидных эфиров: формальный синтез (-)-пароксетина, RO 67-8867 и (+)-эльданолида». Орг Биомол. Химический 11 (8): 1280–1285. doi : 10.1039/c3ob27321k . PMID 23334653 .
- ^ Hashiguchi, S.; Fujii, A.; Haack, K.-J.; Matsumura, K.; Ikariya, T.; Noyori, R. (1997). «Кинетическое разрешение рацемических вторичных спиртов с помощью катализируемого RUII переноса водорода». Angew. Химический Инт. Редакция 36 (3): 288–290. doi : 10.1002/anie.199702881 .
- ^ Hashiguchi, S.; Fujii, A.; Takehara, J.; Ikariya, T.; Noyori, R. (1995). «Асимметричное перенос гидрирование ароматических кетонов, катализируемых комплексами хирального рутения (II)». J. Am. Химический Соц 117 (28): 7562–7563. doi : 10.1021/ja00133a037 .
- ^ Nishibayashi, Y.; Takei, я.; Uemura, S.; Hidai, M. (1999). «Чрезвычайно высокая энантиоселективная окислительно -восстановительная реакция кетонов и спиртов, катализируемой RUCL2 (PPH3) (оксазолинилферроценилфосфин)». Органометаллики . 18 (12): 2291–2293. doi : 10.1021/om990210o .
- ^ Китамура, М.; Касахара, я.; Manabe, K.; Noyori, R.; Takaya, H. (1988). «Кинетическое разрешение расических аллиловых спиртов с помощью катализируемого гидрирования бинап-рутения (II)». J. Org. Химический 53 (3): 708–710. doi : 10.1021/jo00238a048 .
- ^ Ховейда, ах; Schrock, RR (2001). «Каталитический асимметричный метатезис олефина». Химический Евро. Дж . 7 (5): 945–950. doi : 10.1002/1521-3765 (20010302) 7: 5 <945 :: AID-CHEM945> 3.0.CO; 2-3 . PMID 11303874 .
- ^ Патент США 6656710 , Bommarius & Verseck, «Процесс производства аминокислот с использованием ракемазы и ацилата», назначенный Degussa AG
- ^ Ghanem, A.; Aboul-enenin, HY (2005). «Применение липаз в кинетическом разрешении ракматов». Хиральность . 17 (1): 1–15. doi : 10.1002/chir.20089 . PMID 15515046 .
- ^ «Хиральная технология: промышленный биокатализ со стандартными гидролитическими объемными ферментами». Специальные химические журналы . 27 (8): 38. 2007.
- ^ Ghanem, A.; Шуриг, В. (2003). «Катализируемая липаза необратимая переэтерификация вторичных спиртов с использованием изопропенилацетата» (PDF) . Ежемесячные буклеты для химии . 134 (8): 1151–1157. Doi : 10.1007/s00706-0025-1 . S2CID 96922176 .
- ^ Santaniello, E.; Ferraboschi, P.; Grisenti, P.; Manzocchi, A. (1992). «Биокаталитический подход к приготовлению энантиомерически чистых хиральных строительных блоков». Химический Преподобный 92 (5): 1071–1140. doi : 10.1021/cr00013a016 .
- ^ Ticozzi, C.; Занаротти, Антонио (1989). «Энантиоселективное микробное восстановление 5-ацетилзоксазолинов-новый метод стереохимического контроля при восстановлении дрожжей». Либигс Энн. Химический 1989 (12): 1257–1259. doi : 10.1002/jlac.198919890299 .
- ^ Fantin, G.; Fogagnolo, M.; Medici, A.; Pedrini, P.; Поли С. (1993). «Кинетическое разрешение 1-арил- и 1-гетероарильных этанолов путем окисления дрожжами пекаря». Тетраэдр Летт . 34 (5): 883–884. doi : 10.1016/0040-4039 (93) 89039-S . HDL : 11392/462444 .
- ^ Брукс, DW; Wilson, M.; Уэбб, М. (1987). «Различные ферментативные реакции энантиомерной пары: одновременное двойное кинетическое разрешение кето -эфира дрожжами пекарей». J. Org. Химический 52 (11): 2244–2248. doi : 10.1021/jo00387a026 .
- ^ Pellissier, H. (2008). «Недавние события в динамическом кинетическом разрешении». Тетраэдр . 64 (8): 1563–1601. doi : 10.1016/j.tet.2007.10.080 .
- ^ Pellissier, H. (2003). «Динамическое кинетическое разрешение». Тетраэдр . 59 (42): 8291–8327. doi : 10.1016/s0040-4020 (03) 01022-6 .
- ^ Ward, RS (1995). «Динамическое кинетическое разрешение». Тетраэдр: асимметрия . 6 (7): 1475–1490. doi : 10.1016/0957-4166 (95) 00179-s .
- ^ Китамура, М.; Tokunaga, M.; Noyori, R. (1993). «Количественная экспрессия динамического кинетического разрешения хирально лабильных энантиомеров: стереоселективное гидрирование 2-замещенных 3-оксо-карбоксиловых сложных эфиров, катализируемых комплексами бинап-рутения (II)». J. Am. Химический Соц 115 (1): 144–152. doi : 10.1021/ja00054a020 .
- ^ NOIONO, R.; Ikedda, T.; Ohkumum, T.; Widahalm, M.; Закрыть, м.; Чек, H.; Akog, S.; Один, н.; Сайто Т. (1989). гидрирование. J. Am. Химический Соц 111 (25): 9134–9135. doi : 10.1021/ja .
- ^ de Paule, SD; Jeulin, S.; Ратавеломанана-Видал, В.; Genêt, JP.; Чемпион, N.; Dellis, P. (2003). «Исследования синтеза и молекулярного моделирования Synphos®, нового, эффективного дифхосфанового лиганда для катализируемого рутением асимметричное гидрирование». Евро. J. Org. Химический 2003 (10): 1931–1941. doi : 10.1002/ejoc.200200634 .
- ^ Mordant, C.; Ратавеломанана-Видал, В.; Дюнкельманн, П.; Genêt, J.-P. (2004). «Универсальный путь к синхронологическому и анти-амино β-гидроксиэфильным эфирам из β-кето-эфиров путем динамического кинетического разрешения с катализатором RU-Synphos®». Евро. J. Org. Химический 2004 (14): 3017–3026. doi : 10.1002/ejoc.200400078 .
- ^ Ли, Sy; Мерфи, JM; UKAI, A.; FU, GC (2012). «Неферматическое динамическое кинетическое разрешение вторичных спиртов посредством энантиоселективного ацилирования: синтетические и механистические исследования» . J. Am. Химический Соц 134 (36): 15149–15153. doi : 10.1021/ja307425g . PMC 3447740 . PMID 22934603 .
- ^ Pellissier, H. (2003). «Липаза-триэтиламин-опосредованная динамическая трансэтерификация трициклического ацилоина, имеющего скрытую мезоструктуру: новый путь к оптически чистому оксикклопентадиену». Тетраэдр . 59 (42): 8291–9327. doi : 10.1016/s0040-4020 (03) 01022-6 .
- ^ Танигучи, Т.; Огасавара, К. (1997). «Липаза-триэтиламин-опосредованная динамическая трансэтерификация трициклического ацилоина, имеющего скрытую мезоструктуру: новый путь к оптически чистому оксикклопентадиену». Химическая связь (15): 1399–1400. doi : 10.1039/a702910a .
- ^ Кроуфорд, JB; Skerlj, RT; Бриджер, GJ (2007). «Спонтанное ферментативно опосредованное динамическое кинетическое разрешение 8-амино-5,6,7,8-тетрагидрохинолин». J. Org. Химический 72 (2): 669–671. doi : 10.1021/jo062037t . PMID 17221995 .
- ^ Pàmies, O.; Bäckvall, J.-E. (2004). «Химиоэнзиматическое динамическое кинетическое разрешение». Тенденции в биотехнологии . 22 (3): 130–135. doi : 10.1016/j.tibtech.2004.01.005 . PMID 15036863 .
- ^ Pàmies, O.; Bäckvall, J.-E. (2002). «Ферментативное кинетическое разрешение и химиоэнзиматическое динамическое кинетическое разрешение эфиров Δ-гидрокси. Эффективный путь к хиральным Δ-лактонам». J. Org. Химический 67 (4): 1261–1265. doi : 10.1021/jo016096c . PMID 11846671 .
- ^ Martín-Matute, B.; Эдин, М.; Богар, К.; Кайнак, FB; Bäckvall, J.-E. (2005). «Комбинированный катализ рутения (II) и липазы для эффективного динамического кинетического разрешения вторичных спиртов. Понимание механизма рацизма». J. Am. Химический Соц 127 (64): 8817–8825. doi : 10.1021/ja051576x . PMID 15954789 .
- ^ Чой, YK; Suh, JH; Ли, Д.; Лим, это; Юнг, JY; Ким, М.-Дж. (1999). «Динамическое кинетическое разрешение ациклических аллильных ацетатов с использованием липазы и палладий». J. Org. Химический 64 (22): 8423–8424. doi : 10.1021/jo990956w . PMID 11674772 .
- ^ Ли, Д.; Да, ea; Ким, М.-Дж.; Юнг, HM; Ко, JH; Парк, Дж. (2000). «Динамическое кинетическое разрешение аллиловых спиртов, опосредованных катализаторами на основе рутения и липазы». Орг Летал 2 (15): 2377–2379. doi : 10.1021/ol006159y . PMID 10930288 .
- ^ Eames, J. (2000). «Параллельные кинетические решения». Angew. Химический Инт. Редакция 39 (5): 885–888. doi : 10.1002/(sici) 1521-3773 (20000303) 39: 5 <885 :: Aid-Anie885> 3.0.co; 2-2 . PMID 10760881 .
- ^ Дехил, младший; Gotor, V. (2002). «Параллельное кинетическое разрешение раковых смесей: новая стратегия для подготовки соединений энантиопов?». Химический Соц Преподобный 31 (6): 365–370. doi : 10.1039/b205280f . PMID 12491751 .
- ^ Vedejs, E.; Юре, М. (2005). «Эффективность в неферментативном кинетическом разрешении». Angew. Химический Инт. Редакция 44 (5): 3974–4001. doi : 10.1002/anie.200460842 . PMID 15942973 .
- ^ Kurosu, M.; Киши Ю. (1998). «Новый пример для оптического разрешения расических кетонов, происходящих из синтеза батрахотоксина». J. Org. Химический 63 (18): 6100–6101. doi : 10.1021/jo981416m . PMID 11672234 .
- ^ Дехил, младший; Gotor, V. (2002). «Приготовление кетонов и спиртов энантиопов, содержащих четвертичный стереоцентр посредством параллельного кинетического разрешения β-кето нитрилов». J. Org. Химический 67 (5): 1716–1718. doi : 10.1021/jo011092t . PMID 11871913 .
- ^ Танака, К.; FU, GC (2003). «Параллельное кинетическое разрешение 4-алкеиналов, катализируемое RH (I)/TOL-BINAP: синтез энантиоэгентных циклобутанонов и циклопентененонов». J. Am. Химический Соц 125 (27): 8078–8079. doi : 10.1021/ja035489l . PMID 12837058 .
Дальнейшее чтение
[ редактировать ]- Динамические кинетические разрешения. Собрание группы Macmillan. Джейка Винера Ссылка
- Динамическое кинетическое разрешение: мощный подход к асимметричному синтезу. Эрик Алексанский собрание супергруппы 30 марта 2005 г. Ссылка
- Динамическое кинетическое разрешение: практические применения в синтезе. 3-й год семинара Валери Келлер 1 ноября 2001 г. Ссылка
- Кинетическое разрешение. Дэвид Эбнер Стольц Групповой литература семинар. 4 июня 2003 г. Ссылка
- Кинетические решения. UT Southwestern Presentation. связь





![{\ displaystyle [s] = {\ frac {(1+ee) (1-c)} {2}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bedb0ada89fbba54020c618907425dc858a2591b)
![{\ displayStyle [r] = {\ frac {(1-ee) (1-c)} {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1a61e8391de522b72a3580bd1214d5112057d741)

![{\ displayStyle {\ frac {d [s]} {dt}} =-k_ {s} [s] [b^{*}] \ intement \ log [s] =-k_ {s} [b^{* }] t+\ log s_ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0cb65f6ee0307b80ab311cb9d09726947bd97ac1)
![{\ displayStyle s = {\ frac {k_ {r}} {k_ {s}}} = {\ frac {\ log [r]-\ log r_ {0}} {\ log [s]-\ log s_ {{ 0}}} = {\ frac {\ log [(1-c) (1-ee)]+\ log {\ frac {1} {2}}-\ log r_ {0}} {\ log [1 -c) (1+ee)]+\ log {\ frac {1} {2}}-\ log s_ {0}}} = {\ frac {\ log [(1-c) (1-ee)]] } {\ log [(1-c) (1+ee)]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/156b26edecc36af36374614253bb2842be3e550b)
![{\ displaystyle ee '' = {\ frac {[r ']-[s']} {[r ']+[s']}} = {\ frac {ee (1-c)} {c}} \ подразумевает ee = ee '' {\ frac {c} {1-c}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0876f7366b97d07d9a002cb750fdb1a42ca25448)




![{\ displayStyle s = {\ frac {\ log [1-c (1+ee '')]} {\ log [1-c (1-ee '')]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d142162d7ab054c445d0ee122e6ed2b2880103a)
![{\ Disklayle c = \ frac {] {\ log ['' ' + + of \ cdot') / (in + of '))}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/882e4515e695067b8c4864f5a5adf0e984064631)
![{\ displayStyle {\ frac {d [s]} {dt}} =-k_ {s} [s] \ подразумевает s = {\ frac {1} {2}} e^{-k_ {s}}}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fcf79858e21ac5c20f56338e038c1a28e2b6e77)
![{\ displaystyle ee = {\ frac {[s]-[r]} {[s]+[r]}} = {\ frac {e^{-k_ {s} t} -e^{-k_ {r } t}} {e^{-k_ {s} t}+e^{-k_ {r} t}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/537dcb1d65d95eea71ade3ed04fb39937e993fb2)
![{\ displayStyle c = 1-{\ big (} [s]-[r] {\ big)} = 1-{\ frac {e^{-k_ {s} t}+e^{-k_ {r} t}} {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/002346d2f288670c618bfcddfabc48db5fe6a46b)