ДНК-лигаза 1
| ЛИГ1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | LIG1 , ДНК-лигаза 1, LIGI, hLig1, IMD96 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 126391 ; МГИ : 101789 ; Гомологен : 197 ; Генные карты : LIG1 ; ОМА : LIG1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
ДНК-лигаза 1, также ДНК-лигаза I , представляет собой фермент , который у человека кодируется LIG1 геном . ДНК-лигаза 1 — единственная известная эукариотическая ДНК-лигаза, участвующая как в ДНК репликации , так и в репарации , что делает ее наиболее изученной из лигаз .
Открытие
[ редактировать ]Было известно, что репликация ДНК происходит посредством двухцепочечного разрыва , но фермент, ответственный за повторное связывание нитей вместе, и механизм действия были неизвестны до тех пор, пока лаборатории Лемана, Геллерта, Ричардсона и Гурвица не внесли значительный вклад в открытие ДНК. лигазы в 1967 году. [ 5 ]

Набор и регулирование
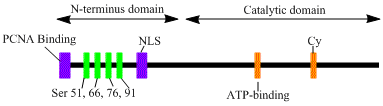
[ редактировать ]LIG1 кодирует фермент массой 120 кДа и длиной 919 остатков , известный как ДНК-лигаза 1. Полипептид ДНК-лигазы 1 содержит N-концевую последовательность, нацеленную на фабрику репликации (RFTS), за которой следует последовательность ядерной локализации (NLS) и три функциональных домена. . [ 6 ] Эти три домена состоят из N-концевого ДНК-связывающего домена (DBD), каталитической нуклеотидилтрансферазы (NTase) и C-концевых доменов, связывающих олигонуклеотиды / олигосахариды (OB). Хотя N-конец пептида не обладает каталитической активностью, он необходим для активности внутри клеток. N-конец белка содержит последовательность, нацеленную на фабрику репликации, которая используется для рекрутирования его в сайты репликации ДНК, известные как фабрики репликации.
Активация и рекрутирование ДНК-лигазы 1, по-видимому, связаны с посттрансляционными модификациями. N-концевой домен завершается фосфорилированием четырех остатков серина в этом домене: Ser51, Ser76 и Ser91 циклинзависимой киназой (CDK) и Ser66 казеинкиназой II (CKII). Было показано, что фосфорилирование этих остатков (в частности, Ser66), возможно, регулирует взаимодействие между RFTS и ядерным антигеном пролиферирующих клеток (PCNA), когда лигаза 1 рекрутируется на фабрики репликации во время S-фазы . [ 6 ] [ 7 ] Росси и др. предположили, что при дефосфорилировании Ser66 RFTS лигазы 1 взаимодействует с PCNA, что было подтверждено in vitro Tom et al. Оба набора данных предоставляют убедительные доказательства того, что N-концевая область лигазы I играет регуляторную роль в функционировании ферментов in vivo в ядре. [ 7 ] [ 8 ] Более того, мутационный анализ показал, что идентификация циклинсвязывающего (Cy) мотива в каталитическом С-концевом домене играет роль в фосфорилировании серинов 91 и 76. Вместе N-концевые серины являются субстратами CDK и CKII, которые, по-видимому, играют важную регуляторную роль в рекрутировании ДНК-лигазы I на фабрику репликации во время S-фазы клеточного цикла . [ 6 ] [ 9 ]
Функция и механизм
[ редактировать ]LIG1 кодирует ДНК-лигазу 1, которая участвует в репликации ДНК и процессе эксцизионной репарации оснований . [ 10 ]
Эукариотическая ДНК-лигаза 1 катализирует реакцию, химически универсальную для всех лигаз. ДНК-лигаза 1 использует аденозинтрифосфат (АТФ) для катализа энергетически выгодных событий лигирования как при ДНК репликации , так и при репарации . Во время фазы синтеза (S-фазы) эукариотического клеточного цикла происходит репликация ДНК. ДНК-лигаза 1 отвечает за соединение фрагментов Окадзаки , образовавшихся во время прерывистого синтеза ДНК на отстающей цепи ДНК после того, как ДНК-полимераза δ заменила нуклеотиды праймера РНК нуклеотидами ДНК. Если фрагменты Оказаки не связаны друг с другом должным образом, несвязанная ДНК (содержащая «разрыв») может легко деградировать до двухцепочечного разрыва — явления, которое, как известно, вызывает генетические мутации. Чтобы связать эти фрагменты вместе, лигаза проходит три этапа:
- Добавление группы аденозинмонофосфата (АМФ) к ферменту, называемое аденилированием,
- Перенос аденозинмонофосфата в ДНК и
- Никелирование или образование фосфодиэфирной связи. [ 8 ] [ 11 ]

Во время аденилирования происходит нуклеофильная атака альфа-фосфата АТФ со стороны каталитического лизина , что приводит к образованию неорганического пирофосфата (PPi) и ковалентно связанного промежуточного продукта лизин-АМФ в активном центре ДНК-лигазы 1.
На этапе переноса АМФ ДНК-лигаза связывается с ДНК, находит разрыв и катализирует реакцию на 5'-фосфатном участке разрыва ДНК. Анионный кислород на 5'-фосфате разрыва ДНК служит нуклеофилом, атакуя альфа-фосфат ковалентно связанного АМФ, вызывая ковалентно связанное промежуточное соединение АМФ (промежуточное соединение ДНК-АМФ).
Для образования фосфодиэфирной связи необходимо отщепить промежуточное соединение ДНК-АМФ. Для выполнения этой задачи происходит нуклеофильная атака 5'-фосфата со стороны расположенного выше 3'-гидроксила, что приводит к образованию фосфодиэфирной связи. Во время этой нуклеофильной атаки группа AMP отталкивается от 5'-фосфата в качестве уходящей группы, позволяя запечатать разрыв и высвободить AMP, завершая один цикл лигирования ДНК.
В неоптимальных условиях лигаза может отделиться от ДНК до завершения полной реакции. Было показано, что уровни магния могут замедлять процесс запечатывания разрывов, вызывая диссоциацию лигазы от ДНК, в результате чего прерванный аденилированный промежуточный продукт не может быть зафиксирован без помощи фосфодиэстеразы . Было показано, что апратаксин (фосфодиэстераза) действует на прерванные промежуточные соединения ДНК посредством гидролиза связи АМФ-фосфат, восстанавливая ДНК до ее исходного состояния до того, как лигаза прореагировала. [ 12 ] [ 13 ]
Роль в ремонте поврежденной базы
[ редактировать ]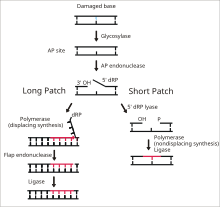
ДНК-лигаза 1 выполняет лигирование одноцепочечных разрывов ДНК на заключительном этапе пути эксцизионной репарации оснований (BER). [ 14 ] Азотистые основания ДНК обычно повреждаются из-за опасностей окружающей среды, таких как активные формы кислорода , токсины и ионизирующая радиация . BER — это основной путь восстановления, отвечающий за вырезание и замену поврежденных оснований. Лигаза I участвует в пути LP-BER, тогда как лигаза III участвует в основном пути SN-BER (2). [ 15 ] LP-BER протекает в 4 каталитических этапа. Сначала ДНК-гликозилаза расщепляет N-гликозидную связь , высвобождая поврежденное основание и создавая AP-сайт — сайт, в котором отсутствует пуриновое или пиримидиновое основание. На следующем этапе эндонуклеаза AP создает разрыв на 5'-конце сайта AP, генерируя висячий остаток дезоксирибозофосфата (dRP) вместо сайта AP. Затем ДНК-полимераза синтезирует несколько новых оснований в направлении от 5’ к 3’, генерируя висячий участок ДНК с dRP на 5’-конце. Именно на этом этапе механизмы SN-BER и LP-BER различаются: в SNBER добавляется только один нуклеотид, а ДНК-полимераза действует как лиаза, вырезая AP-сайт. В LP-BER синтезируются несколько оснований, образуя висячий лоскут ДНК, который расщепляется эндонуклеазой лоскута . В результате остается разорванная цепь ДНК, которая распознается и связывается ДНК-лигазой. [ 14 ] [ 15 ] [ 16 ] Действие лигазы 1 стимулируется другими ферментами LP-BER, в частности AP-эндонуклеазой и ДНК-полимеразой. [ 16 ]
Клиническое значение
[ редактировать ]Мутации в LIG1 , которые приводят к дефициту ДНК-лигазы 1, приводят к иммунодефициту и повышенной чувствительности к агентам, повреждающим ДНК. [ 10 ]
Имеются редкие сообщения о пациентах с дефицитом лигазы 1, возникшим в результате наследственных мутантных аллелей. Первый случай проявился задержкой роста и развития и иммунодефицитом. Мышиная модель была создана на основе клеточных линий, полученных от пациента, что подтвердило, что мутантная лигаза вызывает ошибки репликации, приводящие к нестабильности генома . Примечательно, что у мутантных мышей также наблюдалось увеличение онкогенеза . [ 8 ] Представлены молекулярные, клеточные и клинические особенности 5 пациентов из 3 родств с биаллельными мутациями. У пациентов наблюдалась гипогаммаглобулинемия, лимфопения, увеличение количества циркулирующих γδT-клеток и очень крупные эритроциты (макроцитоз). Тяжесть клинической картины варьировала от легкого дефицита антител до комбинированного иммунодефицита, требующего трансплантации гемопоэтических стволовых клеток. Было продемонстрировано, что химические и радиационные дефекты нарушают пути восстановления ДНК. Дефекты ДНК-лигазы 1 могут, таким образом, приводить к различным формам аутосомно-рецессивного частичного дефицита ДНК-лигазы 1, приводящего к иммунодефициту различной степени тяжести. [ 17 ]
Также было обнаружено, что лигаза I активируется в пролиферирующих опухолевых клетках, в отличие от линий доброкачественных опухолевых клеток и нормальных клеток человека. Кроме того, было показано, что ингибирование экспрессии лигазы I в этих клетках может иметь цитотоксический эффект, что позволяет предположить, что ингибиторы лигазы I могут быть жизнеспособными химиотерапевтическими агентами. [ 18 ]
Дефицит апратаксина , фосфодиэстеразы, ответственной за восстановление ДНК (после того, как ДНК-лигаза I прерывает аденилированное промежуточное соединение ДНК), связан с нейродегенерацией . Это говорит о том, что ДНК не способна повторно вступить в путь репарации без дополнительных резервных механизмов для исправления ошибок лигазы. [ 13 ]
Поскольку структура ДНК хорошо известна, а многие компоненты, необходимые для ее манипуляций, восстановления и использования, идентифицированы и охарактеризованы, исследователи начинают изучать возможность разработки наноскопических механизмов, которые будут включены в живой организм, обладающий способность лечить болезни, бороться с раком и выпускать лекарства на основе биологического стимула, обеспечиваемого организмом наноскопическому оборудованию. ДНК-лигазу, скорее всего, придется включить в такую машину. [ 19 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000105486 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000056394 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Кресге Н., Симони Р.Д., Хилл Р.Л. (январь 2007 г.). «Взгляд на соединение ДНК: работа I. Роберта Лемана над ДНК-лигазой» . Журнал биологической химии . 282 (2): е1–е3. дои : 10.1016/S0021-9258(20)73504-0 .
- ^ Перейти обратно: а б с Феррари Дж., Росси Р., Арозио Д., Виндини А., Биамонти Дж., Монтекукко А. (сентябрь 2003 г.). «Зависимое от клеточного цикла фосфорилирование ДНК-лигазы I человека в сайтах циклин-зависимой киназы» . Журнал биологической химии . 278 (39): 37761–7. дои : 10.1074/jbc.M304462200 . ПМИД 12851383 .
- ^ Перейти обратно: а б Росси Р., Вилла А, Негри С, Сковасси I, Чиаррокки Дж., Биамонти Дж., Монтекукко А (октябрь 1999 г.). «Фабрика репликации, нацеленная на последовательность/сайт связывания PCNA, необходима в G (1) для контроля статуса фосфорилирования ДНК-лигазы I» . Журнал ЭМБО . 18 (20): 5745–54. дои : 10.1093/emboj/18.20.5745 . ПМЦ 1171641 . ПМИД 10523317 .
- ^ Перейти обратно: а б с Элленбергер Т., Томкинсон А.Е. (2008). «ДНК-лигазы эукариот: структурные и функциональные данные» . Ежегодный обзор биохимии . 77 : 313–38. doi : 10.1146/annurev.biochem.77.061306.123941 . ПМЦ 2933818 . ПМИД 18518823 .
- ^ Приджент С., Ласко Д.Д., Кодама К., Вуджетт-младший, Линдал Т. (август 1992 г.). «Активация ДНК-лигазы I млекопитающих посредством фосфорилирования казеинкиназой II» . Журнал ЭМБО . 11 (8): 2925–33. дои : 10.1002/j.1460-2075.1992.tb05362.x . ПМК 556774 . ПМИД 1639065 .
- ^ Перейти обратно: а б «Ген Энтрез: LIG1 лигаза I, ДНК, АТФ-зависимая» .
- ^ Шрисканда В., Шуман С. (январь 1998 г.). «ДНК-лигаза вируса хлореллы: распознавание никеля и мутационный анализ» . Исследования нуклеиновых кислот . 26 (2): 525–31. doi : 10.1093/nar/26.2.525 (неактивен 11 апреля 2024 г.). ПМЦ 147278 . ПМИД 9421510 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ Тейлор М.Р., Конрад Дж.А., Уол Д., О'Брайен П.Дж. (июль 2011 г.). «Кинетический механизм ДНК-лигазы I человека обнаруживает магний-зависимые изменения на этапе ограничения скорости, которые ставят под угрозу эффективность лигирования» . Журнал биологической химии . 286 (26): 23054–62. дои : 10.1074/jbc.M111.248831 . ПМК 3123073 . ПМИД 21561855 .
- ^ Перейти обратно: а б Расс У, Ахель I, Западный SC (март 2007 г.). «Действие апратаксина на множественные пути репарации ДНК» . Журнал биологической химии . 282 (13): 9469–74. дои : 10.1074/jbc.M611489200 . ПМИД 17276982 .
- ^ Перейти обратно: а б Саттлер У., Фрит П., Саллес Б., Калсу П. (апрель 2003 г.). «Синтез репарации ДНК с длинными участками во время эксцизионной репарации оснований в клетках млекопитающих» . Отчеты ЭМБО . 4 (4): 363–7. дои : 10.1038/sj.embor.embor796 . ПМЦ 1319152 . ПМИД 12671676 .
- ^ Перейти обратно: а б Хегде М.Л., Хазра Т.К., Митра С. (январь 2008 г.). «Ранние этапы пути удаления основания ДНК/восстановления одноцепочечного разрыва в клетках млекопитающих» . Клеточные исследования . 18 (1): 27–47. дои : 10.1038/cr.2008.8 . ПМЦ 2692221 . ПМИД 18166975 .
- ^ Перейти обратно: а б Балакришнан Л., Брандт П.Д., Линдси-Больц Л.А., Санкар А., Бамбара Р.А. (май 2009 г.). «Репарация при иссечении длинного основания патча происходит посредством скоординированной стимуляции мультиферментного комплекса репарации ДНК» . Журнал биологической химии . 284 (22): 15158–72. дои : 10.1074/jbc.M109.000505 . ПМЦ 2685697 . ПМИД 19329425 .
- ^ Маффуччи П., Чавес Дж., Юркив Т.Дж., О'Брайен П.Дж., Эбботт Дж.К., Рейнольдс П.Р. и др. (декабрь 2018 г.). «Двуаллельные мутации в ДНК-лигазе 1 лежат в основе спектра иммунных дефицитов» . Журнал клинических исследований . 128 (12): 5489–5504. дои : 10.1172/JCI99629 . ПМК 6264644 . ПМИД 30395541 .
- ^ Сан Д., Уррабаз Р., Нгуен М., Марти Дж., Стрингер С., Круз Э. и др. (декабрь 2001 г.). «Повышенная экспрессия ДНК-лигазы I при раке человека». Клинические исследования рака . 7 (12): 4143–8. ПМИД 11751514 .
- ^ Макдональд Дж. (ноябрь 2008 г.). «Умная ДНК: программирование молекулы жизни для работы и развлечений [превью]» . научный американский . Проверено 22 февраля 2013 г.
Дальнейшее чтение
[ редактировать ]- Леонхардт Х, Кардозо MC (1996). «Нацеливание и ассоциация белков с функциональными доменами в ядре: нерастворимое решение». Структурная и функциональная организация ядерной матрицы . Международный обзор цитологии. Том. 162Б. стр. 303–35. дои : 10.1016/S0074-7696(08)62620-0 . ISBN 978-0-12-364566-1 . ПМИД 8557490 .
- Томкинсон А.Е., Макки З.Б. (февраль 1998 г.). «Структура и функция ДНК-лигаз млекопитающих». Мутационные исследования . 407 (1): 1–9. дои : 10.1016/s0921-8777(97)00050-5 . ПМИД 9539976 .
- Перриго М., Пьеро-Дезейлиньи Э., Бассель Б., Хелд Дж. П. (апрель 1976 г.). «[Паралич после радикулографии Димера X]». Новая медицинская пресса . 5 (17): 1120–2. ПМИД 934827 .
- Вебстер А.Д., Барнс Д.Е., Арлетт К.Ф., Леманн А.Р., Линдал Т. (июнь 1992 г.). «Задержка роста и иммунодефицит у пациента с мутациями гена ДНК-лигазы I». Ланцет . 339 (8808): 1508–9. дои : 10.1016/0140-6736(92)91266-Б . ПМИД 1351188 . S2CID 11874717 .
- Барнс Д.Е., Томкинсон А.Е., Леманн А.Р., Вебстер А.Д., Линдал Т. (май 1992 г.). «Мутации в гене ДНК-лигазы I у человека с иммунодефицитами и клеточной гиперчувствительностью к агентам, повреждающим ДНК». Клетка . 69 (3): 495–503. дои : 10.1016/0092-8674(92)90450-Q . ПМИД 1581963 . S2CID 11736507 .
- Барнс Д.Э., Кодама К., Тайнан К., Траск Б.Дж., Кристенсен М., Де Йонг П.Дж. и др. (январь 1992 г.). «Присвоение гена, кодирующего ДНК-лигазу I, хромосоме человека 19q13.2-13.3» . Геномика . 12 (1): 164–6. дои : 10.1016/0888-7543(92)90422-О . ПМИД 1733856 .
- Петрини Дж. Х., Хувилер К. Г., Уивер Д. Т. (сентябрь 1991 г.). «Ген ДНК-лигазы I дикого типа экспрессируется в клетках с синдромом Блума» . Труды Национальной академии наук Соединенных Штатов Америки . 88 (17): 7615–9. Бибкод : 1991PNAS...88.7615P . дои : 10.1073/pnas.88.17.7615 . ПМК 52352 . ПМИД 1881902 .
- Ласко Д.Д., Томкинсон А.Е., Линдал Т. (июль 1990 г.). «ДНК-лигазы млекопитающих. Биосинтез и внутриклеточная локализация ДНК-лигазы I» . Журнал биологической химии . 265 (21): 12618–22. дои : 10.1016/S0021-9258(19)38388-7 . ПМИД 2197279 .
- Барнс Д.Е., Джонстон Л.Х., Кодама К., Томкинсон А.Е., Ласко Д.Д., Линдал Т. (сентябрь 1990 г.). «КДНК ДНК-лигазы I человека: клонирование и функциональная экспрессия в Saccharomyces cerevisiae» . Труды Национальной академии наук Соединенных Штатов Америки . 87 (17): 6679–83. Бибкод : 1990PNAS...87.6679B . дои : 10.1073/pnas.87.17.6679 . ПМК 54600 . ПМИД 2204063 .
- Монтекукко А., Савини Е., Вейгардт Ф., Росси Р., Чиаррокки Дж., Вилла А., Биамонти Дж. (ноябрь 1995 г.). «N-концевой домен человеческой ДНК-лигазы I содержит сигнал ядерной локализации и направляет фермент к местам репликации ДНК» . Журнал ЭМБО . 14 (21): 5379–86. дои : 10.1002/j.1460-2075.1995.tb00222.x . ПМЦ 394647 . ПМИД 7489727 .
- Маруяма К., Сугано С. (январь 1994 г.). «Олиго-кэпирование: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Джин . 138 (1–2): 171–4. дои : 10.1016/0378-1119(94)90802-8 . ПМИД 8125298 .
- Траск Б., Фертитта А., Кристенсен М., Янгблом Дж., Бергманн А., Коупленд А. и др. (январь 1993 г.). «Картирование флуоресцентной гибридизации in situ хромосомы 19 человека: расположение цитогенетических полос 540 космид и 70 генов или маркеров ДНК» . Геномика . 15 (1): 133–45. дои : 10.1006/geno.1993.1021 . ПМИД 8432525 .
- Петрини Дж. Х., Уолш М. Е., ДиМаре С., Чен X. Н., Коренберг Дж. Р., Уивер Д. Т. (сентябрь 1995 г.). «Выделение и характеристика человеческого гомолога MRE11». Геномика . 29 (1): 80–6. дои : 10.1006/geno.1995.1217 . ПМИД 8530104 .
- Бентли Д., Селфридж Дж., Миллар Дж.К., Сэмюэл К., Хоул Н., Анселл Дж.Д., Мелтон Д.В. (август 1996 г.). «ДНК-лигаза I необходима для эритропоэза печени плода, но не важна для жизнеспособности клеток млекопитающих». Природная генетика . 13 (4): 489–91. дои : 10.1038/ng0896-489 . ПМИД 8696349 . S2CID 20264173 .
- Сузуки Ю, Ёситомо-Накагава К, Маруяма К, Суяма А, Сугано С (октябрь 1997 г.). «Создание и характеристика библиотеки кДНК, обогащенной по полной длине и по 5'-концу». Джин . 200 (1–2): 149–56. дои : 10.1016/S0378-1119(97)00411-3 . ПМИД 9373149 .
- Росси Р., Вилла А, Негри С, Сковасси I, Чиаррокки Дж., Биамонти Дж., Монтекукко А (октябрь 1999 г.). «Фабрика репликации, нацеленная на последовательность/сайт связывания PCNA, необходима в G (1) для контроля статуса фосфорилирования ДНК-лигазы I» . Журнал ЭМБО . 18 (20): 5745–54. дои : 10.1093/emboj/18.20.5745 . ПМЦ 1171641 . ПМИД 10523317 .
- Мацумото Ю., Ким К., Гурвиц Дж., Гэри Р., Левин Д.С., Томкинсон А.Е., Парк М.С. (ноябрь 1999 г.). «Восстановление ядерного антиген-зависимого восстановления апуриновых/апиримидиновых участков пролиферирующих клеток с помощью очищенных белков человека» . Журнал биологической химии . 274 (47): 33703–8. дои : 10.1074/jbc.274.47.33703 . ПМИД 10559261 .
- Виспе С., Сато М.С. (сентябрь 2000 г.). «Образование двухцепочечного разрыва ДНК в клетках человека, опосредованное патчем репарации ДНК» . Журнал биологической химии . 275 (35): 27386–92. дои : 10.1074/jbc.M003126200 . ПМИД 10827190 .





