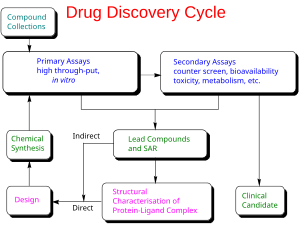
Доклиническая разработка
Эта статья нуждается в более надежных медицинских ссылках для проверки или слишком сильно полагается на первоисточники . ( июнь 2020 г. ) |  |
При лекарств разработке доклиническая разработка (также называемая доклиническими исследованиями или доклиническими исследованиями ) — это этап исследований, который начинается до клинических испытаний (испытаний на людях) и в ходе которого собираются важные данные о осуществимости, итеративных испытаниях и безопасности лекарств, обычно на лабораторных животных.
Основными целями доклинических исследований являются определение стартовой безопасной дозы для первого исследования на людях и оценка потенциальной токсичности продукта, которая обычно включает новые медицинские устройства , отпускаемые по рецепту лекарства и диагностические средства .
Компании используют стилизованную статистику, чтобы проиллюстрировать риски в доклинических исследованиях, например, в среднем только одно из каждых 5000 соединений, дошедших одобренным до стадии доклинической разработки, становится препаратом . [1] [2]
Виды доклинических исследований
[ редактировать ]Каждый класс продуктов может подвергаться различным видам доклинических исследований. Например, лекарства могут подвергаться фармакодинамике (что лекарство делает с организмом) (PD), фармакокинетике (что организм делает с лекарством) (PK), ADME и токсикологическим испытаниям . Эти данные позволяют исследователям аллометрически оценить безопасную стартовую дозу препарата для клинических испытаний на людях. Медицинские устройства, к которым не прикреплено лекарственное средство, не будут подвергаться этим дополнительным тестам и могут быть направлены непосредственно на тестирование надлежащей лабораторной практики (GLP) на предмет безопасности устройства и его компонентов. Некоторые медицинские устройства также проходят тестирование на биосовместимость, которое помогает показать, является ли компонент устройства или все компоненты устойчивыми в живой модели. Большинство доклинических исследований должны соответствовать GLP, указанным в рекомендациях ICH, чтобы их можно было представить в регулирующие органы, такие как Управление по контролю за продуктами и лекарствами США.
Обычно как in vitro , так и in vivo проводятся тесты . Исследования токсичности лекарств включают в себя определение того, на какие органы воздействует этот препарат, а также наличие каких-либо долгосрочных канцерогенных или токсических эффектов, вызывающих заболевание.
Тестирование на животных
[ редактировать ]Информация, собранная в результате этих исследований, имеет жизненно важное значение для начала безопасных испытаний на людях. Обычно в исследованиях по разработке лекарств на животных участвуют два вида животных. Наиболее часто используемые модели — мышиные и собачьи , хотя приматы и свиньи также используются .
Выбор вида
[ редактировать ]Выбор видов основан на том, какой из них даст наилучшую корреляцию с испытаниями на людях. Различия в кишечнике , активности ферментов , системе кровообращения или другие факторы делают определенные модели более подходящими в зависимости от лекарственной формы , места активности или вредных метаболитов . Например, собаки не могут быть хорошей моделью для твердых пероральных лекарственных форм, поскольку характерный кишечник плотоядных животных развит недостаточно по сравнению с кишечником всеядных животных, а скорость опорожнения желудка увеличена. Кроме того, грызуны не могут служить моделью для антибиотиков, поскольку возникающие в результате изменения их кишечной флоры вызывают серьезные побочные эффекты . В зависимости от функциональных групп препарата он может метаболизироваться одинаковым или различным образом у разных видов, что влияет как на эффективность, так и на токсикологию.
Исследования медицинского оборудования также используют эту основную предпосылку. Большинство исследований проводится на более крупных видах, таких как собаки, свиньи и овцы, что позволяет проводить испытания на модели того же размера, что и человек. Кроме того, некоторые виды используются из-за сходства в физиологии конкретных органов или систем органов (свиньи для дерматологических исследований и исследований коронарных стентов; козы для исследований имплантатов молочной железы; собаки для исследований желудка и рака и т. д.).
Важно отметить, что нормативные рекомендации FDA , EMA и других аналогичных международных и региональных органов обычно требуют проведения испытаний на безопасность как минимум на двух видах млекопитающих, включая один вид, не являющийся грызунами, прежде чем получить разрешение на испытания на людях. [3]
Этические проблемы
[ редактировать ]Тестирование на животных в научно-исследовательской фармацевтической промышленности в последние годы сократилось как по этическим, так и по экономическим соображениям. Тем не менее, большинство исследований по-прежнему будут включать тестирование на животных на предмет сходства анатомии и физиологии, которое необходимо для разработки разнообразных продуктов.
Нет наблюдаемых уровней эффекта
[ редактировать ]На основе доклинических исследований устанавливаются уровни ненаблюдаемых побочных эффектов (NOAEL) для лекарственных средств, которые используются для определения начальных уровней дозировок клинических испытаний фазы 1 на основе массового API на массового пациента. Обычно коэффициент неопределенности 1/100 или «запас прочности» включается для учета межвидовых (1/10) и межиндивидуальных (1/10) различий.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Эмануэль Э.Дж. (9 сентября 2015 г.). «Решение проблемы цен на лекарства» . Нью-Йорк Таймс .
В среднем только одно из каждых 5000 соединений, которые фармацевтические компании обнаруживают и проводят доклинические испытания, становится одобренным препаратом. Из лекарств, начатых в клинических испытаниях на людях, только 10 процентов получили одобрение FDA. ...
- ^ «Одобрения лекарств – от изобретения до выхода на рынок… 12 лет!» . МедицинаНет . Проверено 21 апреля 2021 г.
- ^ Атанасов А.Г., Вальтенбергер Б., Пферши-Венциг Э.М., Линдер Т., Ваврош С., Ухрин П., Теммл В., Ван Л., Швайгер С., Хейсс Э.Х., Роллингер Дж.М., Шустер Д., Бреусс Дж.М., Бочков В., Миховилович М.Д., Копп Б., Бауэр Р., Дирш В.М., Штуппнер Х. (декабрь 2015 г.). «Открытие и пополнение запасов фармакологически активных натуральных продуктов растительного происхождения: обзор» . Достижения биотехнологии . 33 (8): 1582–1614. doi : 10.1016/j.biotechadv.2015.08.001 . ПМЦ 4748402 . ПМИД 26281720 .