Буферный раствор
Буферный раствор — это раствор, в котором pH существенно не меняется при разбавлении или при добавлении кислоты или основания при постоянной температуре. [ 1 ] небольшое количество сильной кислоты или основания Его pH меняется очень мало, когда к нему добавляют . Буферные растворы используются в качестве средства поддержания почти постоянного значения pH в самых разных химических процессах. В природе существует множество живых систем , которые используют буферизацию для регулирования pH. Например, бикарбонатная буферная система используется для регулирования , а pH крови бикарбонат также действует как буфер в океане .
Принципы буферизации
[ редактировать ]
Буферные растворы сопротивляются изменению pH из-за химического равновесия между слабой кислотой HA и сопряженным с ней основанием A. − :
Когда к равновесной смеси слабой кислоты и сопряженного с ней основания добавляют немного сильной кислоты, ионы водорода ( H + ) складываются, и равновесие смещается влево, в соответствии с принципом Ле Шателье . Из-за этого концентрация ионов водорода увеличивается меньше, чем ожидается для такого количества добавленной сильной кислоты. Аналогично, если к смеси добавить сильную щелочь, концентрация ионов водорода уменьшится меньше, чем ожидается для количества добавленной щелочи. На рисунке 1 эффект иллюстрируется моделированием титрования слабой кислоты с p K a = 4,7. Относительная концентрация недиссоциированной кислоты показана синим цветом, а сопряженного с ней основания - красным. pH изменяется сравнительно медленно в буферной области, pH = p K a ± 1, с центром при pH = 4,7, где [HA] = [A − ]. Концентрация ионов водорода снижается меньше, чем ожидалось, поскольку большая часть добавленного гидроксид-иона расходуется в реакции.
и лишь немного расходуется на реакцию нейтрализации (которая приводит к увеличению pH)
Когда кислота депротонирована более чем на 95% , pH быстро повышается, поскольку большая часть добавленной щелочи расходуется на реакцию нейтрализации.
Буферная емкость
[ редактировать ]Буферная емкость является количественной мерой устойчивости к изменению pH раствора, содержащего буферный агент, по отношению к изменению концентрации кислоты или щелочи. Его можно определить следующим образом: [ 2 ] [ 3 ] где представляет собой бесконечно малое количество добавленного основания, или где представляет собой бесконечно малое количество добавленной кислоты. pH определяется как -log 10 [H + ], а d (pH) — бесконечно малое изменение pH.
При любом определении буферная емкость для слабой кислоты ГК с константой диссоциации K a может быть выражена как [ 4 ] [ 5 ] [ 3 ] где [Н + ] — концентрация ионов водорода, – общая концентрация добавленной кислоты. K w — константа равновесия самоионизации воды , равная 1,0 × 10 −14 . Заметим, что в решении H + существует в виде иона гидроксония H 3 O + , и дальнейшее увлажнение иона гидроксония оказывает незначительное влияние на равновесие диссоциации, за исключением очень высоких концентраций кислоты.

Это уравнение показывает, что существуют три области повышенной буферной емкости (см. рисунок 2).
- В центральной части кривой (окрашенной на графике зеленым) второй член является доминирующим, а возрастает до локального максимума при pH = pKa . Буферная емкость Высота этого пика зависит от значения pK a . Буферная емкость незначительна, когда концентрация [HA] буферного агента очень мала и увеличивается с увеличением концентрации буферного агента. [ 3 ] Некоторые авторы показывают на графиках буферной емкости только эту область. [ 2 ] Буферная емкость падает до 33 % от максимального значения при pH = p K a ± 1, до 10 % при pH = p K a ± 1,5 и до 1 % при pH = p K a ± 2. По этой причине наиболее полезен диапазон составляет приблизительно p K a ± 1. При выборе буфера для использования при определенном pH он должен иметь значение ap a, K максимально близкое к этому pH. [ 2 ]
- В сильнокислых растворах с pH менее 2 (окрашено на графике красным) первый член уравнения доминирует, а буферная емкость возрастает экспоненциально с уменьшением pH: Это связано с тем, что второй и третий члены становятся пренебрежимо малыми при очень низких значениях pH. Этот термин не зависит от присутствия или отсутствия буферного агента.
- В сильнощелочных растворах с pH более 12 (на графике отмечен синим цветом) третий член уравнения доминирует, и буферная емкость возрастает экспоненциально с увеличением pH: Это связано с тем, что первое и второе слагаемые становятся незначительными при очень высоких значениях pH. Этот термин также не зависит от присутствия или отсутствия буферного агента.
Применение буферов
[ редактировать ]pH раствора, содержащего буферный агент, может изменяться только в узком диапазоне, независимо от того, что еще может присутствовать в растворе. В биологических системах это необходимое условие ферментов правильного функционирования . Например, в крови человека находится смесь угольной кислоты (H
22
3 ) и бикарбонат (HCO −
3 ) присутствует во фракции плазмы ; это представляет собой основной механизм поддержания pH крови между 7,35 и 7,45. За пределами этого узкого диапазона (7,40 ± 0,05 единицы pH) быстро развиваются метаболические состояния ацидоза и алкалоза , что в конечном итоге приводит к смерти, если правильная буферная емкость не восстанавливается быстро.
Если значение pH раствора слишком сильно повышается или падает, эффективность фермента снижается в результате процесса, известного как денатурация , который обычно необратим. [ 6 ] Большинство биологических образцов, которые используются в исследованиях, хранятся в буферном растворе, часто фосфатно-солевом буфере (PBS) с pH 7,4.
В промышленности буферные агенты используются в процессах ферментации и для создания правильных условий для красителей, используемых при окраске тканей. Они также используются в химическом анализе. [ 5 ] и калибровка рН-метров .
Простые буферные агенты
[ редактировать ]Буферный агент п К а Полезный диапазон pH Лимонная кислота 3.13, 4.76, 6.40 2.1–7.4 Уксусная кислота 4.8 3.8–5.8 КХ 2 ПО 4 7.2 6.2–8.2 ЧЭС 9.3 8.3–10.3 Борат 9.24 8.25–10.25
Для буферов в кислых областях pH можно довести до желаемого значения путем добавления сильной кислоты, такой как соляная кислота, к конкретному буферному агенту. сильное основание, такое как гидроксид натрия К щелочным буферам можно добавить . Альтернативно, буферная смесь может быть приготовлена из смеси кислоты и сопряженного с ней основания. Например, ацетатный буфер можно приготовить из смеси уксусной кислоты и ацетата натрия . Аналогичным образом щелочной буфер можно приготовить из смеси основания и сопряженной с ним кислоты.
«Универсальные» буферные смеси
[ редактировать ]Комбинируя вещества со значениями p K a , отличающимися всего на два или менее, и регулируя pH, можно получить широкий спектр буферов. Лимонная кислота является полезным компонентом буферной смеси, поскольку она имеет три значения p K a , разделенные менее чем двумя. Диапазон буферов можно расширить за счет добавления других буферных агентов. Следующие смеси ( буферные растворы Макилвейна ) имеют буферный диапазон от 3 до 8. [ 7 ]
0,2 М Na 2 HPO 4 (мл) 0,1 М лимонная кислота (мл) рН 20.55 79.45 3.0 38.55 61.45 4.0 51.50 48.50 5.0 63.15 36.85 6.0 82.35 17.65 7.0 97.25 2.75 8.0
Смесь, содержащая лимонную кислоту , монокалийфосфат , борную кислоту и диэтилбарбитуровую кислоту , может быть приготовлена так, чтобы охватывать диапазон pH от 2,6 до 12. [ 8 ]
Другими универсальными буферами являются буфер Кармоди. [ 9 ] и буфер Бриттона-Робинсона , разработанный в 1931 году.
Общие буферные соединения, используемые в биологии
[ редактировать ]Эффективную дальность см. в разделе «Буферная емкость » выше. Также см. Буферы Гуда, чтобы узнать об исторических принципах проектирования и благоприятных свойствах этих буферных веществ в биохимических приложениях.
| Общее название (химическое название) | Структура | п К а , 25 °С |
Темп. эффект, dpH / d T (K −1 ) [ 10 ] |
Мол. масса |
|---|---|---|---|---|
| КРАНЫ , ([трис(гидроксиметил)метиламино]пропансульфоновая кислота) |
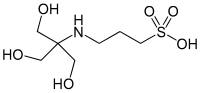 |
8.43 | −0.018 | 243.3 |
| Бицин , (2-(бис(2-гидроксиэтил)амино)уксусная кислота) |
 |
8.35 | −0.018 | 163.2 |
| Трис , (трис(гидроксиметил)аминометан, или 2-амино-2-(гидроксиметил)пропан-1,3-диол) |
 |
8.07 [ а ] | −0.028 | 121.14 |
| Трицин , (N-[трис(гидроксиметил)метил]глицин) |
 |
8.05 | −0.021 | 179.2 |
| ТАПСО , (3-[N-трис(гидроксиметил)метиламино]-2-гидроксипропансульфоновая кислота) |
 |
7.635 | 259.3 | |
| ХЕПЕС , (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) |
 |
7.48 | −0.014 | 238.3 |
| ТЭС , (2-[[1,3-дигидрокси-2-(гидроксиметил)пропан-2-ил]амино]этансульфоновая кислота) |
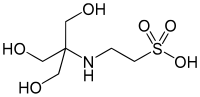 |
7.40 | −0.020 | 229.20 |
| МОПС , (3-(N-морфолино)пропансульфоновая кислота) |
 |
7.20 | −0.015 | 209.3 |
| ТРУБЫ , (пиперазин-N,N'-бис(2-этансульфоновая кислота)) |
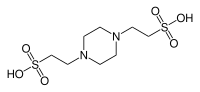 |
6.76 | −0.008 | 302.4 |
| какодилата , (диметилмышьяковая кислота) |
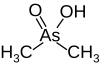 |
6.27 | 138.0 | |
| МЫ , (2-(N-морфолино)этансульфоновая кислота) |
 |
6.15 | −0.011 | 195.2 |
- ^ Трис — основание, p K a = 8,07 относится к сопряженной с ним кислоте.
Расчет pH буфера
[ редактировать ]Монопротонные кислоты
[ редактировать ]Сначала запишите выражение равновесия
Это показывает, что при диссоциации кислоты образуются равные количества ионов водорода и анионов. Равновесные концентрации этих трех компонентов можно рассчитать с помощью таблицы ICE (ICE означает «начальное, изменение, равновесие»).
Таблица ICE для монопротонной кислоты [ХА] [А − ] [ЧАС + ] я С 0 0 и С − х х х И С 0 - х х х + у
В первой строке, обозначенной I , перечислены начальные условия: концентрация кислоты равна C 0 , первоначально недиссоциированной, поэтому концентрации A − и Х + будет равно нулю; y — начальная концентрация добавленной сильной кислоты, например соляной кислоты. Если добавить сильную щелочь, например гидроксид натрия, то у будет отрицательный знак, поскольку щелочь удаляет ионы водорода из раствора. Вторая строка, помеченная буквой C («изменение»), указывает изменения, которые происходят при диссоциации кислоты. Концентрация кислоты уменьшается на величину − x , а концентрации A − и Х + оба увеличиваются на сумму + x . Это следует из выражения равновесия. Третья строка, обозначенная E ( что означает «равновесие»), суммирует первые две строки и показывает равновесные концентрации.
Для нахождения x воспользуемся формулой константы равновесия через концентрации:
Замените концентрации значениями, найденными в последней строке таблицы ICE:
Упростите до
Имея конкретные значения C 0 , K a и y , это уравнение можно решить для x . Предполагая, что pH = −log 10 [H + ], pH можно рассчитать как pH = −log 10 ( x + y ).
Полипротонные кислоты
[ редактировать ]
Полипротонные кислоты – это кислоты, которые могут терять более одного протона. Константу диссоциации первого протона можно обозначить как K a1 , а константы диссоциации последующих протонов - как K a2 и т. д. Лимонная кислота является примером полипротонной кислоты H 3 A, так как она может терять три протона.
Константы ступенчатой диссоциации Равновесие Лимонная кислота Ч 3 А ⇌ Ч 2 А − + Ч + р К а1 = 3,13 H2H2A − ⇌ ХА 2− + Ч + р К а2 = 4,76 ХА 2− ⇌ А 3− + Ч + р К а3 = 6,40
Когда разница между последовательными pKa значениями составляет менее примерно 3, происходит перекрытие диапазонов pH существования видов в равновесии. Чем меньше разница, тем больше совпадение. В случае лимонной кислоты перекрытие является обширным, и растворы лимонной кислоты забуферены во всем диапазоне pH от 2,5 до 7,5.
Расчет pH с помощью полипротонной кислоты требует расчета видообразования выполнения . В случае лимонной кислоты это влечет за собой решение двух уравнений баланса масс:
CA – аналитическая концентрация кислоты, CH – аналитическая концентрация добавленных ионов водорода, β q – кумулятивные константы ассоциации . Kw – константа самоионизации воды . Имеются два нелинейных одновременных уравнения с двумя неизвестными [A 3− ] и [Ч + ]. Существует множество компьютерных программ, позволяющих выполнить этот расчет. Диаграмма состава лимонной кислоты была построена с помощью программы HySS. [ 11 ]
NB. Нумерация кумулятивных общих констант обратна нумерации ступенчатых констант диссоциации.
Связь между значениями кумулятивной константы ассоциации (β) и значениями ступенчатой константы диссоциации (K) для трехосновной кислоты. Равновесие Отношение А 3− + Ч + ⇌ АХ 2+ Log β 1 = pk a3 А 3− +2Ч + ⇌ АХ 2 + Log β 2 =pk a2 + pk a3 А 3− + 3H + ⇌ АХ 3 Log β 3 = pk a1 + pk a2 + pk a3
Кумулятивные константы ассоциации используются в компьютерных программах общего назначения, таких как та, которая используется для получения приведенной выше диаграммы видообразования.
См. также
[ редактировать ]- Уравнение Хендерсона – Хассельбаха
- Буферный агент
- Буферы Гуда
- Эффект общего иона
- Буфер для ионов металлов
- Минеральный окислительно-восстановительный буфер
Ссылки
[ редактировать ]- ^ Дж. Гордон Беттс (25 апреля 2013 г.). «Неорганические соединения, необходимые для жизнедеятельности человека». Анатомия и физиология . ОпенСтакс. ISBN 978-1-947172-04-3 . Проверено 14 мая 2023 г.
- ^ Перейти обратно: а б с Скуг, Дуглас А.; Уэст, Дональд М.; Холлер, Ф. Джеймс; Крауч, Стэнли Р. (2014). Основы аналитической химии (9-е изд.). Брукс/Коул. п. 226. ИСБН 978-0-495-55828-6 .
- ^ Перейти обратно: а б с Урбанский, Эдвард Т.; Шок, Майкл Р. (2000). «Понимание, определение и расчет буферной емкости». Журнал химического образования . 77 (12): 1640–1644. Бибкод : 2000ЮЧЭд..77.1640У . дои : 10.1021/ed077p1640 .
- ^ Батлер, Дж. Н. (1998). Ионное равновесие: расчеты растворимости и pH . Уайли. стр. 133–136. ISBN 978-0-471-58526-8 .
- ^ Перейти обратно: а б Хуланицки, А. (1987). Реакции кислот и оснований в аналитической химии . Перевод Массона, Мэри Р. Хорвуд. ISBN 978-0-85312-330-9 .
- ^ Скорпион, Р. (2000). Основы кислот, оснований, буферов и их применение в биохимических системах . Кендалл/Хант Издательская компания. ISBN 978-0-7872-7374-3 .
- ^ Макилвейн, TC (1921). «Буферный раствор для колориметрического сравнения» (PDF) . Ж. Биол. Хим . 49 (1): 183–186. дои : 10.1016/S0021-9258(18)86000-8 . Архивировано (PDF) из оригинала 26 февраля 2015 г.
- ^ Мендхэм, Дж.; Денни, RC; Барнс, доктор медицинских наук; Томас, М. (2000). «Приложение 5». Учебник Фогеля по количественному химическому анализу (5-е изд.). Харлоу: Образование Пирсона. ISBN 978-0-582-22628-9 .
- ^ Кармоди, Уолтер Р. (1961). «Легко приготавливаемая серия буферов широкого спектра». Дж. Хим. Образование . 38 (11): 559–560. Бибкод : 1961JChEd..38..559C . дои : 10.1021/ed038p559 .
- ^ «Буферный справочный центр» . Сигма-Олдрич. Архивировано из оригинала 17 апреля 2009 г. Проверено 17 апреля 2009 г.
- ^ Альдериги, Л.; Ганс, П.; Иенко, А.; Питерс, Д.; Сабатини, А.; Вакка, А. (1999). «Гиперквадное моделирование и видообразование (HySS): служебная программа для исследования равновесия с участием растворимых и частично растворимых веществ» . Обзоры координационной химии . 184 (1): 311–318. дои : 10.1016/S0010-8545(98)00260-4 . Архивировано из оригинала 4 июля 2007 г.
Внешние ссылки
[ редактировать ]«Биологические буферы» . REACH-устройства.





![{\displaystyle \beta =2.303\left([{\ce {H+}}]+{\frac {T_{{\ce {HA}}}K_{a}[{\ce {H+}}]}{( K_{a}+[{\ce {H+}}])^{2}}}+{\frac {K_{\text{w}}}{[{\ce {H+}}]}}\right) ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf8b7c2c34d12f8145df3299a061593aaa76643a)

![{\displaystyle \beta \approx 2,303{\frac {T_{{\ce {HA}}}K_{a}[{\ce {H+}}]}{(K_{a}+[{\ce {H+} }])^{2}}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec0e3ba9d065bfb822350b58e375d1f4630c6235)


![{\displaystyle K_{\text{a}}={\frac {[{\ce {H+}}][{\ce {A-}}]}{[{\ce {HA}}]}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/89cb17f8ab679cc14a5d23888ed230c1a71b7384)


![{\displaystyle {\begin{aligned}C_{{\ce {A}}}&=[{\ce {A^3-}}]+\beta _{1}[{\ce {A^3-} }][{\ce {H+}}]+\beta _{2}[{\ce {A^3-}}][{\ce {H+}}]^{2}+\beta _{3} [{\what {A^3-}}][{\what {H+}}]^{3},\\C_{{\what {H}}}&=[{\what {H+}}]+ \beta _{1}[{\what {A^3-}}][{\what {H+}}]+2\beta _{2}[{\what {A^3-}}][{\ что {H+}}]^{2}+3\beta _{3}[{\what {A^3-}}][{\what {H+}}]^{3}-K_{\text{w }}[{\ce {H+}}]^{-1}.\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/611bf20542dfc1dbd8256ee6465883f1534f527a)