Конъюгат (теория кислотной базы)
Конъюгатная кислота , в рамках теории Brønsted -Lowry Acid -Base , представляет собой химическое соединение, образованное, когда кислота дает протон ( ЧАС + ) до основания - другими словами, это основание с ионом водорода добавленным , поскольку он теряет ион водорода в обратной реакции. С другой стороны, конъюгатное основание - это то, что остается после того, как кислота пожертвовала протон во время химической реакции. Следовательно, конъюгатное основание представляет собой вещество, образованное удалением протона из кислоты, поскольку оно может получить ион водорода в обратной реакции. [ 1 ] Поскольку некоторые кислоты могут давать несколько протонов, конъюгатное основание кислоты сама по себе может быть кислотным.
Таким образом, это может быть представлено как следующая химическая реакция :
Йоханнес Николаус Брёнстед и Мартин Лоури представили теорию Бренстеда -Лоу, которая говорится, что любое соединение, которое может дать протон другому соединению, является кислотой, а соединение, которое получает протон, является основой. Протон - это субатомная частица в ядре с единичным положительным электрическим зарядом. Это представлено символом ЧАС + Потому что он имеет ядро водорода атома , [ 2 ] то есть водородный катион .
Катион может быть конъюгатным может быть конъюгатной кислотой, а анион основанием, в зависимости от того, какое вещество вовлечено, а какая теория кислотной базы используется. Самый простой анион, который может быть конъюгатным основанием, - это свободный электрон в растворе , конъюгатная кислота которого является атомным водородом.
Кислотные реакции
[ редактировать ]В реакции кислоты и базы кислота и основание реагируют с образованием конъюгатного основания и конъюгатной кислоты соответственно. Кислота теряет протон, а база получает протон. На диаграммах, которые указывают на это, новая связь, образованная между основанием и протоном, показана стрелкой, которая начинается с пары электронов из основания и заканчивается в ионе водорода (протон), которая будет передана: 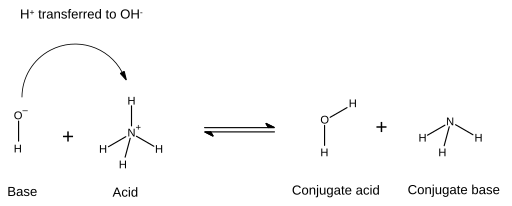 В этом случае молекула воды является конъюгатной кислотой базового гидроксида иона после того, как последний получил ион водорода от аммония . С другой стороны, аммиак является конъюгатным основанием для кислого аммония после того, как аммоний пожертвовал ион водорода для получения молекулы воды. Также, О, − можно рассматривать как сопряженное основание H
В этом случае молекула воды является конъюгатной кислотой базового гидроксида иона после того, как последний получил ион водорода от аммония . С другой стороны, аммиак является конъюгатным основанием для кислого аммония после того, как аммоний пожертвовал ион водорода для получения молекулы воды. Также, О, − можно рассматривать как сопряженное основание H
2 O , поскольку молекула воды жертвует протон, чтобы дать NH +
4 в обратной реакции. Термины «кислота», «основание», «конъюгатная кислота» и «конъюгатное основание» не зафиксированы для определенного химического вещества, но могут быть заменены, если возникающая реакция будет обращена вспять.
Сила конъюгатов
[ редактировать ]Сила конъюгатной кислоты пропорциональна его постоянной расщеплению . Более сильная конъюгатная кислота будет легче расставаться на свои продукты, «протолкнуть» протоны водорода и иметь более высокую константу равновесия . Сила конъюгатного основания можно рассматривать как тенденцию «тянуть» протоны водорода к себе. Если конъюгатное основание классифицируется как сильное, оно «придерживается» протона водорода при растворенности, а его кислота не будет разделена.
Если химическое вещество является сильной кислотой, ее конъюгатная основа будет слабым. [ 3 ] Примером этого случая будет расщепление соляной кислоты HCl в воде. Поскольку HCl является сильной кислотой (она в значительной степени расщепляется), его конъюгатное основание ( CL −
) будет слабым. Поэтому в этой системе большинство h +
будут гидрония ионами h
3 O. +
вместо прикрепления к Cl − Анионы и сопряженные основания будут слабее, чем молекулы воды.
С другой стороны, если химическое вещество является слабой кислотой, ее конъюгатная основа не обязательно будет сильным. Считайте, что этаноат, конъюгатное основание этановой кислоты, имеет константу расщепления основания (KB) около 5,6 × 10 −10 , делая это слабым базой. Для того, чтобы вид имел сильную конъюгатную основу, она должна быть очень слабой кислотой, такой как вода.
Идентификация сопряженных кислотно -базовых пар
[ редактировать ]Чтобы идентифицировать сопряженную кислоту, ищите связанные пары соединений. Кислотно -базовую реакцию можно просматривать в смысле до и после. Перед - сторона реагента уравнения, после того, как продукт - сторона продукта уравнения. Конъюгатная кислота на стороне уравнения приобретает ион водорода, поэтому в рамках до конца уравнения соединение, которое имеет один меньший ион водорода конъюгатной кислоты, является основанием. Конъюгатное основание на стороне уравнения потеряло ион водорода, поэтому в передней стороне уравнения соединение, которое имеет еще один ион водорода конъюгатного основания, является кислотой.
Рассмотрим следующую кислоту -базовую реакцию:
3 + ч
2 O → H
3 O. +
+ Нет −
3
Азотная кислота ( HNO
3 ) является кислотой , потому что он жертвует протон молекуле воды, а ее конъюгатное основание - нитрат ( нет −
3 ). Молекула воды действует как основание, поскольку она получает катион водород (протон), а ее конъюгатная кислота - ион гидрония ( H
3 O. +
).
| Уравнение | Кислота | База | Сопряженная база | Сопряженная кислота |
|---|---|---|---|---|
| Hclo 2 + ч 2 O → CLO − 2 + ч 3 O. + |
Hclo 2 |
ЧАС 2 o |
Clo − 2 |
ЧАС 3 O. + |
| Clo − + H 2 o → Hclo + OH − |
ЧАС 2 o |
Clo − |
ОЙ − |
Hclo |
| HCl + h 2 po − 4 → кл − + H 3 ночи 4 |
Hcl | ЧАС 2 po − 4 |
Калькуляция − |
ЧАС 3 ночи 4 |
Приложения
[ редактировать ]Одно из использования конъюгатных кислот и оснований заключается в буферизации систем, которые включают буферный раствор . В буфере слабая кислота и ее конъюгатное основание (в форме соли), или слабое основание и ее конъюгатная кислота, используются для ограничения изменения pH во время процесса титрования. Буферы имеют как органическое, так и неорганическое химическое применение. Например, помимо буферов, используемых в лабораторных процессах, кровь человека действует как буфер для поддержания pH. Самым важным буфером в нашем кровотоке является буфер карбокидно-бикарбонатного , который предотвращает резкие изменения pH, когда CO
2 представлено. Это функционирует как таковые:
Кроме того, вот таблица общих буферов.
| Буферный агент | PK A. | Полезный диапазон рН |
|---|---|---|
| Лимонная кислота | 3.13, 4.76, 6.40 | 2.1 - 7.4 |
| Уксусная кислота | 4.8 | 3.8 - 5.8 |
| KH 2 POI 4 | 7.2 | 6.2 - 8.2 |
| Ches. | 9.3 | 8.3–10.3 |
| Борат | 9.24 | 8.25 - 10.25 |
Вторым распространенным применением с органическим соединением будет производство буфера с уксусной кислотой. Если уксусная кислота, слабая кислота с формулой CH
3 COOH , был превращен в буферное раствор, его необходимо объединить с его конъюгатной базой CH
3 COO −
в форме соли. Полученная смесь называется ацетатным буфером, состоящий из водного CH
3 COOH и AWERY CH
3 COONA . Уксусная кислота, наряду со многими другими слабыми кислотами, служат полезными компонентами буферов в разных лабораторных условиях, каждый из которых полезен в своем собственном диапазоне pH.
Раствор лактата Рингера является примером, где конъюгатное основание органической кислоты, молочной кислоты , Ch
3 Ch (OH) Что −
2 сочетается с катионами натрия, кальция и калия и хлоридными анионами в дистиллированной воде [ 4 ] которые вместе образуют жидкость, которая является изотонической по отношению к крови человека и используется для реанимации жидкости после крови из -за травмы , хирургии или ожоговой травмы . [ 5 ]
Таблица кислот и их сопряженные основания
[ редактировать ]Ниже приведены несколько примеров кислот и их соответствующих сопряженных оснований; Обратите внимание, как они отличаются только одним протоном (ч + Ион). Прочность кислоты уменьшается, а прочность конъюгатного основания увеличивается вниз по столу.
| Кислота | Сопряженная база |
|---|---|
| ЧАС 2 ф + Флуороний ион |
HF Фторид водорода |
| HCL соляная кислота | Калькуляция − Хлорид ион |
| H 2 SO 4 серной кислоты | HSO − 4 серо водорода ион ( бисульфат -ион) |
| HNO 3 азотная кислота | НЕТ − 3 нитрат -ион |
| H 3 o + Гидроний ион | H 2 o Вода |
| HSO − 4 серо водорода ион |
ТАК 2− 4 сульфат -ион |
| H 3 PO 4 Фосфорная кислота | H 2 Po − 4 дигидрогенофосфатного иона |
| CH 3 COOH Уксусная кислота | Ch 3 COO − Ацетатный ион |
| HF Гидрофторическая кислота | Фон − Фторид ион |
| H 2 CO 3 углекислота | HCO − 3 водородного карбоната ион |
| H 2 S Гидросульфуриновая кислота | HS − Гидросульфид ион |
| H 2 Po − 4 дигидрогенофосфатного иона |
HPO 2− 4 водорода фосфата ион |
| Нын -н.э. + 4 аммония ион |
NH 3 аммиак |
| H 2 o Вода ( pH = 7) | ОЙ − Гидроксид -ион |
| HCO − 3 гидрогенкбоната (бикарбонат) ион |
Сопутствующий 2− 3 Карбонат ион |
Таблица оснований и их сопряженные кислоты
[ редактировать ]Напротив, вот таблица оснований и их сопряженных кислот. Аналогично, прочность основания уменьшается, а прочность конъюгатной кислоты увеличивается вниз по столу.
| База | Сопряженная кислота |
|---|---|
| В 2 часа 5 нх 2 этиламин |
В 2 часа 5 нх + 3 этиламмония ион |
| Гнездо 3 нх 2 метиламин |
Гнездо 3 нх + 3 метиламмония ион |
| Нын -н.э. 3 аммиака |
Нын -н.э. + 4 аммония ион |
| В 5 часов 5 N пиридин |
В 5 часов 6 н + Пиридиний |
| В 6 часов 5 нх 2 муты |
В 6 часов 5 нх + 3 фениламмония ион |
| В 6 часов 5 co − 2 бензоат -ион |
В 6 часов 6 co 2 бензойная кислота |
| Фон − Фторид ион |
HF Фторид водорода |
| PO 3− 4 фосфат -ион |
HPO 2− 4 водорода фосфата ион |
| ОЙ − Гидроксид -ион | H 2 o Вода (нейтральная, рН 7) |
| HCO − 3 бикарбонат |
ЧАС 22 3 углекислота |
| Сопутствующий 2− 3 Карбонат ион |
HCO − 3 бикарбонат |
| Бренд − Бромид -ион |
HBR водород Бромид |
| HPO 2− 4 водородфосфат |
ЧАС 2 po − 4 дигидрогенофосфатного иона |
| Калькуляция − Хлорид ион |
HCL -водород Хлорид |
| ЧАС 2 o Вода |
ЧАС 3 O. + Гидроний ион |
| Нитрит -ион | Азота кислота |
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Zumdahl, Stephen S. & Zumdahl, Susan A. Chemistry . Houghton Mifflin, 2007, ISBN 0618713700
- ^ "Брёнстед - теория лаури | Химия" . Энциклопедия Британская . Получено 25 февраля 2020 года .
- ^ «Прочность конъюгатных кислот и учебного пособия по химии» . www.ausetute.com.au . Получено 25 февраля 2020 года .
- ^ Британский национальный формулярный запас: BNF 69 (69 Ed.). Британская медицинская ассоциация. 2015. с. 683. ISBN 9780857111562 .
- ^ Пестана, Карлос (7 апреля 2020 года). Примечания к хирургии Пестана (пятое изд.). Каплан Медицинский тест подготовка. С. 4–5. ISBN 978-1506254340 .






