Ты погрузишься
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Спинраза |
| Другие имена | ИОНИС-СМН Прием , ИСИС-СМН Прием |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а617010 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | интратекальный |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Биодоступность | 100% (интратекально) |
| Связывание с белками | <25% (в спинномозговой жидкости), >94% (в плазме) [6] |
| Метаболизм | Гидролиз, опосредованный экзонуклеазой (3'- и 5') |
| Период полувыведения | 135–177 дней (в ликворе ), 63–87 дней (в плазме ) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| Химические и физические данные | |
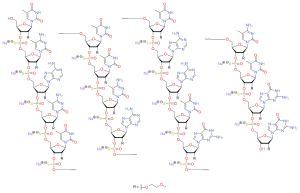
| Формула | С 234 Н 323 Н 61 На 17 О 128 П 17 С 17 [4] |
| Молярная масса | 7 500 .86 g·mol −1 |
нырнуть в [7] продается как Спинраза , [4] — препарат, используемый для лечения спинальной мышечной атрофии (СМА), редкого нервно-мышечного заболевания . [8] [4] В декабре 2016 года он стал первым одобренным препаратом, используемым для лечения этого расстройства.
Поскольку заболевание, которое он лечит, встречается очень редко, Нусинерсен имеет так называемого « орфанного препарата ». в США и Европейском Союзе статус [9]
Медицинское использование
[ редактировать ]Препарат используется для лечения спинальной мышечной атрофии, связанной с мутацией гена SMN1 . Его вводят непосредственно в центральную нервную систему (ЦНС) путем интратекальной инъекции. [4]
В клинических испытаниях препарат остановил прогрессирование заболевания. Примерно у 60% детей, страдающих спинальной мышечной атрофией 1 типа, он улучшает двигательные функции. [4]
Побочные эффекты
[ редактировать ]У людей, принимавших нузинерсен, был повышен риск инфекций верхних и нижних дыхательных путей, заложенности носа, ушных инфекций, запоров, легочной аспирации , прорезывания зубов и сколиоза . Существует риск задержки роста младенцев и детей . У пожилых участников клинических исследований наиболее частыми нежелательными явлениями были головная боль, боль в спине и другие побочные эффекты спинальной инъекции , такие как постпункционная головная боль . [4]
Хотя это и не наблюдалось у пациентов, принимавших участие в исследовании, снижение количества тромбоцитов , а также риск повреждения почек являются теоретическими рисками для антисмысловых препаратов, и поэтому во время лечения следует контролировать функцию тромбоцитов и почек. [4]
В 2018 г. было зарегистрировано несколько случаев сообщающейся гидроцефалии у детей и взрослых, получавших нусинерсен; остается неясным, было ли это связано с наркотиками. [10]
Фармакология
[ редактировать ]Спинальная мышечная атрофия вызвана мутациями потери функции в гене SMN1 , который кодирует белок выживаемости мотонейронов (SMN) . Люди выживают благодаря небольшому количеству белка SMN, вырабатываемого геном SMN2 . Нусинерсен модулирует альтернативный сплайсинг гена SMN2 , функционально превращая его в ген SMN1 , тем самым повышая уровень белка SMN в ЦНС. [11]
Препарат распределяется в ЦНС и периферических тканях. [4]
Период полувыведения оценивается в 135–177 дней в спинномозговой жидкости (СМЖ) и в 63–87 дней в плазме крови . Препарат метаболизируется посредством гидролиза, опосредованного экзонуклеазой (3'- и 5'), и не взаимодействует с CYP450 . ферментами [4] Основным путем выведения нусинерсена и его метаболитов, вероятно, является выведение с мочой. [4]
Химия
[ редактировать ]Нусинерсен представляет собой антисмысловой олигонуклеотид , в котором 2'-гидроксигруппы рибофуранозильных колец заменены на 2'- О -2-метоксиэтильные группы, а фосфатные связи заменены фосфоротиоатными связями. [4] [11] [12]
История
[ редактировать ]Нусинерсен был разработан в сотрудничестве Адриана Крайнера из лаборатории Колд-Спринг-Харбор и компании Ionis Pharmaceuticals (ранее называвшейся Isis Pharmaceuticals). [13] [14] [15] [16] Первоначальная работа по целевому обнаружению нусинерсена была проведена Равиндрой Н. Сингхом и его коллегами из Медицинской школы Массачусетского университета при финансовой поддержке Cure SMA. [17] [18]
Начиная с 2012 года Ionis сотрудничала с Biogen в разработке, а в 2015 году Biogen приобрела эксклюзивную лицензию на препарат за лицензионный сбор в размере 75 миллионов долларов США , поэтапные выплаты до 150 миллионов долларов США и последующие поэтапные роялти; Biogen также оплатила затраты на разработку после получения лицензии. [19] Лицензия на Biogen включала лицензии на интеллектуальную собственность, которую Ionis приобрела у лаборатории Колд-Спринг-Харбор и Массачусетского университета. [20]
В ноябре 2016 года заявка на новый препарат была принята в рамках с FDA процесса приоритетной проверки учетом результатов исследования фазы III и неудовлетворенных потребностей, а также была принята на рассмотрение в Европейском агентстве по лекарственным средствам (EMA). на тот момент [21] [22] Он был одобрен FDA в декабре 2016 года и EMA в мае 2017 года как первый препарат для лечения СМА. [23] [24] Впоследствии нусинерсен был одобрен для лечения СМА в Канаде (июль 2017 г.). [25] Япония (июль 2017 г.), [26] Бразилия (август 2017 г.), [27] Швейцария (сентябрь 2017 г.), [28] и Китай (февраль 2019 г.). [29]
В 2023 году дополнительные клинические исследования продолжили подтверждение эффективности нузинерсена, особенно подчеркивая преимущества раннего вмешательства. Испытания продемонстрировали значительные улучшения двигательных функций и показателей выживаемости среди младенцев со СМА 1 типа, подчеркивая важность своевременного лечения для достижения оптимальных клинических результатов. [30]
Общество и культура
[ редактировать ]Экономика
[ редактировать ]Нусинерсена Прейскурантная цена в США составляет 125 000 долларов США за инъекцию, что соответствует стоимости лечения в 750 000 долларов США в первый год и 375 000 долларов США в год после этого. [31] По данным The New York Times , это ставит нусинерсен «в число самых дорогих лекарств в мире». [22]
В октябре 2017 года власти Дании рекомендовали нусинерсен использовать только небольшой группе людей со СМА 1 типа (младенцы) и отказались предлагать его в качестве стандартного лечения для всех остальных людей со СМА, сославшись на «необоснованно высокую цену» по сравнению с в пользу. [32]
Норвежские власти отклонили финансирование в октябре 2017 года, поскольку цена лекарства была «неэтично высокой». [33] В феврале 2018 года финансирование было одобрено для лиц до 18 лет. [33] В апреле 2023 года финансирование было расширено и теперь включает взрослых. [34]
В августе 2018 года Национальный институт здравоохранения и совершенствования медицинской помощи (NICE), который оценивает экономическую эффективность лечения для Национальной службы здравоохранения Англии и Уэльса, рекомендовал не предлагать нусинерсен людям со СМА. [35] Дети со СМА типа 1 проходили лечение в Великобритании в рамках программы расширенного доступа , финансируемой Biogen ; после зачисления 80 детей в ноябре 2018 года программа закрылась для новых людей. [36] Однако в мае 2019 года NICE изменила свою позицию и объявила о своем решении рекомендовать нусинерсен для использования при широком спектре СМА в течение 5 лет. [37] [38]
Ирландии В феврале 2019 года руководитель службы здравоохранения решил, что нусинерсен слишком дорог для финансирования, заявив, что затраты составят около 600 000 евро на одного пациента в первый год и около 380 000 евро в последующий год, «при этом предполагаемые последствия для бюджета превысят 20 миллионов евро». в течение пяти лет» для 25 детей со СМА, живущих в Ирландии. И производитель, и группы пациентов оспорили эти цифры и указали, что фактические цены в Ирландии соответствуют договорной цене по инициативе Бенилюкса , членом которой Ирландия является с июня 2018 года. [39]
По состоянию на май 2019 года нусинерсен был доступен в системе общественного здравоохранения более чем в 40 странах. [40]
В декабре 2021 года нусинерсен был включен в расширенное страховое покрытие Китая, и цена была снижена с 697 000 иен за флакон до примерно 33 000 иен (~ 5100 долларов США) за флакон. [41] [42] [43]
Ссылки
[ редактировать ]- ^ «Лекарства, отпускаемые по рецепту: регистрация новых химических веществ в Австралии, 2017» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 9 апреля 2023 г.
- ^ «Лекарственные средства, отпускаемые по рецепту, и биологические препараты: годовой обзор TGA за 2017 год» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 31 марта 2024 г.
- ^ «Генетические нарушения» . Здоровье Канады . 9 мая 2018 года . Проверено 13 апреля 2024 г.
- ^ Jump up to: а б с д и ж г час я дж к л «Спинраза-нусинерсен для инъекций, раствор» . ДейлиМед . 30 июня 2020 г. Проверено 3 ноября 2020 г. .
- ^ «Спинраза ЭПАР» . Европейское агентство по лекарственным средствам . 2 апреля 2012 года . Проверено 29 июня 2024 г.
- ^ Патон Д (2017). «Нусинерсен: антисмысловой олигонуклеотид для увеличения выработки белка SMN при спинальной мышечной атрофии». Наркотики сегодня . 53 (6). Clarivate Analytics (США): 327–337. дои : 10.1358/точка.2017.53.6.2652413 . ISSN 1699-3993 . ПМИД 28799578 .
- ^ Jump up to: а б «Международные непатентованные наименования фармацевтических веществ (МНН). Рекомендуемые международные непатентованные наименования: Список 74» (PDF) . Всемирная организация здравоохранения. стр. 413–414 . Проверено 13 марта 2017 г.
- ^ Оттесен EW (январь 2017 г.). «ISS-N1 — первое одобренное FDA лекарство от спинальной мышечной атрофии» . Трансляционная нейронаука . 8 (1): 1–6. doi : 10.1515/tnsci-2017-0001 . ПМЦ 5382937 . ПМИД 28400976 .
- ^ «Нусинерсен» . Специализированная фармацевтическая служба Великобритании. 28 января 2016 г. Архивировано из оригинала 13 апреля 2019 г. . Проверено 31 декабря 2016 г.
- ^ «Новое предупреждение о сообщающейся гидроцефалии, связанной с нусинерсеном». Реакции еженедельно . 1714 (1): 3. 1 августа 2018 г. doi : 10.1007/s40278-018-50183-2 . ISSN 1179-2051 . S2CID 195086499 .
- ^ Jump up to: а б Занетта С., Ниццардо М., Симона С., Монгуцци Е., Бресолин Н., Коми ГП и др. (январь 2014 г.). «Стратегии молекулярной терапии спинальной мышечной атрофии: текущие и будущие клинические исследования» . Клиническая терапия . 36 (1): 128–40. doi : 10.1016/j.clinthera.2013.11.006 . ПМИД 24360800 .
- ^ Пао П.В., Ви КБ, Йи У.К., Прамоно З.А., Двипрамоно З.А. (апрель 2014 г.). «Двойная маскировка специфических негативных регуляторных элементов сплайсинга привела к максимальному включению экзона 7 гена SMN2» . Молекулярная терапия . 22 (4): 854–61. дои : 10.1038/mt.2013.276 . ПМЦ 3982506 . ПМИД 24317636 . Последовательность нусинерсена (UCACUUUCAUAAUGCUGG) указана как N1-Hua в Таблице I.
- ^ Гарбер К. (октябрь 2016 г.). «Большая победа возможна для антисмыслового препарата Ionis / Biogen при мышечной атрофии». Природная биотехнология . 34 (10): 1002–1003. дои : 10.1038/nbt1016-1002 . ПМИД 27727217 . S2CID 37479367 .
- ^ Вадман М. (23 декабря 2016 г.). «Обновлено: FDA одобрило препарат, который спасает детей со смертельным нейродегенеративным заболеванием» . Наука . дои : 10.1126/science.aal0476 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Оффорд С (1 декабря 2016 г.). «Олигонуклеотидная терапия близка к одобрению» . Ученый .
{{cite news}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Тарр П. (24 декабря 2016 г.). «Одобрение FDA CSHL спасительного препарата для лечения СМА приветствуется его исследователем-изобретателем в CSHL» . Лаборатория Колд-Спринг-Харбор . Архивировано из оригинала 1 января 2017 года . Проверено 1 января 2017 г.
{{cite news}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ «Терапевтические подходы» . www.curesma.org . Вылечить СМА. Архивировано из оригинала 1 января 2017 года . Проверено 1 января 2017 г.
- ^ Сингх Н.Н., Хауэлл, доктор медицинских наук, Андрофи Э.Дж., Сингх Р.Н. (2019). «Как открытие МКС-N1 привело к первому медикаментозному лечению спинальной мышечной атрофии» . Генная терапия . 24 (9): 520–526. дои : 10.1038/gt.2017.34 . ПМЦ 5623086 . ПМИД 28485722 .
- ^ «Biogen выделяет 75 миллионов долларов на разработку Нусинерсена Ionis после положительных результатов фазы III» , Новости генной инженерии , 1 августа 2016 г.
- ^ «Пресс-релиз: Отчет компаний Biogen и Ionis Pharmaceuticals, Нусинерсен соответствует основной конечной точке при промежуточном анализе фазы 3 исследования ENDEAR при спинальной мышечной атрофии с началом у детей | Biogen Media» . Биоген . 1 августа 2016 года. Архивировано из оригинала 10 августа 2017 года . Проверено 1 января 2017 г.
- ^ «Нормативные заявки на терапию СМА Nusinersen приняты в США и ЕС» . БиоНьюс Сервисез, ООО. Ноябрь 2016 года . Проверено 15 ноября 2016 г.
- ^ Jump up to: а б Томас К. (30 декабря 2016 г.). «Дорогое лекарство от смертельного заболевания мышц получило одобрение FDA» . Нью-Йорк Таймс .
{{cite news}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Грант C (27 декабря 2016 г.). «Неожиданное одобрение препарата — праздничный подарок для Biogen» . Уолл Стрит Джорнал . ISSN 0099-9660 . Проверено 27 декабря 2016 г.
{{cite web}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ «Спинраза (нусинерсен)» . Европейское агентство по лекарственным средствам . Архивировано из оригинала 28 октября 2017 года . Проверено 27 октября 2017 г.
- ^ «Спинраза™ (нусинерсен) компании Biogen получает уведомление о соответствии требованиям Министерства здравоохранения Канады для лечения спинальной мышечной атрофии 5q (СМА)» . Цион . 4 июля 2017 года. Архивировано из оригинала 4 декабря 2017 года . Проверено 13 октября 2017 г.
- ^ «Biogen скоро запустит Спинразу в Японии» . 10 июля 2017 г.
- ^ «Выпущено новое лекарство от спинальной мышечной атрофии» (на бразильском португальском языке). 25 августа 2017 г.
- ^ «Спинраза – одобрение теперь и в Швейцарии» (на швейцарском верхненемецком языке). СМА Швейцария. 30 сентября 2017 г.
- ^ «Biogen продолжает расширять присутствие в Китае с одобрением SPINRAZA® (нусинерсен), первого и единственного средства лечения спинальной мышечной атрофии | Biogen» . инвесторы.biogen.com . Проверено 10 января 2022 г.
- ^ «Нусинерсен (Спинраза®) – спинальная мышечная атрофия (СМА) | Национальный институт неврологических расстройств и инсульта» . www.ninds.nih.gov . Проверено 3 июня 2024 г.
- ^ «Цены, купоны и программы помощи пациентам на Спинразу» . Наркотики.com . Проверено 10 сентября 2021 г.
- ^ Медицинский совет говорит нет лекарствам для детей с мышечной дистрофией: «неоправданно» дорого. Проверено 13 октября 2017 г.
- ^ Jump up to: а б Это непонятно и невероятно несправедливо ( гугл переводчик)
- ^ Омланд E (11 апреля 2023 г.). «Форум по принятию решений сказал «да» Спинразе в связи с мышечными заболеваниями на дополнительном заседании» . НРК (по-норвежски нюнорск) . Проверено 14 апреля 2023 г.
- ^ «Дорогой препарат для мышц Спинраза от Biogen слишком дорог для Британии» . Рейтер . 13 августа 2018 года . Проверено 28 мая 2019 г.
- ^ «Заявление Biogen о программе расширенного доступа» . Мышечная дистрофия Великобритании. 2 декабря 2018 г. Архивировано из оригинала 28 февраля 2019 г. Проверено 27 февраля 2019 г.
- ^ «NICE рекомендует впервые начать лечение детей с редким заболеванием, связанным с атрофией мышц» . Национальный институт здравоохранения и передового опыта. 15 мая 2019 года. Архивировано из оригинала 28 мая 2019 года . Проверено 28 мая 2019 г.
- ^ Нусинерсен для лечения спинальной мышечной атрофии. Руководство по оценке технологий NICE [TA588] 2019 г.
- ^ «Производитель лекарств призывает Вышку пересмотреть цены на лечение заболеваний, связанных с атрофией мышц» . Ирландские Таймс. 25 февраля 2019 года . Проверено 27 февраля 2019 г.
- ^ «Доступ к Спинразе по странам» . Лечите СМА . 18 октября 2018 года . Проверено 28 мая 2019 г.
- ^ «Спинраза от Biogen, Yescarta от Fosun Kite и спорный препарат от болезни Альцгеймера: все, что вам нужно знать о новом государственном освещении в Китае» . ФиерсФарма . 3 декабря 2021 г. Проверено 27 января 2022 г.
- ^ «Китайский листинг NDRL в 2021 году предполагает снижение цен до 95%» . www.thepharmaletter.com . Проверено 27 января 2022 г.
- ^ 陈子琰. «Китай повышает доступность лечения редких заболеваний» . www.chinadaily.com.cn . Проверено 27 января 2022 г.
Дальнейшее чтение
[ редактировать ]- Финкель Р.С., Чирибога К.А., Вайсар Дж., Дэй Дж.В., Монтес Дж., Де Виво Д.С. и др. (декабрь 2016 г.). «Лечение спинальной мышечной атрофии с инфантильным началом нузинерсеном: открытое исследование фазы 2 с увеличением дозы». Ланцет . 388 (10063): 3017–3026. дои : 10.1016/S0140-6736(16)31408-8 . ПМИД 27939059 . S2CID 40696239 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка )