Номенклатура неорганической химии ИЮПАК 2005 г.
Номенклатура неорганической химии, Рекомендации ИЮПАК 2005 года — это версия Номенклатуры неорганической химии 2005 года (которая неофициально называется Красной книгой ). Это сборник правил наименования неорганических соединений, рекомендованных Международным союзом теоретической и прикладной химии (IUPAC).
Краткое содержание
[ редактировать ]Издание 2005 года заменяет их предыдущие рекомендации: Номенклатуру Красной книги неорганической химии, Рекомендации ИЮПАК 1990 года (Красная книга I) и «где это уместно» (так в оригинале) Номенклатуру неорганической химии II, Рекомендации ИЮПАК 2000 года (Красная книга II) .
Рекомендации занимают более 300 страниц. [ 1 ] а полный текст можно скачать на сайте IUPAC. [ 2 ] Исправления вынесены. [ 3 ]
Помимо реорганизации содержания, появился новый раздел, посвященный металлоорганическим соединениям, и формальный список элементов, который будет использоваться вместо списков электроотрицательности при упорядочении элементов в формулах и названиях. Концепция предпочтительного названия ИЮПАК (ПИН), являющаяся частью пересмотренной синей книги по наименованию органических соединений, еще не принята для неорганических соединений. Однако существуют рекомендации относительно того, какой метод именования следует использовать.
Методы именования
[ редактировать ]В рекомендациях описывается ряд различных способов обозначения соединений. Это:
- композиционное наименование (например, хлорид натрия)
- заместительное наименование на основе исходных гидридов (GeCl 2 Me 2 дихлордиметилгерман)
- название добавки ([MnFO 3 ] фторидотриоксидомарганец)
Кроме того, имеются рекомендации по следующим вопросам:
- наименование кластерных соединений
- разрешенные названия неорганических кислот и производных
- наименование твердых фаз, например, нестехиометрических фаз
Для простого соединения, такого как AlCl 3 , различные соглашения об именах дают следующее:
- по составу : трихлорид алюминия ( стехиометрически ) или гексахлорид диалюминия ( димер ).
- заместитель : трихлоралюман
- добавка : трихлоралюминий; гексахлородиалюминий (димер без структурной информации); ди-мк-хлорид-тетрахлоро-1κ 2 Cl , 2κ 2 Cl -диалюминий (димер со структурной информацией)
Элементы секвенирования - список «электротрицательностей».
[ редактировать ]Во всех рекомендациях использование электроотрицательности элементов для секвенирования было заменено формальным списком, который в общих чертах основан на электроотрицательности. В рекомендациях по-прежнему используются термины электроположительный и электроотрицательный для обозначения относительного положения элемента в этом списке.
Простое практическое правило игнорирования лантаноидов и актинидов таково:
- для двух элементов в разных группах - тогда элемент в группе с более высоким номером имеет более высокую «электроотрицательность».
- для двух элементов одной группы элемент с меньшим атомным номером имеет более высокую «электроотрицательность».
- Водород менее электроотрицательен, чем любой халькоген, и более электроотрицательен, чем любой пниктоген. Следовательно, формулы воды и аммиака можно записать H 2 O и NH 3 соответственно.
Полный список, от самой высокой до самой низкой «электроотрицательности» (с добавлением элементов со 112 по 118, которые еще не были названы в 2005 году, к соответствующим группам):
- Группа 17 в последовательности атомных номеров, т.е. F – T, за которыми следуют
- Группа 16 в последовательности атомных номеров, т. е. O – Lv, за которой следует
- H, водород , за которым следует
- Группа 15 в последовательности атомных номеров, т. е. N – Mc, за которой следует
- Группа 14 в последовательности атомных номеров, т. е. C – Fl, за которой следует
- Группа 13 в последовательности атомных номеров, т. е. B – Nh , за которой следует
- Группа 12 в последовательности атомных номеров, т.е. Zn – Cn, за которой следует
- Группа 11 в последовательности атомных номеров, т. е. Cu – Rg, за которой следует
- Группа 10 в последовательности атомных номеров, т.е. Ni–D, за которыми следует
- Группа 9 в последовательности атомных номеров, т. е. Co – Mt , за которой следует
- Группа 8 в последовательности атомных номеров, т. е. Fe – Hs, за которой следует
- Группа 7 в последовательности атомных номеров, т. е. Mn – Bh, за которой следует
- Группа 6 в последовательности атомных номеров, т. е. Cr – Sg, за которой следует
- Группа 5 в последовательности атомных номеров, т. е. V – Db, за которой следует
- Группа 4 в последовательности атомных номеров, т. е. Ti – Rf, за которой следует
- Группа 3 в последовательности атомных номеров, т. е. Sc – Y , за которой следует
- лантаноиды за в последовательности атомных номеров, т. е. La – Lu, которой следует
- актиноиды за в последовательности атомных номеров, т. е. Ac – Lr, которой следует
- Группа 2 в последовательности атомных номеров, т.е. Be-Ra, за которой следует
- Группа 1 (исключая H) в последовательности атомных номеров, т. е. Li – Fr, за которой следует
- Группа 18 в последовательности атомных номеров, т. е. He – Og.
Определение номенклатуры для использования
[ редактировать ]| Действие | Добавление сложный? |
Определенный стехиометрия? |
одноатомный ? | молекулярный ? | металл присутствует? | Связь с углеродом ? | переходный металл группа 3–12? |
основная группа метал группы 1, 2, 3–6? |
|---|---|---|---|---|---|---|---|---|
| Обрабатывать каждый компонент отдельно использовать композиционный |
Да | |||||||
| Используйте твердых тел именование | Нет | Нет | ||||||
| Наименование элемента или одноатомного катиона/аниона/радикала | Нет | Да | Да | |||||
| Разделите компоненты на «электроположительные» и «электроотрицательные». Обрабатывать каждый компонент отдельно Используйте обобщенное стехиометрическое именование. |
Нет | Да | Нет | Нет | ||||
| Используйте синюю книгу ( Органическое соединение ) |
Нет | Да | Нет | Да | Нет | Да | ||
| Используйте аддитивные имена для группа 3- 12 металлоорганики |
Нет | Да | Нет | Да | Да | Да | Да | |
| Используйте замещающее наименование для металлоорганические соединения группы 3–6 Используйте композиционные для групп 1–2 металлоорганических соединений |
Нет | Да | Нет | Да | Да | Да | Нет | Да |
| Используйте аддитивные названия для координационных комплексов. | Нет | Да | Нет | Да | Да | Нет | Да | |
| Выберите заместитель или добавку. | Нет | Да | Нет | Да | Нет | Нет |
Примечание. «Рассматривать отдельно» означает использование таблицы решений для каждого компонента.
Имена элементов
[ редактировать ]Образец неопределенной структуры
[ редактировать ]Неопределенный образец просто берет имя элемента. Например, образец углерода (который может быть алмазом, графитом и т. д. или их смесью) будет называться углеродом.
Специфический аллотроп
[ редактировать ]Молекулярный
[ редактировать ]- O 2 дикислород (приемлемое название кислород)
- O 3 трикислород (приемлемое название озон)
- P 4 тетрафосфор (приемлемое название белый фосфор)
- S 6 гексасера (приемлемое название ε-сера)
- S 8 циклооктасера (приемлемые названия полиморфных форм - α-сера, β-сера, γ-сера)
Кристаллическая форма
[ редактировать ]Это указывается символом элемента, за которым следует символ Пирсона для кристаллической формы. (Обратите внимание, что в рекомендациях второй символ выделен курсивом.)
- C n углерод (c F 8) (приемлемое название алмаз)
- Sn n олово(t I 4) (приемлемое название β- или белое олово)
- Mn n марганец(c I 58) (приемлемое название α-марганец)
Аморфные признанные аллотропы
[ редактировать ]Примеры включают в себя П н ,. красный фосфор; В качестве n аморфный мышьяк.
Соединения
[ редактировать ]Композиционные названия несут мало структурной информации и рекомендуются к использованию, когда структурная информация недоступна или не требует передачи. Стехиометрические названия самые простые и отражают либо эмпирическую формулу, либо молекулярную формулу. Порядок элементов соответствует формальному списку электроотрицательности для бинарных соединений и списку электроотрицательности, в котором элементы группируются в два класса, которые затем располагаются в алфавитном порядке. Пропорции указываются ди-, три- и т. д. (См. числовой множитель ИЮПАК .) Если известно, что существуют комплексные катионы или анионы, они называются самостоятельно, а затем эти названия используются как часть названия соединения.
Бинарные соединения
[ редактировать ]В бинарных соединениях первым в формуле стоит более электроположительный элемент. Используется формальный список. Название наиболее электроотрицательного элемента изменено и теперь заканчивается на -ide, а название более электроположительного элемента остается неизменным.
Возьмем бинарное соединение натрия и хлора: хлор находится первым в списке, поэтому в названии идет последним. Другими примерами являются
- PCl 5 Пентахлорид фосфора
- Ca 2 P 3 дикальцийтрифосфид
- станнид никеля NiSn
- Cr 23 C 6 гексакарбид трикосахрома
Тройные соединения и не только
[ редактировать ]Нижеследующее иллюстрирует принципы.
Четвертичное соединение брома, хлора, йода и фосфора в соотношении 1:1:1:1:
- PBrClI бромид фосфора хлорид йодид (фосфор является наиболее электроположительным, все остальные обозначены как электроотрицательные и расположены в алфавитном порядке)
Тройное соединение сурьмы, меди и калия в соотношении 2:1:5 можно назвать двумя способами в зависимости от того, какой элемент (ы) обозначен как электроотрицательный.
- CuK 5 Sb 2 диантимонид пентакалия меди (и медь, и калий обозначены как электроположительные и расположены в алфавитном порядке)
- K 5 CuSb 2 куприд пентакалия диантимонид (только калий обозначен как электроположительный, а два электроотрицательных элемента расположены в алфавитном порядке) (Обратите внимание, что в красной книге этот пример показан неправильно)
Названия ионов и радикалов
[ редактировать ]Катионы
[ редактировать ]Одноатомные катионы называются путем названия элемента и последующего заряда в скобках, например
- Уже +
натрий(1+) - Кр 3+
хром(3+)
Иногда необходимо использовать сокращенную форму названия элемента, например, гермид вместо германия, поскольку германид относится к GeH. −
3 .
Многоатомные катионы одного и того же элемента называются по названию элемента, которому предшествуют ди-, три- и т. д. , например:
- ртуть 2+
2 димеркурия(2+)
Многоатомные катионы, состоящие из разных элементов, называются замещающе или аддитивно, например:
- PH +
4 фосфаний - СбФ +
4 тетрафторстибаний (заместитель) или тетрафторосурьма(1+) - Обратите внимание, что аммоний и оксоний являются приемлемыми названиями для NH. +
4 и Н
33О +
соответственно. (Гидроний не является приемлемым названием для H
33О +
[ нужна ссылка ] )
Анионы
[ редактировать ]Одноатомные анионы называются как элемент, модифицированный окончанием -ide. Плата указывается в скобках (необязательно для 1-), например:
- кл. − хлорид (1-) или хлорид
- С 2− сульфид(2-)
Некоторые элементы имеют в качестве корня свое латинское название, например
- серебро, Ag, аргентид
- медь, Cu, куприд
- железо, Fe, феррид
- олово, Sn, станнид
Многоатомные анионы одного и того же элемента называются по названию элемента, которому предшествуют ди-, три- и т. д. , например:
- О 2 2− диоксид(2-) (или пероксид как приемлемое название)
- С 2 2− дикарбид(2-) (или ацетилид как приемлемое название)
- SS2 2− дисульфид (2-)
или иногда в качестве альтернативы, полученной из замещающего имени, например
- SS2 2− дисульфанид
Многоатомные анионы, состоящие из разных элементов, называются либо замещающе, либо аддитивно, окончания названий -ide и -ate соответственно, например:
- ГэХ 3 − германид (заместитель) или тригидридогерманат (1-) (добавка)
- ТЭН 3 − заместитель теллануида, где -uide указывает анион, состоящий из дополнительного гидрида, присоединенного к исходному гидриду
- [ПФ 6 ] − гексафтор-λ 5 -фосфаноид (заместитель) или гексафторофосфат (1-) (добавка)
- SOSO3 2− триоксидосульфат (2-) (добавка) или сульфит (приемлемое несистематическое название)
Полный список альтернативных допустимых несистематических названий катионов и анионов приведен в рекомендациях. Многие анионы имеют названия, полученные от неорганических кислот, и о них речь пойдет позже.
Радикалы
[ редактировать ]Наличие неспаренных электронов может обозначаться знаком « · ». Например:
- Он · + гелий( · +)
- № 2 (2 · )2+ диазот(2 · 2+)
Наименование гидратов и подобных им решеточных соединений.
[ редактировать ]Использование термина «гидрат» по-прежнему приемлемо, например, Na 2 SO 4 ·10H 2 O, декагидрат сульфата натрия. Рекомендуемый метод — назвать его сульфатом натрия — вода (1/10). Аналогичным образом, другими примерами решетчатых соединений являются:
- CaCl 2 ·8NH 3 , хлорид кальция — аммиак (1/8)
- 2Na 2 CO 3 ·3H 2 O 2 , карбонат натрия – перекись водорода (2/3)
- AlCl 3 ·4EtOH, хлорид алюминия—этанол (1/4)
Определение пропорций с использованием заряда или степени окисления
[ редактировать ]В качестве альтернативы префиксам ди- и три- можно использовать либо заряд, либо степень окисления. Рекомендуется зарядить, поскольку степень окисления может быть неоднозначной и открытой для дискуссий.
Замещающая номенклатура
[ редактировать ]Этот метод наименования обычно соответствует установленной органической номенклатуре ИЮПАК. Гидридам элементов основной группы (группы 13–17) присвоены названия -ановых оснований, например боран, BH 3 . Приемлемые альтернативные названия для некоторых исходных гидридов — вода, а не оксидан, и аммиак, а не азан. В этих случаях основное название предназначено для использования для замещенных производных.
В этом разделе рекомендаций рассмотрены названия соединений, содержащих кольца и цепи.
Базовые гидриды
[ редактировать ]| Бюстгальтер 3 | боран | СН 4 | метан | НХ 3 | приходить ( аммиак ) |
Н 2 О | оксидан ( вода ) |
ВЧ | фторан ( фтористый водород ) |
| AlHAlH3 | алюман | SiHСиХ4 | силан | РН 3 | фосфан ( фосфин ) |
Ч 2 С | сульфан ( сероводород или дигидросульфид) |
HCl | хлоран ( хлорид водорода ) |
| ГаХ 3 | галлан | ГэХ 4 | уместный | AsHAsH3 | Арсен ( арсин ) |
Н 2 См. | селен ( селенид водорода или дигидроселенид) |
ХБр | броман ( бромистый водород ) |
| ИнХ 3 | индигановый | СнХ 4 | оставаться | СбХ 3 | стибан ( наука ) |
Н 2 Те | теллейн ( теллурид водорода или теллурид дигидрогена) |
ПРИВЕТ | йодан ( йодистый водород ) |
| ТлХ 3 | Таллан | ПбХ 4 | отвесить | БиГ 3 | висмутан ( висмутин ) |
Н 2 По | очищен ( полонид водорода или дигидрополонид) |
Имеет | астат ( астатид водорода ) |
Гидриды с нестандартной связью — лямбда-условие.
[ редактировать ]Если соединение имеет нестандартную связь по сравнению с исходным гидридом, например PCl 5, используется лямбда-условие. Например:
- PCl 5 пентахлор-λ 5 -фосфан
- SF 6 гексафтор-λ 6 -сульфан
Полиядерные гидриды
[ редактировать ]приставка ди-, три- и т.д. К названию родительского гидрида добавляется Примеры:
- HOOH, диоксидан (перекись водорода – приемлемое название)
- H 2 PPH 2 , дифосфан
- H 3 SiSiH 2 SiH 2 SiH 3 , тетрасилан
Кольца и цепочки
[ редактировать ]В рекомендациях описаны три способа присвоения «родительских» названий гомоядерным моноциклическим гидридам (т.е. одиночным кольцам, состоящим из одного элемента):
- номенклатура Ханча – Видмана (метод, предпочтительный для колец размером 3–10)
- «номенклатура скелетных замен» — с указанием замены атомов углерода в соответствующем углеродном соединении атомами другого элемента (например, кремний становится силой, германием, германием) и мультипликативным префиксом три, тетра, пента и т. д.) (метод предпочтителен для колец большего размера) чем 10)
- путем добавления префикса цикло к названию соответствующей неразветвленной незамещенной цепи.
Гидриды бора
[ редактировать ]За стехиометрическим названием следует количество атомов водорода в скобках. Например, B 2 H 6 , диборан(6). Дополнительную структурную информацию можно передать, добавив к «структурному дескриптору» приставки клозо- , нидо- , арахно- , гифо- , кладо- .
Существует полностью систематический метод нумерации атомов в кластерах гидрида бора и метод описания положения мостиковых атомов водорода с помощью символа μ.
Основная группа металлоорганических соединений.
[ редактировать ]Использование замещающей номенклатуры рекомендуется для металлоорганических соединений групп 13–16 основной группы. Примеры:
- AlH 2 Me под названием метилалюман
- BiI 2 Ph назван дииод(фенил)висмутаном.
Для металлоорганических соединений 1–2 групп можно использовать аддитивные (с указанием молекулярного агрегата) или композиционные наименования. Примеры:
- [BeEtH] назван этилгидридобериллием или этанидогидридобериллием.
- [Mg(n 5 -C 5 H 5 ) 2 ] под названием bis(η 5 -циклопентадиенил)магний или бис(η 5 -циклопентадиенид)магний
- Na(CHCH 2 ) этенид натрия (композиционное название)
Однако в рекомендации отмечается, что будущие номенклатурные проекты будут рассматривать эти соединения.
Номенклатура добавок
[ редактировать ]Это наименование было разработано в основном для координационных соединений, хотя оно может применяться и более широко. Примеры:
- Si(OH) 4 тетрагидроксикремний (добавка) или силанететрол (заменитель) (обратите внимание, что кремниевая кислота является приемлемым названием - ортокремниевая опущена).
- [CoCl(NH 3 ) 5 ]Cl 2 хлорид пентаамминхлоридокобальта(2+)
Рекомендуемая процедура наименования моноядерных соединений
[ редактировать ]Рекомендации включают блок-схему, которую можно кратко резюмировать:
- определить центральный атом,
- идентифицировать и назвать лиганды,
- укажите способ координации лигандов, т.е. используя соглашения каппа и/или эта.
- секвенировать лиганды
- укажите координационную геометрию, т. е. символ многогранника, индекс конфигурации (с использованием правил CIP и абсолютной конфигурации для оптически активных соединений).
Названия лигандов
[ редактировать ]Анионные лиганды
[ редактировать ]Если имя аниона заканчивается на -ide, то его имя в качестве лиганда меняется на -o. Например, хлорид-анион Cl − становится хлоридом. В этом отличие от наименований органических соединений и наименований-заместителей, где хлор рассматривается как нейтральный и становится хлором, как в PCl 3 , который может быть назван либо замещающе, либо аддитивно, как трихлорфосфан или трихлорофосфор соответственно.
Аналогично, если названия анионов оканчиваются на -ite, -ate, то имена лигандов будут -ito, -ato.
Нейтральные лиганды
[ редактировать ]Нейтральные лиганды не меняют названия, за исключением следующих:
- Вода, «аква»
- Аммиак, «амины»
- Окись углерода, связанная через углерод, «карбонил».
- Оксид азота, связанный через азот, «нитрозил».
Примеры названий лигандов
[ редактировать ]| Формула | имя |
|---|---|
| кл. − | хлорида |
| Китай − | цианидо |
| ЧАС − | гидридо |
| Д − или 2 ЧАС − | дейтерид или [ 2 H] гидридо |
| PhCH 2 CH 2 Se − | 2-фенилэтан-1-селенолато |
| MeCOO − | ацетато или этаноато |
| Я 2 как − | диметиларсанид |
| МЕФ − | метилфосфанидо |
| МеКОНГ 2 | ацетамид (не ацетамидо) |
| МеКОНГ − | ацетилазанид или ацетиламидо (не ацетамидо) |
| МЕНХ 2 | метанамин |
| МЕНХ − | метилазанид, или метиламидо, или метанаминидо |
| МеФ 2 | метилфосфан |
| СО | карбонил |
Последовательность и положение лигандов и центральных атомов
[ редактировать ]Лиганды упорядочены по имени в алфавитном порядке и предшествуют названию центрального атома. Число координирующих лигандов обозначается приставками ди-, три-, тетра-пента- и т. д. для простых лигандов или бис-, трис-, тетракис- и т. д. для сложных лигандов. Например:
- [CoCl(NH 3 ) 5 ]Cl 2 хлорид пентаамминхлоридокобальта(3+), где аммин (NH 3 ) предшествует хлориду. Названия центрального атома идут после лигандов. Если имеется более одного центрального атома, ему предшествуют ди-три-, тетра- и т. д.
- Os 3 (CO) 12 , додекакарбонилтриосмий
Если есть разные центральные атомы, они упорядочены с использованием списка электроотрицательности.
- [ReCo(CO) 9 ] нонакарбонилрений-кобальт
Мостиковые лиганды - использование символа μ.
[ редактировать ]Лиганды могут соединять два или более центров. Префикс μ используется для указания мостикового лиганда как в формуле, так и в названии. Например, димерная форма трихлорида алюминия :
- Al 2 Cl 4 (μ-Cl) 2
- ди-мк-хлорид-тетрахлорид-1κ 2 Cl , 2κ 2 Cl -диалюминий
Этот пример иллюстрирует расположение мостиковых и немостиковых лигандов одного и того же типа. В формуле мостиковые лиганды следуют за немостиковыми лигандами, тогда как в названии мостиковые лиганды предшествуют немостиковым. Обратите внимание на использование каппа-соглашения, чтобы указать, что в каждом алюминии есть два концевых хлорида.
Индекс моста
[ редактировать ]Если имеется более двух центров, соединенных мостом, в качестве нижнего индекса добавляется индекс моста. Например, в основном ацетате бериллия , который можно представить как тетраэдрическое расположение атомов Be, связанных 6 ацетатными ионами, образующими каркас с центральным оксидным анионом, формула и название следующие:
- [Be 4 (μ 4 -O)(μ-O 2 CMe) 6 ]
- гексакис(μ-ацетат-κ O :κ O ′ )-μ 4 -оксидо- тетраэдро -тетрабериллий
μ 4 описывает мостиковое соединение центрального оксидного иона. (Обратите внимание на использование каппа-соглашения для описания образования мостиков ацетат-иона, в котором участвуют оба атома кислорода.) В названии, где лиганд участвует в различных способах образования мостиков, множественные мостиковые соединения перечислены в порядке убывания сложности, например μ 3 Перемычка перед перемычкой μ 2 .
Каппа, к, условность
[ редактировать ]Соглашение каппа используется для определения того, какие атомы лиганда связаны с центральным атомом, а в полиядерных соединениях какие атомы, как мостиковые, так и несвязанные, связаны с каким центральным атомом. Для монодентатных лигандов нет однозначности относительно того, какой атом образует связь с центральным атомом. Однако, когда лиганд имеет более одного атома, который может связываться с центральным атомом, используется соглашение каппа, чтобы указать, какие атомы в лиганде образуют связь. Атомный символ элемента выделен курсивом и ему предшествует каппа, κ. Эти символы размещаются после части названия лиганда, обозначающей кольцо, цепь и т. д., где расположен лиганд. Например:
- пентаамминнитрито-κ O -кобальт (III) указывает, что нитритный лиганд связывается через атом кислорода.
Если существует более одной связи, образованной из лиганда определенным элементом, числовой верхний индекс дает счет. Например:
- аква[(этан-1,2-диилдинитрило-κ 2 N , N ′ )трис(ацетат-κ O )ацетато]кобальтат(1-), анион кобальта, образованный водой и пентадентатной эдта , которая связывается через два атома азота и три атома кислорода. В edta есть две связи от атомов азота, которые обозначаются -κ. 2 Н , Н ' . Три связи кислорода обозначаются трис (ацетато-κ O ), где на ацетат приходится одна связка.
В полиядерных комплексах использование символа каппа расширяется двумя взаимосвязанными способами. Во-первых, чтобы указать, какие лигирующие атомы связываются с каким центральным атомом, и, во-вторых, для мостикового лиганда указать, какие центральные атомы участвуют. Центральные атомы необходимо идентифицировать, т.е. присвоив им номера. (Формально это предусмотрено в рекомендациях). Чтобы указать, какие лигирующие атомы в лиганде связаны с каким центральным атомом, номера центральных атомов предшествуют символу каппа, а числовой верхний индекс указывает количество лигаций, за которым следует атомный символ. Несколько вхождений разделяются запятыми.
Примеры:
- ди-мк-хлорид-тетрахлорид-1κ 2 Cl,2κ 2 Cl-диалюминий ( трихлорид алюминия ).
- тетрахлоро-1κ 2 Cl,2κ 2 Cl указывает, что на каждом атоме алюминия имеется два хлоридных лиганда.
- декакарбонил-1κ 3 С ,2к 3 С , 3 г 4 C -ди-мк-гидрид-1:2κ 2 Ч ;1:2κ 2 Н — треугольник —(3 Os — Os ), ( Декакарбонилдигидридотриосмий ).
- декакарбонил-1κ 3 С ,2к 3 С , 3 г 4 C показывает, что у двух атомов осмия имеются три карбонильные группы, а у третьего – четыре.
- ди-мк-гидридо-1:2κ 2 Ч ;1:2κ 2 H указывает на наличие двухгидридных мостиков между атомом осмия 1 и атомом осмия 2.
Эта, конвенция
[ редактировать ]Систематизировано использование η для обозначения тактильности. Использование η 1 не рекомендуется. Если спецификация задействованных атомов неоднозначна, необходимо указать положение атомов. Это иллюстрируется примерами:
- Cr(η 6 -C 6 H 6 ) 2 , называемый bis(η 6 -бензол)хром, поскольку задействованы все (соседние) атомы бензольных лигандов, их положение не обязательно указывать
- [(1,2,5,6-η)-циклоокта-1,3,5,7-тетраен](η 5 -циклопентадиенил)кобальта при этом только две (в положениях 1 и 5) из четырех двойных связей связаны с центральным атомом.
Координационная геометрия
[ редактировать ]Для любого координационного числа выше 2 возможно более одной координационной геометрии. Например, четырехкоординатные координационные соединения могут иметь форму тетраэдра, плоского квадрата, квадратной пирамиды или формы качелей. Символ многогранника используется для описания геометрии. Индекс конфигурации определяется по положению лигандов и вместе с символом многогранника ставится в начале названия. Например, в комплексе ( SP -4-3)-(ацетонитрил)дихлоро(пиридин)платина(II) ( SP -4-3) в начале названия описывает квадратную плоскую геометрию, координата 4 с индексом конфигурации из 3, что указывает на положение лигандов вокруг центрального атома. Подробнее см. символ многогранника .
Металлоорганические группы 3–12.
[ редактировать ]Номенклатура добавок обычно рекомендуется для металлоорганических соединений групп 3–12 (переходные металлы и цинк, кадмий и ртуть).
Металлоцены
[ редактировать ]Вслед за ферроценом — первым сэндвич-соединением с центральным атомом железа, координированным с двумя параллельными циклопентадиенильными кольцами, — широко используются названия соединений со схожей структурой, таких как осмоцен и ванадоцен. Рекомендация состоит в том, что океан, заканчивающийся в названии, должен быть ограничен соединениями, в которых есть дискретные молекулы бис (η 5 -циклопентадиенил)металл (и циклозамещенные аналоги), где циклопентадиенильные кольца по существу параллельны, а металл находится в d-блоке. Данная терминология НЕ применима к соединениям элементов s- или p-блока, таким как Ba(C 5 H 5 ) 2 или Sn(C 5 H 5 ) 2 .
Примерами соединений, соответствующих критериям, являются:
- ванадоцен , [V(η 5 -С 5 Н 5 ) 2 ]
- хромоцен , [Cr(η 5 -С 5 Н 5 ) 2 ]
- кобальтоцен , [Co(η 5 -С 5 Н 5 ) 2 ]
- родоцен , [Rh(η 5 -С 5 Н 5 ) 2 ]
- никельоцен , [Ni(η 5 -С 5 Н 5 ) 2 ]
- рутеноцен , [Ru(η 5 -С 5 Н 5 ) 2 ]
- осмоцен , [Os(η 5 -С 5 Н 5 ) 2 ]
- марганец , [Mn(η 5 -С 5 Н 5 ) 2 ]
- реноцен , [Re(η 5 -C 5 H 5 ) 2 ].
Примерами соединений, которые не следует называть металлоценами, являются:
- С 10 Н 10 Ти
- [Ti(η 5 -C 5 H 5 ) 2 Cl 2 ] правильно называется дихлордобис(η 5 -циклопентадиенил)титан НЕ дихлорид титаноцена
Полиядерные кластерные соединения
[ редактировать ]Металл-металлические облигации
[ редактировать ]В полиядерных соединениях со связями металл-металл они отображаются после названия элемента следующим образом: (3 Os — Os ) в декакарбонилдигидридотриосмии . Пара скобок содержит количество образовавшихся связей (если оно больше 1), за которым следуют выделенные курсивом атомные символы элементов, разделенные «длинным тире».
Геометрия полиядерного кластера
[ редактировать ]Геометрия полиядерных кластеров может различаться по сложности. Дескриптор, например тетраэдро, или дескриптор CEP, например Td -(13)-Δ. 4 - close ] можно использовать. это определяется сложностью кластера. Ниже приведены некоторые примеры дескрипторов и эквивалентов CEP. (Дескрипторы CEP названы в честь Кейси, Эванса и Пауэлла, описавших систему. [ 4 ]
| количество атомов | дескриптор | дескриптор CEP |
|---|---|---|
| 3 | треугольник | |
| 4 | рамка | |
| 4 | тетраэдр | [ Td -(13)-Δ 4 - близко ] |
| 5 | [ Д 3ч -(131)-Д 6 - близко ] | |
| 6 | октаэдр | [ О ч -(141)-D 8 - близко ] |
| 6 | трипризма | |
| 8 | антипризма | |
| 8 | додекаэдр | [ Д 2d -(2222)-Δ 6 - близко ] |
| 12 | икосаэдр | [ I h -(1551)-Δ 20 - близко ] |
Примеры:
декакарбонилдимарганец  бис(пентакарбонилмарганец)( Mn — Mn )
бис(пентакарбонилмарганец)( Mn — Mn )
додекакарбонилтетрародий 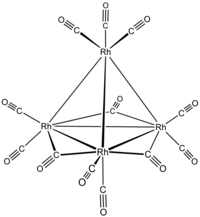 три-м-карбонил-1:2к 2 С 1:3 г. 2 С ;2:3к 2 С- нонакарбонил-
1к 2 С ,2к 2 С , 3 г 2 С , 4к 3 С -[ Т d -(13)-Δ 4 - клозо ]-тетрародий(6 Rh - Rh )
три-м-карбонил-1:2к 2 С 1:3 г. 2 С ;2:3к 2 С- нонакарбонил-
1к 2 С ,2к 2 С , 3 г 2 С , 4к 3 С -[ Т d -(13)-Δ 4 - клозо ]-тетрародий(6 Rh - Rh )
или три-м-карбонил-1:2к 2 С 1:3 г. 2 С ;2:3к 2 С- нонакарбонил-
1к 2 С ,2к 2 С , 3 г 2 С , 4к 3 С -тетраэдро-тетрародий(6 Rh - Rh )
Неорганические кислоты
[ редактировать ]Названия водорода
[ редактировать ]Рекомендации включают описание водородных названий кислот. Следующие примеры иллюстрируют этот метод:
- HNO 3 водород(нитрат)
- H 2 SO 4 дигидро(сульфат)
- HSO - 4 водород(сульфат) (2-)
- H 2 S диводород(сульфид)
Обратите внимание, что в отличие от композиционного метода наименования (сероводород), поскольку при наименовании водорода НЕТ пробела между электроположительными и электроотрицательными компонентами.
Этот метод не дает структурной информации о положении гидронов (атомов водорода). Если необходимо передать эту информацию, следует использовать название добавки (примеры см. в списке ниже).
Список допустимых имен
[ редактировать ]В рекомендациях приведен полный список допустимых названий обычных кислот и родственных им анионов. Выбор из этого списка показан ниже.
| приемлемое название кислоты | родственные анионы – приемлемые названия и аддитивные имена | ||
|---|---|---|---|
| борная кислота , [В(ОН) 3 ] | дигидрогенборат, [БО(ОН) 2 ] − дигидроксидооксидоборат(1-) |
гидроборат, [БО 2 (ОН)] 2 − гидроксидиоксидоборат(2-) |
борат, [БО 3 ] 3 − триоксидоборат(3-) |
| угольная кислота , [СО(ОН) 2 ] | гидрокарбонат, [СО 2 (ОН)] − гидроксидиоксидокарбонат(1-) |
карбонат, [СО 3 ] 2 − триоксидокарбонат(2-) |
|
| хлорная кислота , [ClO 2 (OH)] гидроксидиоксидохлор |
хлорат, [ClO 3 ] − триоксидохлорат(1-) |
||
| хлористая кислота , [ClO(OH)] гидроксидооксидохлорины |
хлорит, [ClO 2 ] − диоксидохлорат(1-) |
||
| азотная кислота , [НЕТ 2 (ОН)] гидроксидиоксид азота |
нитрат, [НЕТ − 3 ] триоксидонитрат (1-) |
||
| азотистая кислота , [НЕТ(ОН)] гидроксидооксид азота |
нитрит, [НЕТ 2 ] − диоксидонитрат (1-) |
||
| хлорная кислота , [ClO 3 (OH)] гидроксидотриоксидохлорины |
перхлорат, [ClO 4 ] − тетраоксидохлорат(1-) |
||
| фосфорная кислота , [PO(OH) 3 ] тригидроксидооксидофосфор |
дигидрофосфат, [РО 2 (ОН) 2 ] − дигидроксидиоксидофосфат(1-) |
гидрофосфат, [РО 3 (ОН)] 2 − гидроксидотриоксидофосфат (2-) |
фосфат, [ПО 4 ] 3 − тетраоксидофосфат(3-) |
| фосфоновая кислота , [ФО(ОН) 2 ] гидридодигидроксидооксидофосфор |
гидрофосфонат, [ФО 2 (ОН)] − гидридогидроксидиоксидофосфат(1-) |
фосфонат, [ФО 3 ] 2 − гидридотриоксидофосфат(2-) |
|
| фосфористая кислота, H3POH3PO3 тригидроксидофосфор |
дигидрофосфит [PO(OH) 2 ] − дигидроксиоксидофосфат(1-)) | гидрофосфит, [РО 2 (ОН)] 2 − гидроксидиоксидофосфат(2-) | фосфит, [ПО 3 ] 3 − триоксидофосфат(3-) |
| серная кислота, [SO2 ( OH) 2 ] дигидроксидиоксидосера |
гидросульфат, [SO3 ( ОН)] − гидроксидотриоксидосульфат (1-) |
сульфат, [ТАК 4 ] 2 − тетраоксидосульфат (2-) | |
Твердые вещества
[ редактировать ]Стехиометрические фазы получили названия по составу. Нестехиометрические фазы более сложны. По возможности следует использовать формулы, но при необходимости можно использовать следующие названия:
- сульфид железа(II) (дефицит железа)
- дикарбид молибдена (избыток углерода)
Названия минералов
[ редактировать ]Обычно названия минералов не следует использовать для указания химического состава. Однако название минерала можно использовать для указания типа структуры в формуле, например
- BaTiO 3 (типа перовскита)
Приблизительные формулы и переменный состав
[ редактировать ]Простые обозначения могут использоваться там, где мало информации о механизме изменчивости либо доступно, либо не требуется передавать:
- ~ FeS (примерно или приблизительно)
Если существует непрерывный диапазон состава, это можно записать, например: K(Br,Cl) для смеси КБр и КСl и (Li 2 ,Mg)Cl 2 для смеси LiCl и MgCl 2 . Рекомендуется использовать следующий обобщенный метод, например
- Cu x Ni 1−x для (С Ни)
- KBr x Cl 1−x для К(Бр,Cl)
Отметим, что катионные вакансии в CoO можно описать как СоО 1-х
Обозначение точечных дефектов (Крегера – Винка).
[ редактировать ]Точечные дефекты, симметрия и заселенность узлов могут быть описаны с использованием нотации Крегера-Винка , обратите внимание, что ИЮПАК предпочитает, чтобы вакансии определялись как V, а не V (элемент ванадий).
Номенклатура фаз
[ редактировать ]Чтобы указать кристаллическую форму соединения или элемента, символ Пирсона можно использовать . Использование Strukturbericht (например, A1 и т. д.) или греческих букв недопустимо. За символом Пирсона может следовать пространственная группа и формула-прототип. Примеры:
- углерод(c F 8 ) , алмаз
- РуАл (Ц П2 2, Пм3м)( CsCl ) тип
Полиморфизм
[ редактировать ]Рекомендуется идентифицировать полиморфы (например, ZnS , где они образуют цинковую обманку (кубическую) и вюрцит (шестиугольную)), как ZnS( c ) и ZnS( h ) соответственно.
Примечания и ссылки
[ редактировать ]- ^ Номенклатура неорганической химии, Рекомендации ИЮПАК, 2005 г., изд. Н.Г. Коннелли и др. Издательство RSC https://iupac.org/what-we-do/books/redbook/
- ^ Номенклатура неорганической химии, Рекомендации IUPAC 2005 г. - Полный текст (PDF)
- ^ Поправки к номенклатуре неорганической химии: Рекомендации IUPAC 2005 г.
- ^ «Система дескрипторов и принципы нумерации замкнутых многогранников бора, по крайней мере, с одной осью вращательной симметрии и одной плоскостью симметрии». Кейси Дж.Б., Эванс У.Дж., Пауэлл У.Х. Inorg. хим. , 20, 5, (1981), 1333–1341 два : 10.1021/ic50219a001
