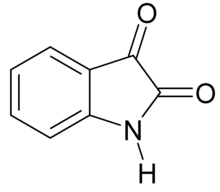
Исатин
| |

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
1 H -Индол-2,3-дион | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 383659 | |
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.001.889 |
| Номер ЕС |
|
| 165206 | |
| КЕГГ | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 8 Ч 5 НЕТ 2 | |
| Молярная масса | 147.1308 g/mol |
| Появление | Оранжево-красное твердое вещество |
| Температура плавления | 200 ° С (392 ° F; 473 К) |
| Опасности | |
| СГС Маркировка : | |

| |
| Предупреждение | |
| Х302 , Х315 , Х319 , Х335 | |
| P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P330 , P332+P313 , P337+P313 , П362 , П403+П233 , П405 , П501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Изатин , также известный как трибулин , представляет собой органическое соединение, полученное из индола с формулой C 8 H 5 NO 2 . Соединение было впервые получено Отто Линне Эрдманом. [ 1 ] и Огюст Лоран [ 2 ] как продукт окисления красителя индиго азотной в 1840 году и хромовой кислотами .
Изатин — хорошо известный природный продукт, который можно найти в растениях рода Isatis , Couroupita guianensis , Couroupita guianensis , [ 3 ] [ 4 ] а также у человека как метаболическое производное адреналина . [ 5 ]
Он выглядит как красно-оранжевый порошок и обычно используется в качестве строительного материала для синтеза широкого спектра биологически активных соединений, включая противоопухолевые препараты . [ 6 ] противовирусные препараты , [ 7 ] анти-ВИЧ, [ 8 ] и противотуберкулезные средства . [ 9 ]
Изатиновое ядро также отвечает за цвет красителей « Майя синий » и «Майя желтый». [ 10 ]
Синтез
[ редактировать ]Методика Сандмейера
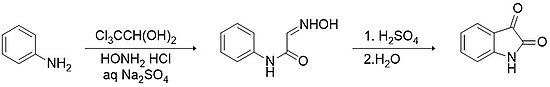
[ редактировать ]Методика Сандмейера — самый старый и простой способ синтеза изатина. [ 11 ] Этот метод включает конденсацию хлоралгидрата и первичного ариламина (например, анилина ) в присутствии гидрохлорида гидроксиламина в водном сульфате натрия с образованием α-изонитрозоацетанилида. Выделение этого промежуточного соединения и последующая электрофильная циклизация, стимулируемая сильными кислотами (например, серной кислотой ), дают изатин с выходом >75%.
Методика Штолле
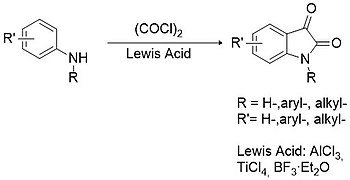
[ редактировать ]Процедура Штолле считается лучшей альтернативой методологии Сандмейера для синтеза как замещенных, так и незамещенных изатинов. [ 12 ] В этом случае первичные или вторичные ариламины конденсируются с оксалилхлоридом с образованием промежуточного хлороксалиланилида, который затем может циклизоваться в присутствии кислоты Льюиса (например, трихлорид алюминия , тетрахлорид титана , бора трифторид и т. д .).
Другие процедуры
[ редактировать ]Более поздние подходы к синтезу N-замещенных изатинов включают прямое окисление коммерчески доступных замещенных индолов или оксиндолов различными окислителями, такими как TBHP , [ 13 ] ИБХ-СО3К , [ 14 ] тХорошо [ 15 ] и т. д .

Реактивность
[ редактировать ]Наличие ароматического кольца , кетона и γ-лактамного фрагмента дает изатину редкий потенциал, который можно использовать как в качестве электрофила , так и в качестве нуклеофила : действительно, он подвергается огромному количеству реакций, таких как N-замещения, электрофильные реакции. ароматическое замещение в положениях С-5 и С-7 фенильного кольца, нуклеофильное присоединение С-3 к карбонильной группе , хемоселективное восстановление , окисление , расширение колец и спироаннуляции . Из-за этой уникальной реакционной способности изатин считается одним из наиболее ценных строительных блоков в органическом синтезе .
N -Замещение
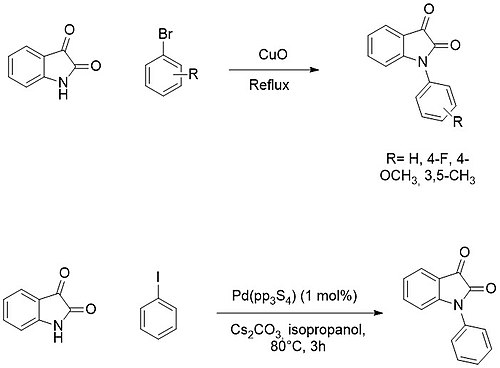
[ редактировать ]- функционализацию N изатинового ядра можно легко получить путем депротонирования аминогруппы с образованием соответствующей натриевой или калиевой соли и последующего добавления электрофила ( например, алкил- или ацилгалогенидов ) .

С другой стороны, N -арилирование обычно достигается путем реакций кросс-сочетания с арилгалогенидами с использованием медных или палладиевых катализаторов . [ 16 ] [ 17 ]
Расширение кольца
[ редактировать ]В области органического синтеза расширения колец считаются ценными реакциями, поскольку позволяют получить кольца среднего размера (7-9 атомов), которые трудно синтезировать «классическими» методами. [ 18 ]
На сегодняшний день опубликовано лишь несколько статей, посвященных расширению кольца производных изатина. Первый представляет собой кислотно-катализируемую однореакторную многокомпонентную реакцию с участием изатинов, аминоурацилов и изооксазолонов с образованием изоксазохинолинов, важных каркасов в медицинской химии . [ 19 ]

В другой однореакторной многокомпонентной реакции уникальное двухуглеродное расширение было достигнуто путем взаимодействия изатина с инден-1,3-дионом и N-замещенным пиридинийбромидом с образованием дибензо[b,d]азепин-6-онов. [ 20 ]

C-2 / C-3 Нуклеофильное присоединение
[ редактировать ]Изатин подвергается нуклеофильному присоединению к карбонилам в положениях С-2 и С-3 . Региоселективность . процесса сильно зависит как от субстрата (свойств заместителей изатинового ядра, особенно связанных с атомом азота), так и от условий реакции ( растворитель , температура и т. д.) В некоторых случаях за нуклеофильным присоединением могут следовать вторичные реакции ( например, циклизация , расширение цикла , раскрытие цикла и т. д. ).

Окисление
[ редактировать ]Окисление изатина перекисью водорода ( окисление Байера-Виллигера ) или хромовым ангидридом дает изатовый ангидрид . [ 22 ] [ 23 ] [ 24 ] соединение, широко используемое как в гербицидах , так и в медицинской химии . Использование пероксидисерной кислоты приводит к образованию соединений 1,4‑бензоксазина . [ 22 ]

Димеризация
[ редактировать ]Димеризация изатина с KBH 4 в метаноле дает Индирубин . [ 25 ] Это красный компонент пигмента индиго и высокоэффективное цитотоксическое соединение.

Снижение
[ редактировать ]Восстановление нонамидной карбонильной группы, очевидно, происходит с образованием оксиндола соответственно.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Эрдманн, Отто Линней (1840). «Исследования Индиго» . Журнал практической химии . 19 (1): 321–362. дои : 10.1002/prac.18400190161 .
- ^ Лоран, Огюст (1840). «Исследование Индиго». Анналы химии и физики . 3 (3): 393–434.
- ^ Пинто, AC (2001). «Химия изатинов: обзор с 1975 по 1999 год» . Ж. Браз. хим. Соц . 12 (3): 273. doi : 10.1590/S0103-50532001000300002 .
- ^ Бергман, Дж. (1988). «Структура и свойства некоторых индольных компонентов Couroupita guianensis aubl». Тетраэдр . 41 (14): 2879. doi : 10.1016/S0040-4020(01)96609-8 .
- ^ Чиянзу, И. (2003). «Синтез и оценка производных изатинов и тиосемикарбазона против крузаина, фальципаина-2 и родезаина». Биоорг. Мед. хим. Летт . 13 (20): 3527–30. дои : 10.1016/S0960-894X(03)00756-X . ПМИД 14505663 .
- ^ Малламо, Япония (2006). «Структурно-ориентированная идентификация новых ингибиторов киназы VEGFR-2 посредством параллельного синтеза в растворе». Биоорг. Мед. хим. Летт . 16 (8): 2158–62. дои : 10.1016/j.bmcl.2006.01.063 . ПМИД 16460933 .
- ^ Он, Ю. (2006). «Разработка, синтез и биологическая оценка новых оксиндолов как ненуклеозидных ингибиторов обратной транскриптазы ВИЧ-1». Биоорг. Мед. хим. Летт . 16 (8): 2109–12. дои : 10.1016/j.bmcl.2006.01.066 . ПМИД 16464578 .
- ^ Шрирам, Д. (2005). «Синтез и оценка анти-ВИЧ активности производных изатина бета-тиосемикарбазона». Биоорг. Мед. хим. Летт . 15 (20): 4451–5. дои : 10.1016/j.bmcl.2005.07.046 . ПМИД 16115762 .
- ^ Бин-Джубайр, ФАС (2010). «Противотуберкулезная активность изатина и его производных». Межд. Дж. Рез. Фарм. Наука . 1 : 113.
- ^ Вускес де Агредос-Паскуаль, ML (2011). «От синего майя к желтому майя: связь между древними наноструктурными материалами по данным вольтамперометрии микрочастиц». Энджью. хим. Межд. Эд . 50 (25): 5741–4. дои : 10.1002/anie.201100921 . ПМИД 21557419 .
- ^ Сандмейер, Т. (1919). «Об изонитрозоацетанилидах и их конденсации с образованием изатинов» . Хелв. Акта . 2 : 234. doi : 10.1002/hlca.19190020125 .
- ^ Столле, Р. (1922). «О N-замещенных оксиндолах и изатинах» . Дж. Практика. Хим. (на немецком языке) . 105 (1): 137–148. дои : 10.1002/prac.19221050111 .
- ^ Джи, SJ (2014). «Хемоселективное аминирование индолов, катализируемое I2/TBHP». Орг. Летт . 16 : 3094–3097.
- ^ Кирш, С.Ф. (2015). «Синтез изатинов путем прямого окисления индолов IBX-SO3K/NaI». Синтез . 47 (13): 1937–1943. дои : 10.1055/s-0034-1380517 .
- ^ Вэй, WT (2018). «Синтез индолин-2,3-дионов путем радикального сочетания индолин-2-онов с трет-бутилгидропероксидом». Синлетт . 29 (2): 215–218. дои : 10.1055/s-0036-1589106 .
- ^ Коппола, Гэри М. (сентябрь 1987 г.). «Арилирование изатинов. Прямой путь к -арилизатовым ангидридам». Журнал гетероциклической химии . 24 (5): 1249–1251. дои : 10.1002/jhet.5570240503 .
- ^ Маджумдер, Арпи; Гупта, Рагини; Мандал, Мринмей; Бабу, Мадху; Чакраборти, Дебашис (апрель 2015 г.). «Стойкие на воздухе катализаторы на основе сульфида палладия (0) для реакций сочетания C–N и C–O типа Ульмана». Журнал металлоорганической химии . 781 : 23–34. дои : 10.1016/j.jorganchem.2014.11.018 .
- ^ Дональд, Джеймс Р.; Ансворт, Уильям П. (3 июля 2017 г.). «Реакции расширения кольца при синтезе макроциклов и колец среднего размера» . Химия - Европейский журнал . 23 (37): 8780–8799. дои : 10.1002/chem.201700467 . ПМИД 28295709 .
- ^ Пумати, Натарадж; Маякришнан, Сивакалаи; Муралидхаран, Дорайсвами; Шринивасан, Раджагопал; Перумал, Парамасиван Т. (2015). «Реакция изатинов с 6-аминоурацилами и изоксазолами: раскрытие изатинового кольца против аннуляций и региоселективный синтез изоксазол-конденсированных хинолиновых каркасов в воде». Зеленая химия . 17 (6): 3362–3372. дои : 10.1039/c5gc00006h .
- ^ Ши, Жун-Го; Ван, Сяо-Хуа; Лю, Ружанг; Ян, Чао-Го (2016). «Расширение двухуглеродного кольца изатина: удобная конструкция дибензо[b,d]азепинонового каркаса». Химические коммуникации . 52 (37): 6280–6283. дои : 10.1039/c6cc00525j . ПМИД 27079548 . S2CID 36547699 .
- ^ Бергман, Ян; Стальные перчатки, Клаас; Валлберг, Ганс (1997). «Исследование реакции между индол-2,3-дионами (изатинами) и вторичными алифатическими аминами» (PDF) . Acta Chemica Scandinavica . 51 : 753–759. doi : 10.3891/acta.chem.scand.51-0753 .
- ^ Jump up to: а б Райссенвебер, Гернот; Мангольд, Дитрих (март 1980 г.). «Окисление изатинов до изатовых ангидридов и 2,3-диоксо-1,4-бензоксазинов». Международное издание «Прикладная химия» на английском языке . 19 (3): 222–223. дои : 10.1002/anie.198002221 .
- ^ Ян, Шуаншуан; Ли, Сишуай; Ху, Фанфанг; Ли, Иньлун; Ян, Юньюнь; Ян, Джункай; Куанг, Чуньсян; Ян, Цин (25 октября 2013 г.). «Открытие производных триптантрина как мощных ингибиторов индоламин-2,3-диоксигеназы с терапевтической активностью у мышей с опухолями рака легких Льюиса (LLC)». Журнал медицинской химии . 56 (21): 8321–8331. дои : 10.1021/jm401195n . ПМИД 24099220 .
- ^ Бао, Яцзе; Ян, Ичжэ; Сюй, Кун; Су, Джиху; Чжа, Чжэнген; Ван, Чжиюн (20 апреля 2015 г.). «Катализируемое медью радикальное метилирование/C–H-аминирование/каскад окисления для синтеза хиназолинонов». Журнал органической химии . 80 (9): 4736–4742. дои : 10.1021/acs.joc.5b00191 . ПМИД 25849218 .
- ^ Ван, Цуйлин; Ян, Цзясюй; Ду, Мо; Берлисон, Джозеф А.; Ли, Чи; Сан, Янни; Чжао, Даньцин; Лю, Цзяньли (май 2017 г.). «Одностадийный синтез индирубинов путем восстановительного сочетания изатинов с KBH 4». Тетраэдр . 73 (19): 2780–2785. дои : 10.1016/j.tet.2017.03.077 .
Отзывы
[ редактировать ]- Попп, Пранк Д. (1975). «Химия изатина». Достижения гетероциклической химии. Том 18 . Том. 18. стр. 1–58. дои : 10.1016/S0065-2725(08)60127-0 . ISBN 9780120206186 .
- Сильва, Хоаким FM да; Гарден, Саймон Дж.; Пинто, Анджело К. (июнь 2001 г.). «Химия изатинов: обзор с 1975 по 1999 год» . Журнал Бразильского химического общества . 12 (3): 273–324. дои : 10.1590/S0103-50532001000300002 .
- Месропян Э.Г.; Аветисян, А.А. (2009). «Новые производные изатина». Российский журнал органической химии . 45 (11): 1583. doi : 10.1134/S1070428009110013 . S2CID 97341279 .
- Варун, Варун; Сонам, Сонам; Каккар, Рита (2019). «Изатин и его производные: обзор последних синтезов, реакций и применений» . МедХимКомм . 10 (3): 351–368. дои : 10.1039/C8MD00585K . ПМК 6438150 . ПМИД 30996856 .
Внешние ссылки
[ редактировать ]- » энциклопедия Британская Том. 14 (11-е изд.). 1911. с. 865–866.