РНК-терапия
РНК-терапия — это новый класс лекарств на основе рибонуклеиновой кислоты (РНК) . проводятся Исследования по клиническому использованию с 1990-х годов, а достигнуты значительные успехи в терапии рака . в начале 2010-х годов [ 1 ] В 2020 и 2021 годах мРНК-вакцины во всем мире были разработаны для использования в борьбе с коронавирусной болезнью (пандемией COVID-19). [ 2 ] Вакцина Pfizer-BioNTech против COVID-19 была первой мРНК-вакциной, одобренной регулирующим органом по лекарственным средствам , за ней последовали вакцина Moderna против COVID-19 и другие.
Основными типами РНК-терапии являются те, которые основаны на информационной РНК (мРНК), антисмысловой РНК (асРНК), РНК-интерференции (РНКи) и РНК- аптамерах . Из четырех типов терапия на основе мРНК является единственной, которая основана на запуске синтеза белков внутри клеток, что делает ее особенно полезной при разработке вакцин. [ 3 ] Антисмысловая РНК комплементарна кодирующей мРНК и используется для запуска инактивации мРНК, чтобы предотвратить использование мРНК в трансляции белка. [ 4 ] Системы на основе РНКи используют аналогичный механизм и включают использование как малых интерферирующих РНК (миРНК), так и микроРНК (миРНК) для предотвращения трансляции мРНК и/или деградации мРНК. [ 5 ] [ 6 ] Однако аптамеры РНК представляют собой короткие одноцепочечные молекулы РНК, образующиеся в результате направленной эволюции для связывания с различными биомолекулярными мишенями с высоким сродством, тем самым влияя на их нормальную in vivo . активность [ 7 ] [ 8 ] [ 9 ]
РНК синтезируется из матричной ДНК с помощью РНК-полимеразы, при этом информационная РНК (мРНК) служит промежуточной биомолекулой между экспрессией ДНК и трансляцией белка . Из-за своих уникальных свойств (таких как типично одноцепочечная природа и 2'-ОН-группа) и способности принимать множество различных вторичных/третичных структур как кодирующие, так и некодирующие РНК привлекли внимание в медицине. Начались исследования по изучению потенциала РНК для использования в терапевтических целях, и при открытии лекарств и внедрении РНК-терапии возникли уникальные проблемы. [ 10 ]
мРНК
[ редактировать ]Информационная РНК ( мРНК ) — это одноцепочечная молекула РНК комплементарная одной из цепей ДНК гена . , [ 11 ] Молекула мРНК передает часть кода ДНК в другие части клетки для производства белков. [ 12 ] ДНК-терапия требует доступа к ядру для транскрипции в РНК, а ее функциональность зависит от разрушения ядерной оболочки во время деления клеток. Однако для того, чтобы мРНК-терапевтические препараты начали функционировать, им не обязательно проникать в ядро, поскольку они будут транслироваться сразу же, как только достигнут цитоплазмы . [ 13 ] Более того, в отличие от плазмид и вирусных векторов , мРНК не интегрируются в геном и, следовательно, не подвергаются риску инсерционного мутагенеза . [ 14 ] что делает их пригодными для использования в вакцинах против рака, иммунотерапии опухолей и профилактике инфекционных заболеваний. [ 15 ]
Открытие и развитие
[ редактировать ]В 1953 году Альфред Дэй Херши сообщил, что вскоре после заражения фагом бактерии вырабатывают форму РНК на высоком уровне, и эта РНК также быстро расщепляется. [ 16 ] Однако первое четкое указание на наличие мРНК было получено в работе Эллиота Волкина и Лазаруса Астрачана в 1956 году, когда они заражали E.coli бактериофагами Т2 и помещали их в среду с 32 П. [ 17 ] [ 18 ] Они обнаружили, что синтез белка E.coli был остановлен и синтезировались фаговые белки. [ 19 ] Затем, в мае 1961 года, их коллеги-исследователи Сидни Бреннер, Франсуа Жакоб и Джим Уотсон объявили о выделении мРНК. [ 20 ] [ 21 ] В течение нескольких десятилетий после открытия мРНК люди сосредоточились на понимании структурных, функциональных аспектов и аспектов метаболизма мРНК. Однако в 1990 году Джон А. Вольф продемонстрировал идею препаратов, кодируемых нуклеиновыми кислотами, путем прямой инъекции транскрибируемой in vitro (IVT) мРНК или плазмидной ДНК (пДНК) в скелетные мышцы мышей, которые экспрессировали кодируемый белок в инъецированной мышце. [ 22 ] [ 23 ] [ 24 ]
Как только мРНК IVT достигает цитоплазмы, мРНК мгновенно транслируется. Таким образом, для функционирования ему не обязательно проникать в ядро. [ 25 ] Кроме того, он не интегрируется в геном и, следовательно, не подвержен риску инсерционного мутагенеза. [ 26 ] Более того, мРНК IVT активна лишь временно и полностью разрушается физиологическими метаболическими путями. [ 27 ] По этим причинам мРНК IVT подверглась обширным доклиническим исследованиям.
Механизмы
[ редактировать ]Транскрипция in vitro (IVT) осуществляется на линеаризованной плазмидной матрице ДНК, содержащей целевую кодирующую последовательность. Затем голая мРНК или мРНК, образующая комплекс с наночастицами, будет доставляться системно или локально. Впоследствии часть экзогенной голой мРНК или мРНК, образующей комплекс, будет проходить через клеточно-специфичные механизмы. Попав в цитоплазму, мРНК IVT транслируется механизмом синтеза белка. [ 28 ] [ 29 ]
Существует два идентифицированных сенсора РНК: toll-подобные рецепторы (TLR) и семейство RIG-I-подобных рецепторов. TLR локализуются в эндосомальном компартменте клеток, таких как ДК и макрофаги. [ 30 ] RIG-I-подобное семейство представляет собой рецептор распознавания образов (PRR). [ 31 ] Однако механизмы иммунного ответа и процесс распознавания мРНК вакцины клеточными сенсорами, а также механизм активации сенсора до сих пор неясны. [ 29 ]
Приложения
[ редактировать ]Иммунотерапия рака
[ редактировать ]В 1995 году Роберт Конри продемонстрировал, что внутримышечная инъекция голой РНК, кодирующей карциноэмбриональный антиген, вызывает антигенспецифические реакции антител. [ 32 ] Затем это было уточнено, продемонстрировав, что дендритные клетки (ДК), подвергнутые воздействию мРНК, кодирующей специфические антигены, или общей мРНК, экстрагированной из опухолевых клеток и введенной мышам с опухолями, индуцируют Т-клеточный иммунный ответ и ингибируют рост опухолей. [ 33 ] Затем исследователи начали подходить к ДК, трансфицированным мРНК, используя вакцины на основе ex vivo IVT. ДК, трансфицированных мРНК [ 34 ] Тем временем компания Argos Therapeutics в 2015 году начала клиническое исследование III фазы с использованием ДК с распространенным почечно-клеточным раком (NCT01582672), но оно было прекращено из-за отсутствия эффективности. [ 35 ]
Для дальнейшего применения мРНК IVT была оптимизирована для in situ трансфекции ДК in vivo . Это улучшило эффективность трансляции и стабильность мРНК IVT и улучшило презентацию антигена, кодируемого мРНК, на MHC класса I и II . молекулах [ 36 ] [ 37 ] Затем они обнаружили, что прямая инъекция обнаженной мРНК IVT в лимфатические узлы была наиболее эффективным способом индуцировать Т-клеточный ответ. [ 38 ] начала первые испытания на людях инъекции голой мРНК IVT, кодирующей раковые антигены, На основании этого открытия компания BioNTech пациентам с меланомой (NCT01684241). [ 39 ]
новую иммунотерапию рака, сочетающую самодоставку РНК (sd-rxRNA) и терапию адоптивного переноса клеток изобрели Недавно компания RXi Pharmaceuticals и Каролинский институт (ACT) . В этой терапии sd-rxRNA устраняла экспрессию иммуносупрессивных рецепторов и белков в терапевтических иммунных клетках, что улучшало способность иммунных клеток разрушать опухолевые клетки. Затем sd-rxRNA, нацеленная на PD-1, помогла повысить противоопухолевую активность инфильтрирующих опухоль лимфоцитов (TIL) против клеток меланомы. [ 40 ] [ 41 ] На основе этой идеи мРНК-4157 была протестирована и прошла I фазу клинических испытаний. [ 42 ]
Цитозольные пути, чувствительные к нуклеиновым кислотам, могут усиливать иммунный ответ на рак. Агонист RIG-I , РНК «стебель-петля» (SLR) 14. Рост опухоли значительно задерживался и увеличивал выживаемость мышей. SLR14 улучшил противоопухолевую эффективность антитела против PD1 по сравнению с лечением одним агентом. SLR14 поглощался CD11b+ миелоидными клетками в микроокружении опухоли . Гены, связанные с иммунной защитой, значительно активировались, наряду с увеличением количества CD8+ Т-лимфоцитов , NK-клеток и CD11b+ клеток. SLR14 ингибировал рост неиммуногенной опухоли B16 , оставляя иммунную память. [ 43 ]
Вакцина
[ редактировать ]В 1993 году о первом успехе мРНК-вакцины было сообщено на мышах с использованием инкапсулированной в липосомы мРНК IVT, которая кодирует нуклеопротеин гриппа, индуцирующий вирусспецифические Т-клетки. [ 44 ] Затем мРНК IVT была составлена с синтетическими липидными наночастицами, и она индуцировала защитные реакции антител против респираторно-синцитиального вируса (РСВ) и вируса гриппа у мышей. [ 45 ]
Существует несколько различных типов разработки вакцин на основе мРНК IVT для лечения инфекционных заболеваний. Одним из успешных типов является использование самоамплифицирующейся мРНК IVT, которая имеет последовательности вирусов с положительной цепью РНК. Первоначально он был разработан для флавивируса и пригоден для внутрикожной инъекции. Одним из других способов является введение двухкомпонентной вакцины, содержащей адъювант мРНК и голую мРНК IVT, кодирующую только антиген гемагглютинина гриппа , или в сочетании с нейраминидазой, кодирующей мРНК IVT. [ 46 ]
Например, для лечения ВИЧ в вакцинах используются ДК, трансфицированные мРНК IVT, кодирующей белки ВИЧ. Существует несколько клинических испытаний фазы I и II с использованием комбинаций, кодирующих мРНК IVT, и они показывают, что могут быть индуцированы антигенспецифические ответы CD8+ и CD4+ Т-клеток. Однако в клинических исследованиях противовирусного эффекта не наблюдалось. [ 47 ] [ 48 ]
Одна из других мРНК-вакцин предназначена для COVID-19 . Вспышка тяжелого острого респираторного синдрома Коронавируса 2 ( SARS-CoV-2 ) произошла в декабре 2019 года и распространилась по всему миру, вызвав пандемию респираторного заболевания, получившего название коронавирусной болезни 2019 года (COVID-19). [ 49 ] Вакцина Moderna против COVID-19 , производимая компанией Moderna с 2020 года, представляет собой вакцину на основе мРНК, инкапсулированную в липидные наночастицы (LNP), которая кодирует полноразмерный, предварительно стабилизированный антиген spike(S)-2P SARS-CoV-2 с трансмембранный якорь. [ 50 ] [ 51 ]
Антивирус
[ редактировать ]В 2021 году сообщалось, что SLR14 предотвращает инфекцию нижних дыхательных путей и тяжелые заболевания у мышей, зависящие от интерферона типа I (IFN-I). У мышей с иммунодефицитом и хронической инфекцией SARS-CoV-2 врожденный иммунитет практически полностью стерилизовался без помощи адаптивной иммунной системы . [ 52 ]
Регенерация тканей
[ редактировать ]Исследование, проведенное в 2022 году исследователями из клиники Майо , Маастрихтского университета и биотехнологической компании Ethris GmBH, специализирующейся на РНК-терапии, показало, что химически модифицированная мРНК, кодирующая BMP-2, способствует дозозависимому заживлению бедренной кости остеотомии у самцов крыс. Молекулы мРНК образовывали комплекс с невирусными липидными частицами , загружали на губки и хирургическим путем имплантировали в дефекты кости. Они оставались локализованными вокруг места нанесения. По сравнению с прямым получением rhBMP-2, костные ткани, регенерированные после обработки мРНК, демонстрировали более высокую прочность и меньшее образование массивной мозоли. [ 53 ]
Ограничения
[ редактировать ]Существует множество проблем для успешного перевода мРНК в лекарства, поскольку мРНК представляет собой очень большую и тяжелую молекулу (10^5 ~ 10^6 Да). Более того, мРНК нестабильна и легко разрушается нуклеазами, а также активирует иммунную систему. [ 54 ] Кроме того, мРНК имеет высокую плотность отрицательного заряда и снижает проникновение мРНК через клеточные мембраны. [ 55 ] По этим причинам без соответствующей системы доставки мРНК легко разлагается, а период полураспада мРНК без системы доставки составляет всего около 7 часов. [ 56 ] Несмотря на то, что некоторые проблемы можно преодолеть с помощью химических модификаций , доставка мРНК остается препятствием. Методы, которые были исследованы для улучшения системы доставки мРНК, включают использование микроинъекций , пластырей РНК (мРНК, загруженных в растворяющуюся микроиглу), генную пушку , конденсацию протамина , адъюванты РНК и инкапсулирование мРНК в наночастицы с липидами. [ 54 ] [ 57 ] [ 58 ]
Несмотря на то, что мРНК, транслированная in vitro (IVT) с агентами доставки, показала улучшенную устойчивость к деградации, необходимы дополнительные исследования о том, как повысить эффективность доставки голой мРНК in vivo . [ 23 ]
Утвержденная РНК-терапия
[ редактировать ]Антисмысловая РНК
[ редактировать ]Антисмысловая РНК представляет собой некодирующую одноцепочечную РНК, комплементарную кодирующей последовательности мРНК. Он ингибирует способность мРНК транслироваться в белки. [ 64 ] Короткие транскрипты антисмысловой РНК производятся внутри ядра под действием фермента Dicer, который расщепляет предшественники двухцепочечной РНК на виды РНК длиной 21–26 нуклеотидов. [ 4 ]
Существует стратегия открытия, основанная на антисмысловом анализе, обоснование и дизайн скрининговых анализов, а также применение таких анализов для скрининга экстрактов натуральных продуктов и открытия ингибиторов ферментов, конденсирующих жирные кислоты . [ 65 ] Антисмысловая РНК используется для лечения рака и ингибирования метастазирования , а векторы — для секвестрации антисмысловых РНК. В частности, микроРНК (миР) 15 и 16 для пациента, нуждающегося в лечении для диагностики и профилактики рака. [ 66 ] Антисмысловые препараты основаны на том факте, что антисмысловая РНК гибридизуется с мРНК и инактивирует ее. Эти лекарства представляют собой короткие последовательности РНК, которые прикрепляются к мРНК и мешают определенному гену производить белок, который он кодирует. Антисмысловые препараты разрабатываются для лечения рака легких, диабета и таких заболеваний, как артрит и астма, с основным воспалительным компонентом. [ 67 ] Это показывает, что снижение экспрессии антисмысловой РНК 1 MLLT4 (MLLT4-AS1) является потенциальным биомаркером и предиктором плохого прогноза рака желудка. На данный момент изучены возможности применения антисмысловых РНК в антивирусных и противораковых методах лечения, а также в регулировании экспрессии родственных генов в растениях и микроорганизмах. [ 68 ] [ 69 ]
Невирусные векторы, вирусные векторы и липосомы использовались для доставки антисмысловой РНК через клеточную мембрану в цитоплазму и ядро. [ нужна ссылка ] Было обнаружено, что доставка на основе вирусного вектора является наиболее предпочтительной среди различных систем доставки, поскольку она обладает высокой эффективностью трансфекции. [ 70 ] Однако трудно доставить антисмысловую РНК только в целевые сайты. Кроме того, из-за размера и проблем стабильности антисмысловой РНК существуют некоторые ограничения на ее использование. Для улучшения условий доставки были изучены химические модификации и новые конструкции олигонуклеотидов для улучшения распределения лекарств, побочных эффектов и переносимости. [ 71 ] [ 72 ]
РНКи
[ редактировать ]Интерферирующие РНК — это класс коротких некодирующих РНК , которые трансляционно или посттрансляционно подавляют экспрессию генов. [ 73 ] [ 5 ] Их открытие и последующая идентификация в качестве ключевых эффекторов посттранскрипционной регуляции генов сделали малые интерферирующие РНК ( миРНК ) и микроРНК ( миРНК ) потенциальными терапевтическими средствами для лечения системных заболеваний. [ 73 ] [ 5 ] [ 74 ] Система RNAi была первоначально открыта в 1990 году Йоргенсеном и др., которые проводили исследования, связанные с введением генов окраски в петунии. [ 74 ] [ 75 ] и считается, что эта система первоначально возникла как средство врожденного иммунитета против вирусов с двухцепочечной РНК. [ 76 ]
миРНК
[ редактировать ]
Малые интерферирующие ( siRNA ) — это короткие двухцепочечные фрагменты РНК из 19–23 пар оснований (с 3'-концом из двух нуклеотидов), которые участвуют в РНК-индуцированном комплексе молчания (RISC) для подавления генов. [ 5 ] [ 74 ] В частности, миРНК связывается комплексом RISC, где она раскручивается с помощью гидролиза АТФ. [ 74 ] [ 77 ] [ 78 ] Затем он используется ферментом «Слайсер» в качестве руководства для нацеливания мРНК на деградацию на основе комплементарного спаривания оснований с целевой мРНК. [ 74 ] [ 77 ] [ 78 ] В качестве терапевтического средства миРНК можно доставлять локально, через глаз или нос, для лечения различных заболеваний. [ 5 ] Преимущества местной доставки заключаются в простоте рецептуры и доставки лекарства, а также в высокой биодоступности препарата. [ 5 ] Системная доставка необходима для борьбы с раком и другими заболеваниями. [ 5 ] Нацеливание на siRNA при местной доставке является одной из основных проблем в терапии siRNA. [ 5 ] Хотя для доставки миРНК-терапии можно использовать внутривенные инъекции , были высказаны опасения по поводу больших объемов, используемых для инъекции, поскольку они часто должны составлять ~ 20-30% от общего объема крови. [ 74 ] Другие методы доставки включают липосомальную упаковку, конъюгацию с проницаемыми для мембран пептидами и прямую электропорацию тканей/органов . [ 74 ] Кроме того, было обнаружено, что экзогенные миРНК сохраняются только несколько дней (максимум несколько недель в неделящихся клетках) in vivo . [ 79 ] [ 80 ] Если миРНК сможет успешно достичь своей цели, она сможет терапевтически регулировать экспрессию генов благодаря своей способности соединять пары оснований с мишенями мРНК и способствовать их деградации через систему RISC. [ 5 ] [ 74 ] В настоящее время терапия на основе миРНК находится на I фазе клинических испытаний для лечения возрастной дегенерации желтого пятна . [ 74 ] хотя его также исследуют для использования в терапии рака. Например, миРНК можно использовать для нацеливания на мРНК, которые кодируют белки, способствующие росту опухоли, такие как рецептор VEGF и фермент теломераза . [ 74 ]
микроРНК
[ редактировать ]МикроРНК ( миРНК ) представляют собой короткие олигонуклеотиды РНК длиной ~19–23 пары оснований , которые участвуют в комплексе молчания, индуцируемом микроРНК. [ 74 ] [ 6 ] В частности, после загрузки на фермент ARGONAUTE микроРНК работают с мРНК, подавляя трансляцию и посттрансляционно дестабилизируя мРНК . [ 6 ] Хотя они функционально аналогичны миРНК, микроРНК не требуют обширного спаривания оснований для подавления мРНК (может потребоваться всего семь пар оснований с мишенью). [ 81 ] [ 82 ] что позволяет им воздействовать на более широкий круг мишеней мРНК. [ 83 ] В клетке микроРНК использует переключение, настройку и нейтральные взаимодействия для точной регуляции репрессии генов. [ 6 ] В качестве терапевтического средства микроРНК потенциально может влиять на биохимические пути во всем организме. [ 73 ]
Поскольку у человека идентифицировано более 400 микроРНК, первоочередной задачей является определение гена-мишени для репрессии. [ 6 ] Было создано несколько баз данных, например TargetScan , с использованием сопоставления семян микроРНК. [ 73 ] Анализы in vitro помогают определить фенотипические эффекты микроРНК. [ 73 ] но из-за сложной природы регуляции генов не все идентифицированные микроРНК оказывают ожидаемый эффект. [ 6 ] Кроме того, было обнаружено, что несколько микроРНК действуют как супрессоры опухолей или онкогены in vivo , например онкогенные миР-155 и миР-17-92. [ 83 ]
В клинических исследованиях микроРНК обычно используются в качестве биомаркеров различных заболеваний, потенциально обеспечивая более раннюю диагностику, а также прогрессирование заболевания, стадию и генетические связи. [ 73 ] В настоящее время в испытаниях фазы 1 и 2 проверяются миметики микроРНК (для экспрессии генов) и микроРНК (для подавления генов) у пациентов с раком и другими заболеваниями. [ 73 ] В частности, мимические микроРНК используются для введения микроРНК, которые действуют как супрессоры опухолей, в раковые ткани, тогда как антагонисты микроРНК используются для нацеливания на онкогенные микроРНК, чтобы предотвратить их активность, способствующую развитию рака. [ 83 ] Терапевтические микроРНК также используются в дополнение к обычным методам лечения (таким как лечение рака), которые, как известно, сверхэкспрессируют или дестабилизируют уровни микроРНК у пациентов. [ 73 ] Примером терапии, имитирующей микроРНК, которая продемонстрировала эффективность в препятствовании росту опухоли рака легких в исследованиях на мышах, является миР-34а. [ 83 ] [ 84 ]
Одним из аспектов терапии на основе микроРНК является потенциальная возможность экзогенной микроРНК влиять на механизмы молчания микроРНК в нормальных клетках организма, тем самым влияя на нормальные клеточные биохимические пути. [ 83 ] Однако исследования in vivo показали, что микроРНК практически не оказывают влияния на нецелевые ткани/органы. [ 84 ] [ 85 ]
РНК-аптамеры
[ редактировать ]
В широком смысле аптамеры представляют собой небольшие молекулы, состоящие либо из одноцепочечной ДНК, либо из РНК и обычно имеющие длину 20–100 нуклеотидов. [ 7 ] [ 8 ] [ 87 ] или ~3-60 кДа . [ 87 ] [ 88 ] Из-за своей одноцепочечной природы аптамеры способны образовывать множество вторичных структур, включая псевдоузлы , петли стеблей и выпуклости, посредством взаимодействий внутрицепочечных пар оснований. [ 87 ] Комбинации вторичных структур, присутствующих в аптамере, придают ему особую третичную структуру, которая, в свою очередь, определяет конкретную мишень, с которой аптамер будет избирательно связываться. [ 87 ] [ 89 ] Из-за избирательной способности аптамеров к связыванию они считаются перспективными биомолекулами для использования в фармацевтике. [ 7 ] [ 8 ] [ 87 ] Кроме того, аптамеры демонстрируют прочное связывание с мишенями, при этом константы диссоциации часто находятся в диапазоне от пМ до нМ. [ 7 ] [ 9 ] Помимо своей сильной связывающей способности, аптамеры ценятся еще и потому, что их можно использовать на мишенях, которые не способны связываться с небольшими пептидами, генерируемыми фаговым дисплеем или антителами , и они способны различать конформационные изомеры и аминокислотные замены. [ 87 ] [ 90 ] [ 91 ] Кроме того, поскольку аптамеры основаны на нуклеиновых кислотах, их можно синтезировать напрямую, устраняя необходимость клеточной экспрессии и экстракции, как в случае с производством антител. [ 8 ] [ 92 ] В частности, РНК-аптамеры способны производить множество различных структур, что приводит к предположениям, что они более разборчивы в своем сродстве к мишени по сравнению с ДНК-аптамерами. [ 87 ] [ 93 ]
Открытие и развитие
[ редактировать ]Аптамеры были первоначально открыты в 1990 году, когда Лари Голд и Крейг Тёрк использовали метод направленной эволюции, известный как SELEX, для выделения небольшой одноцепочечной молекулы РНК, которая была способна связываться с ДНК-полимеразой бактериофага Т4. [ 8 ] [ 94 ] Кроме того, термин «аптамер» был придуман Эндрю Эллингтоном, который работал с Джеком Шостаком над выбором аптамера РНК, который был способен прочно связываться с определенными молекулами органических красителей. [ 87 ] [ 95 ] Сам термин представляет собой смесь латинского «aptus» («подходить») и греческого «meros» («часть»). [ 87 ] [ 95 ]
РНК-аптамеры не столько «создаются», сколько «отбираются». Для разработки РНК-аптамера, способного избирательно связываться с молекулярной мишенью, используется метод, известный как « Систематическая эволюция лигандов путем экспоненциального обогащения» (SELEX), для выделения уникального РНК-аптамера из пула, состоящего от ~ 10 ^ 13 до 10 ^ 16 различных аптамеров. , иначе называемая библиотекой. [ 7 ] [ 8 ] [ 87 ] [ 94 ] [ 95 ] Библиотеку потенциальных олигонуклеотидов аптамеров затем инкубируют с нецелевыми видами, чтобы удалить аптамеры, которые проявляют неспецифическое связывание. [ 7 ] После последующего удаления неспецифических аптамеров оставшиеся члены библиотеки затем подвергаются воздействию желаемой мишени, которая может быть белком, пептидом, типом клеток или даже органом (в случае SELEX на основе живых животных). [ 7 ] [ 87 ] [ 96 ] [ 97 ] [ 98 ] [ 99 ] [ 100 ] [ 101 ] Отсюда аптамеры РНК, которые были связаны с мишенью, транскрибируются в кДНК , которая затем амплифицируется посредством ПЦР , а продукты ПЦР затем повторно транскрибируются в РНК. [ 87 ] Эти новые транскрипты РНК затем используются для многократного повторения цикла селекции, в результате чего в конечном итоге образуется гомогенный пул РНК-аптамеров, способных к высокоспецифичному и высокоаффинному связыванию с мишенью. [ 7 ]
Примеры
[ редактировать ]РНК-аптамеры могут быть разработаны так, чтобы действовать как антагонисты , агонисты или так называемые «аптамеры-ловушки РНК». [ 87 ] [ 102 ] В случае антагонистов аптамер РНК используется либо для предотвращения связывания определенного белка с рецептором его клеточной мембраны, либо для предотвращения выполнения белком своей активности путем связывания с мишенью белка. [ 87 ] В настоящее время единственные методы лечения на основе РНК-аптамеров, прошедшие клинические испытания, действуют как антагонисты. [ 87 ] Когда РНК-аптамеры предназначены для действия в качестве агонистов, они способствуют активации иммунных клеток в качестве костимулирующих молекул, тем самым помогая мобилизовать собственную защитную систему организма. [ 87 ] [ 103 ] Что касается аптамеров-ловушек РНК, синтетический аптамер РНК напоминает нативную молекулу РНК. [ 87 ] [ 102 ] Таким образом, белки, которые связываются с нативной РНК-мишенью, вместо этого связываются с РНК-аптамером, возможно, вмешиваясь в биомолекулярный путь конкретного заболевания. [ 87 ] [ 102 ] Помимо своей полезности в качестве прямых терапевтических агентов, РНК-аптамеры также рассматриваются для других терапевтических ролей. Например, путем конъюгации РНК-аптамера с лекарственным соединением РНК-аптамер может действовать как система адресной доставки этого лекарства. [ 7 ] Такие РНК-аптамеры известны как ApDC. [ 7 ] Кроме того, благодаря конъюгации с радиоизотопом или молекулой флуоресцентного красителя аптамеры РНК могут быть полезны в диагностической визуализации. [ 7 ] [ 104 ] [ 105 ]
Благодаря процессу SELEX, используемому для отбора РНК-аптамеров, можно создавать РНК-аптамеры для многих потенциальных мишеней. Путем непосредственного введения аптамеров РНК в мишень во время SELEX можно получить очень селективный, гомогенный пул аптамеров РНК с высоким сродством. Таким образом, РНК-аптамеры могут быть созданы для воздействия на небольшие пептиды и белки, а также на фрагменты клеток, целые клетки и даже на определенные ткани. [ 7 ] [ 87 ] [ 106 ] [ 107 ] [ 99 ] [ 108 ] Примеры молекулярных мишеней и потенциальных мишеней РНК-аптамеров включают фактор роста эндотелия сосудов , [ 109 ] остеобласты , [ 110 ] и CXC Хемокин-лиганд 12 ( CXCL2 ). [ 7 ] [ 8 ] [ 111 ]
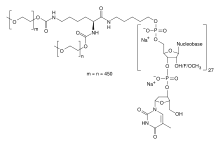
Примером терапии РНК-аптамером является Пегаптаниб (также известный как Macugen®), единственный метод лечения РНК-аптамером, одобренный FDA. [ 7 ] [ 8 ] [ 87 ] Первоначально одобренный в 2004 году для лечения возрастной макулярной дегенерации , пегаптаниб представляет собой аптамер РНК из 28 нуклеотидов, который действует как антагонист VEGF . [ 7 ] [ 8 ] [ 87 ] Однако он не так эффективен, как лечение на основе антител, такое как бевацизумаб и ранибизумаб . [ 87 ] [ 112 ] [ 113 ] Другим примером терапевтического РНК-аптамера является NOX-A12, РНК-аптамер из 45 нуклеотидов, который проходит клинические испытания для лечения хронического лимфоцитарного лейкоза , рака поджелудочной железы , а также других видов рака. [ 8 ] NOX-A12 действует как антагонист CXCL12/SDF-1, хемокина, участвующего в росте опухоли. [ 8 ]
Ограничения
[ редактировать ]Хотя высокая селективность и прочное связывание РНК-аптамеров вызвали интерес к их использованию в качестве фармацевтических препаратов, существует множество проблем, которые не позволяют им добиться успеха in vivo . Во-первых, без модификаций РНК-аптамеры разрушаются после введения в организм нуклеазами в течение нескольких минут. [ 8 ] [ 87 ] [ 114 ] [ 115 ] Кроме того, из-за своего небольшого размера аптамеры РНК могут удаляться из кровотока почечной системой. [ 8 ] [ 87 ] [ 88 ] [ 114 ] [ 115 ] Кроме того, известно, что из-за своего отрицательного заряда аптамеры РНК связывают белки в кровотоке, что приводит к доставке в нецелевые ткани и токсичности. [ 87 ] [ 116 ] [ 117 ] Также необходимо соблюдать осторожность при выделении аптамеров РНК, поскольку аптамеры, которые содержат повторяющиеся последовательности цитозин-фосфат-гуанин (CpG), вызывают активацию иммунной системы через путь Toll-подобного рецептора . [ 8 ] [ 118 ] [ 119 ]
Чтобы преодолеть некоторые in vivo ограничения РНК-аптамеров , к нуклеотидам можно добавлять различные модификации, чтобы повысить эффективность аптамера. Например, фрагмент полиэтиленгликоля (ПЭГ) может быть присоединен для увеличения размера аптамера, тем самым предотвращая его удаление из кровотока почечными клубочками . [ 120 ] [ 121 ] Однако ПЭГ был вовлечен в аллергические реакции во время in vivo . испытаний [ 87 ] [ 122 ] [ 123 ] Кроме того, могут быть добавлены модификации для предотвращения деградации нуклеазы, такие как 2'-фторо- или аминогруппа, а также 3'-инвертированный тимидин. [ 8 ] [ 87 ] [ 124 ] [ 125 ] Кроме того, аптамер можно синтезировать так, чтобы сахар рибозы находился в L-форме, а не в D-форме , что еще больше предотвращает распознавание нуклеазы. [ 7 ] [ 87 ] [ 126 ] [ 127 ] Такие аптамеры известны как шпигельмеры . [ 7 ] [ 127 ] Чтобы предотвратить активацию пути Toll-подобного рецептора, азотистые основания цитозина в аптамере могут быть метилированы. [ 8 ] Тем не менее, несмотря на эти потенциальные решения проблемы снижения эффективности in vivo , возможно, что химическая модификация аптамера может ослабить его аффинность связывания с мишенью. [ 87 ] [ 128 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Шахин, У.; Карико, К.; Туречи, О. (2014), «Терапия на основе мРНК – разработка нового класса лекарств», Nature Reviews. Drug Discovery , 13 (10): 759–780, doi : 10.1038/nrd4278 , PMID 25233993 , S2CID 27454546
- ^ «Наше исследование вакцины против COVID-19 – что дальше? | Pfizer» . www.pfizer.com . Проверено 29 ноября 2020 г.
- ^ ДеФранческо Л. (март 2017 г.). «Вакцина против хайпа» . Природная биотехнология . 35 (3): 193–197. дои : 10.1038/nbt.3812 . ПМИД 28244993 . S2CID 3606308 .
- ^ Перейти обратно: а б Иида Т., Накаяма Дж., Моазед Д. (июль 2008 г.). «Установление гетерохроматина, опосредованное миРНК, требует HP1 и связано с антисмысловой транскрипцией» . Молекулярная клетка . 31 (2): 178–89. doi : 10.1016/j.molcel.2008.07.003 . ПМЦ 2575423 . ПМИД 18657501 .
- ^ Перейти обратно: а б с д и ж г час я Никам Р.Р., Гор КР (август 2018 г.). «Путешествие миРНК: клинические разработки и целевая доставка». Нуклеиновая кислотная терапия . 28 (4): 209–224. дои : 10.1089/нат.2017.0715 . ПМИД 29584585 . S2CID 4763853 .
- ^ Перейти обратно: а б с д и ж Бартель Д.П. (январь 2009 г.). «МикроРНК: целевое распознавание и регуляторные функции» . Клетка . 136 (2): 215–33. дои : 10.1016/j.cell.2009.01.002 . ПМЦ 3794896 . ПМИД 19167326 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р Чжу Г, Чен X (сентябрь 2018 г.). «Таргетная терапия на основе аптамеров» . Обзоры расширенной доставки лекарств . 134 : 65–78. дои : 10.1016/j.addr.2018.08.005 . ПМК 6239901 . ПМИД 30125604 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п Каур Х., Бруно Дж.Г., Кумар А., Шарма Т.К. (01.07.2018). «Аптамеры в терапии и диагностике» . Тераностика . 8 (15): 4016–4032. дои : 10.7150/thno.25958 . ПМК 6096388 . ПМИД 30128033 .
- ^ Перейти обратно: а б Данн М.Р., Хименес Р.М., Чапут Х.К. (04 октября 2017 г.). «Анализ открытия и технологии аптамеров». Обзоры природы Химия . 1 (10): 1–16. дои : 10.1038/s41570-017-0076 . ISSN 2397-3358 .
- ^ Коутиньо МФ, Матуш Л, Сантос ЖИ, Алвес С (2019). «РНК-терапия: как далеко мы зашли?». В Ромао Л. (ред.). Метаболизм мРНК при заболеваниях человека . Достижения экспериментальной медицины и биологии. Том. 1157. Чам: Springer International Publishing. стр. 133–177. дои : 10.1007/978-3-030-19966-1_7 . ISBN 978-3-030-19965-4 . ПМИД 31342441 . S2CID 198491788 .
- ^ «Информационная РНК (мРНК)» . Genome.gov . Проверено 5 октября 2020 г.
- ^ «мРНК» . Биологический словарь . 25 ноября 2016 г. Проверено 30 ноября 2020 г.
- ^ Херндон М.К., Квирк К.С., Нильсон Дж.Х. (январь 2016 г.). «Глава 2. Контроль экспрессии гормональных генов». В Джеймсон Дж.Л., Де Гроот Л.Дж., де Крецер Д.М., Джудис Л.К. (ред.). Эндокринология: взрослая и детская (Седьмое изд.). Филадельфия: У. Б. Сондерс. стр. 16–29.д2. дои : 10.1016/B978-0-323-18907-1.00002-0 . ISBN 978-0-323-18907-1 .
- ^ Ямамото А., Корманн М., Рознекер Дж., Рудольф С. (март 2009 г.). «Текущие перспективы доставки генов мРНК». Европейский журнал фармацевтики и биофармацевтики . 71 (3): 484–9. дои : 10.1016/j.ejpb.2008.09.016 . ПМИД 18948192 .
- ^ Хуан Л., Чжан Л., Ли В., Ли С., Вэнь Дж., Ли Х., Лю Цзы (июль 2020 г.). «Достижения в разработке терапии на основе мРНК». МРНК-вакцины . Актуальные темы микробиологии и иммунологии. Том. 440. Берлин, Гейдельберг: Шпрингер. стр. 147–166. дои : 10.1007/82_2020_222 . ISBN 978-3-031-18069-9 . ПМИД 32683507 . S2CID 220654211 .
- ^ Херши А.Д. (сентябрь 1953 г.). «Экономика нуклеиновых кислот у бактерий, инфицированных бактериофагом Т2» . Журнал общей физиологии . 37 (1): 1–23. дои : 10.1085/jgp.37.1.1 . ПМК 2147426 . PMID 13084888 .
- ^ «Некролог Эллиота Волкина (2012) Knoxville News Sentinel» . Legacy.com . Проверено 1 июля 2021 г.
- ^ Уэйд, Николас (2 августа 2003 г.). «Лазарь Астрахан, 78 лет, проводил исследования РНК» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 1 июля 2021 г.
- ^ Астрачан Л., Коловик К.П., Каплан Н.О. (апрель 1956 г.). «Включение фосфора в рибонуклеиновую кислоту Escherichia coli после заражения бактериофагом Т2». Вирусология . 2 (2): 149–161. дои : 10.1016/0042-6822(56)90016-2 . ПМИД 13312220 .
- ^ Бреннер С., Джейкоб Ф., Мезельсон М. (май 1961 г.). «Нестабильный промежуточный продукт, несущий информацию от генов к рибосомам для синтеза белка». Природа . 190 (4776): 576–581. Бибкод : 1961Natur.190..576B . дои : 10.1038/190576a0 . ПМИД 20446365 . S2CID 4200865 .
- ^ Грос Ф., Хайатт Х., Гилберт В., Курланд К.Г. , Райзбро Р.В., Уотсон Дж.Д. (май 1961 г.). «Нестабильная рибонуклеиновая кислота, обнаруженная с помощью импульсного мечения Escherichia coli ». Природа . 190 (4776): 581–5. Бибкод : 1961Natur.190..581G . дои : 10.1038/190581a0 . ПМИД 13708983 . S2CID 4197056 .
- ^ Вольф Дж.А., Мэлоун Р.В., Уильямс П., Чонг В., Аксади Г., Яни А., Фельгнер П.Л. (март 1990 г.). «Прямой перенос генов в мышцы мыши in vivo». Наука . 247 (4949, ч. 1): 1465–8. Бибкод : 1990Sci...247.1465W . дои : 10.1126/science.1690918 . ПМИД 1690918 .
- ^ Перейти обратно: а б Сахин У, Карико К, Тюречи О (октябрь 2014 г.). «Терапия на основе мРНК – разработка нового класса лекарств» . Обзоры природы. Открытие наркотиков . 13 (10): 759–80. дои : 10.1038/nrd4278 . ПМИД 25233993 . S2CID 27454546 .
- ^ Беккерт, Бертран; Маскида, Бенуа (2011). «Синтез РНК путем транскрипции in vitro» . РНК . Методы молекулярной биологии. Том. 703. стр. 29–41. дои : 10.1007/978-1-59745-248-9_3 . ISBN 978-1-58829-913-0 . ISSN 1940-6029 . ПМИД 21125481 . S2CID 26196836 .
- ^ Карико К. (апрель 2019 г.). «Терапия мРНК, транскрибируемая in vitro: из тени и в центре внимания» . Молекулярная терапия . 27 (4): 691–692. дои : 10.1016/j.ymthe.2019.03.009 . ПМК 6453554 . ПМИД 30905578 .
- ^ Мандл CW, Аберле Дж.Х., Аберле С.В., Хольцманн Х., Эллисон С.Л., Хайнц FX (декабрь 1998 г.). «Инфекционная РНК, синтезированная in vitro, как аттенуированная живая вакцина на модели флавивируса». Природная медицина . 4 (12): 1438–40. дои : 10.1038/4031 . ПМИД 9846585 . S2CID 22676794 .
- ^ Хёрр И., Обст Р., Раммензее Х.Г., Юнг Г. (январь 2000 г.). «Применение РНК in vivo приводит к индукции специфических цитотоксических Т-лимфоцитов и антител». Европейский журнал иммунологии . 30 (1): 1–7. doi : 10.1002/1521-4141(200001)30:1<1::aid-immu1>3.0.co;2-# . ПМИД 10602021 . S2CID 196606232 .
- ^ Ван Хек Л., Руз К. (февраль 2019 г.). «Как мРНК-терапевтические препараты выходят на рынок моноклональных антител» . Журнал трансляционной медицины . 17 (1): 54. дои : 10.1186/s12967-019-1804-8 . ПМК 6387507 . ПМИД 30795778 .
- ^ Перейти обратно: а б Чжан С., Маругги Г., Шань Х., Ли Дж. (2019). «Достижения в области мРНК-вакцин от инфекционных заболеваний» . Границы в иммунологии . 10 :594. дои : 10.3389/fimmu.2019.00594 . ПМК 6446947 . ПМИД 30972078 .
- ^ Хуа З, Хоу Б (март 2013 г.). «Передача сигналов TLR в развитии и активации B-клеток» . Клеточная и молекулярная иммунология . 10 (2): 103–6. дои : 10.1038/cmi.2012.61 . ПМК 4003046 . ПМИД 23241902 .
- ^ Като Х, О СВ, Фудзита Т (май 2017 г.). «RIG-I-подобные рецепторы и интерферопатии I типа» . Журнал исследований интерферона и цитокинов . 37 (5): 207–213. дои : 10.1089/jir.2016.0095 . ПМЦ 5439449 . ПМИД 28475461 .
- ^ Конри Р.М., ЛоБульо А.Ф., Райт М., Сумерел Л., Пайк М.Дж., Йоханнинг Ф. и др. (апрель 1995 г.). «Характеристика полинуклеотидного вакцинного вектора с информационной РНК». Исследования рака . 55 (7): 1397–400. ПМИД 7882341 .
- ^ Бочковски Д., Наир С.К., Снайдер Д., Гильбоа Э. (август 1996 г.). «Дендритные клетки, насыщенные РНК, являются мощными антигенпрезентирующими клетками in vitro и in vivo» . Журнал экспериментальной медицины . 184 (2): 465–72. дои : 10.1084/jem.184.2.465 . ПМК 2192710 . PMID 8760800 .
- ^ Наир С.К., Хейзер А., Бочковски Д., Маджумдар А., Наоэ М., Лебковски Дж.С. и др. (сентябрь 2000 г.). «Индукция цитотоксических Т-клеточных ответов и опухолевого иммунитета против несвязанных опухолей с использованием дендритных клеток, трансфицированных теломеразной обратной транскриптазой РНК». Природная медицина . 6 (9): 1011–7. дои : 10.1038/79519 . ПМИД 10973321 . S2CID 6109427 .
- ^ Аргос Терапевтика (13 июня 2018 г.). «Международное рандомизированное исследование фазы 3 аутологичной иммунотерапии дендритных клеток (AGS-003) плюс стандартное лечение распространенной почечно-клеточной карциномы (ADAPT)» . Клинические испытания . Проверено 30 ноября 2020 г. .
- ^ Крайтер С., Конрад Т., Сестер М., Хубер С., Туречи О., Шахин У. (октябрь 2007 г.). «Одновременная количественная оценка ex vivo антигенспецифических ответов CD4+ и CD8+ Т-клеток с использованием транскрибируемой in vitro РНК» . Иммунология рака, иммунотерапия . 56 (10): 1577–87. дои : 10.1007/s00262-007-0302-7 . ПМЦ 11029841 . ПМИД 17361438 . S2CID 23374448 .
- ^ Крайтер С., Селми А., Дикен М., Себастьян М., Остерло П., Шильд Х. и др. (январь 2008 г.). «Повышение эффективности презентации антигена за счет связывания антигенов с сигналами трафика MHC класса I» . Журнал иммунологии . 180 (1): 309–18. дои : 10.4049/jimmunol.180.1.309 . ПМИД 18097032 . S2CID 83698413 .
- ^ Кун А.Н., Дикен М., Крайтер С., Селми А., Ковальска Дж., Джемиелити Дж. и др. (август 2010 г.). «Аналоги фосфоротиоатного кэпа повышают стабильность и эффективность трансляции РНК-вакцин в незрелых дендритных клетках и вызывают превосходные иммунные реакции in vivo» . Генная терапия . 17 (8): 961–71. дои : 10.1038/gt.2010.52 . ПМИД 20410931 . S2CID 647837 .
- ^ BioNTech RNA Pharmaceuticals GmbH (14 января 2020 г.). «Первое клиническое исследование повышения дозы у человека, оценивающее безопасность и переносимость интранодального введения противораковой вакцины на основе РНК, нацеленной на два опухолеассоциированных антигена, у пациентов с распространенной меланомой» . Клинические испытания . Проверено 30 ноября 2020 г. .
- ^ Лигтенберг М.А., Пико де Коанья Ю., Шмушкович Т., Ёсимото Ю., Труксова И., Ян Ю. и др. (июнь 2018 г.). «Самодоставка РНКи, нацеленная на PD-1, улучшает функциональность опухолеспецифичных Т-клеток для адоптивной клеточной терапии злокачественной меланомы» . Молекулярная терапия . 26 (6): 1482–1493. дои : 10.1016/j.ymthe.2018.04.015 . ПМК 5986970 . ПМИД 29735366 .
- ^ Лиан С., Се Р., Йе Ю, Се Икс, Ли С, Лу Ю и др. (апрель 2019 г.). «Одновременная блокировка CD47 и PD-L1 усиливает врожденный и адаптивный раковый иммунный ответ и высвобождение цитокинов» . Электронная биомедицина . 42 : 281–295. дои : 10.1016/j.ebiom.2019.03.018 . ПМК 6491392 . ПМИД 30878596 .
- ^ «мРНК-4157 | Модерна, Инк» . www.modernatx.com . Проверено 30 ноября 2020 г.
- ^ Цзян, Сяодун; Мутусами, Вишванатан; Федорова, Ольга; Конг, Ён; Ким, Дэниел Дж.; Бозенберг, Маркус; Пайл, Анна Мари; Ивасаки, Акико (2 декабря 2019 г.). «Внутриопухолевая доставка агониста RIG-I SLR14 вызывает сильные противоопухолевые реакции» . Журнал экспериментальной медицины . 216 (12): 2854–2868. дои : 10.1084/jem.20190801 . ISSN 1540-9538 . ПМК 6888973 . ПМИД 31601678 .
- ^ Мартинон Ф., Кришнан С., Ленцен Г., Магне Р., Гомар Э., Гийе Дж.Г. и др. (июль 1993 г.). «Индукция вирусспецифических цитотоксических Т-лимфоцитов in vivo с помощью мРНК, заключённой в липосомах». Европейский журнал иммунологии . 23 (7): 1719–22. дои : 10.1002/eji.1830230749 . ПМИД 8325342 . S2CID 42640967 .
- ^ Хекеле А., Бертолет С., Арчер Дж., Гибсон Д.Г., Палладино Г., Брито Л.А. и др. (август 2013 г.). «Быстро произведенная вакцина SAM(®) против гриппа H7N9 иммуногенна у мышей» . Новые микробы и инфекции . 2 (8): 1–7. дои : 10.1038/emi.2013.54 . ПМЦ 3821287 . ПМИД 26038486 .
- ^ Петш Б., Шни М., Фогель А.Б., Ланге Е., Хоффманн Б., Восс Д. и др. (декабрь 2012 г.). «Защитная эффективность синтезированных in vitro специфических мРНК-вакцин против инфекции вируса гриппа А». Природная биотехнология . 30 (12): 1210–6. дои : 10.1038/nbt.2436 . ПМИД 23159882 . S2CID 12488462 .
- ^ Рути Дж.П., Булассель М.Р., Яссин-Диаб Б., Николетт С., Хили Д., Джейн Р. и др. (февраль 2010 г.). «Иммунологическая активность и безопасность аутологичных дендритных клеток, подвергнутых электропорации РНК ВИЧ, у ВИЧ-1-инфицированных пациентов, получающих антиретровирусную терапию» . Клиническая иммунология . 134 (2): 140–7. дои : 10.1016/j.clim.2009.09.009 . ПМК 2818410 . ПМИД 19889582 .
- ^ Ван Галк Э., Влиге Э., Векеманс М., Ван Тенделоо В.Ф., Ван Де Вельде А., Смитс Э. и др. (февраль 2012 г.). «Вакцинация дендритных клеток на основе мРНК индуцирует мощные противовирусные Т-клеточные реакции у пациентов, инфицированных ВИЧ-1» . СПИД . 26 (4): Ф1-12. дои : 10.1097/qad.0b013e32834f33e8 . ПМИД 22156965 . S2CID 205988884 .
- ^ Хелми Ю.А., Фавзи М., Эласвад А., Соби А., Кенни С.П., Шехата А.А. (апрель 2020 г.). «Пандемия COVID-19: комплексный обзор таксономии, генетики, эпидемиологии, диагностики, лечения и контроля» . Журнал клинической медицины . 9 (4): 1225. дои : 10.3390/jcm9041225 . ПМЦ 7230578 . ПМИД 32344679 .
- ^ "Лекарство" . По умолчанию . Проверено 30 ноября 2020 г.
- ^ Джексон Л.А., Андерсон Э.Дж., Руфаэль Н.Г., Робертс ПК, Махен М., Колер Р.Н. и др. (ноябрь 2020 г.). «МРНК-вакцина против SARS-CoV-2 – предварительный отчет» . Медицинский журнал Новой Англии . 383 (20): 1920–1931. дои : 10.1056/NEJMoa2022483 . ПМЦ 7377258 . ПМИД 32663912 .
- ^ Мао, Тяньян; Исраэлов, Бенджамин; Лукас, Каролина; Фогельс, Шанталь Б.Ф.; Гомес-Кальво, Мария Луиза; Федорова, Ольга; Бребан, Маллери И.; Менаше, Бриджит Л.; Донг, Хуэйпин; Линехан, Мелисса; Йельская инициатива по надзору за геномом SARS-CoV-2 (10 ноября 2021 г.). «Агонист RIG-I РНК «ствол-петля» защищает от острой и хронической инфекции SARS-CoV-2 у мышей» . Журнал экспериментальной медицины . 219 (1): e20211818. дои : 10.1084/jem.20211818 . ISSN 0022-1007 . ПМК 8590200 . ПМИД 34757384 .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Де Ла Вега, Родольфо Э.; ван Гриенсвен, Мартин; Чжан, Вэнь; Коэнен, Майкл Дж.; Наджелли, Кристофер В.; Панос, Джозеф А.; Пенише Сильва, Карлос Х.; Гейгер, Джон; Планк, Кристиан; Эванс, Кристофер Х.; Балмайор, Элизабет Р. (18 февраля 2022 г.). «Эффективное заживление крупных дефектов костных сегментов с использованием оптимизированной химически модифицированной информационной РНК, кодирующей BMP-2» . Достижения науки . 8 (7): eabl6242. Бибкод : 2022SciA....8.6242D . дои : 10.1126/sciadv.abl6242 . ISSN 2375-2548 . ПМЦ 8849297 . ПМИД 35171668 .
- ^ Перейти обратно: а б Хаусли Дж., Толлерви Д. (февраль 2009 г.). «Множество путей деградации РНК» . Клетка . 136 (4): 763–76. дои : 10.1016/j.cell.2009.01.019 . ПМИД 19239894 . S2CID 17570967 .
- ^ Ковальски П.С., Рудра А., Мяо Л., Андерсон Д.Г. (апрель 2019 г.). «Доставка посланника: достижения в области технологий терапевтической доставки мРНК» . Молекулярная терапия . 27 (4): 710–728. дои : 10.1016/j.ymthe.2019.02.012 . ПМК 6453548 . ПМИД 30846391 .
- ^ Шарова Л.В., Шаров А.А., Недорезов Т., Пяо Ю., Шайк Н., Ко М.С. (февраль 2009 г.). «База данных по периоду полураспада мРНК 19 977 генов, полученная с помощью микрочипового анализа ДНК плюрипотентных и дифференцирующихся эмбриональных стволовых клеток мыши» . Исследование ДНК . 16 (1): 45–58. дои : 10.1093/dnares/dsn030 . ПМК 2644350 . ПМИД 19001483 .
- ^ Диринг Р.П., Коммаредди С., Улмер Дж.Б., Брито Л.А., Гилл А.Дж. (июнь 2014 г.). «Вакцины на основе нуклеиновой кислоты: перспективы невирусной доставки мРНК-вакцин». Экспертное мнение о доставке лекарств . 11 (6): 885–99. дои : 10.1517/17425247.2014.901308 . ПМИД 24665982 . S2CID 33489182 .
- ^ Голомбек С., Пильц М., Стейнле Х., Кохба Е., Левин Ю., Лунтер Д. и др. (июнь 2018 г.). «Внутрикожная доставка синтетической мРНК с использованием полых микроигл для эффективного и быстрого производства экзогенных белков в коже» . Молекулярная терапия: нуклеиновые кислоты . 11 : 382–392. дои : 10.1016/j.omtn.2018.03.005 . ПМЦ 5992458 . ПМИД 29858073 .
- ^ Перейти обратно: а б с Ким, Ён Кук (апрель 2022 г.). «РНК-терапия: богатая история, разнообразные применения и неограниченные перспективы» . Экспериментальная и молекулярная медицина . 54 (4): 455–465. дои : 10.1038/s12276-022-00757-5 . ISSN 2092-6413 . ПМК 9016686 . ПМИД 35440755 .
- ^ «Патисиран» , Arc.Ask3.Ru , 10 мая 2023 г. , получено 1 июня 2023 г.
- ^ «Гивосиран» , Arc.Ask3.Ru , 13 мая 2023 г. , получено 13 июня 2023 г.
- ^ «Лумасиран» , Arc.Ask3.Ru , 19 марта 2023 г. , получено 1 июня 2023 г.
- ^ «Инклисиран» , Arc.Ask3.Ru , 10 июня 2023 г. , получено 13 июня 2023 г.
- ^ «7.19A: Регуляция РНК и антисмысловая РНК» . Свободные тексты по биологии . 06.06.2017 . Проверено 1 декабря 2020 г.
- ^ Сингх С.Б., Филлипс Дж.В., Ван Дж. (март 2007 г.). «Высокочувствительная стратегия обнаружения цельноклеточных антибактериальных средств на основе мишени путем подавления антисмысловой РНК». Текущее мнение об открытии и разработке лекарств . 10 (2): 160–6. ПМИД 17436551 .
- ^ США 2017283805 , Бончи Д., Де Мария Р., «Антисмысловая РНК для лечения рака и ингибирования метастазов и векторов для антисмысловой секвестрации», опубликовано в 2017 г., передано Istituto Superiore di Sanità.
- ^ Уэйд Дж.Т. (2013). «Антисмысловая РНК». Энциклопедия генетики Бреннера . дои : 10.1016/B978-0-12-809633-8.06068-4 . ISBN 978-0-12-809633-8 .
- ^ Сюй Цз.З., Чжан Дж.Л., Чжан В.Г. (2018). «Антисмысловая РНК: новый фаворит в генетических исследованиях» . Журнал Чжэцзянского университета. Наука. Б. 19 (10): 739–749. дои : 10.1631/jzus.B1700594 . ПМК 6194357 . ПМИД 30269442 .
- ^ Волудакис, Андреас Э.; Калдис, Афанасий; Патил, Басавапрабху Л. (29 сентября 2022 г.). «Вакцинация растений на основе РНК для борьбы с вирусами» . Ежегодный обзор вирусологии . 9 (1): 521–548. doi : 10.1146/annurev-virology-091919-073708 . ISSN 2327-056X .
- ^ Фаруки А.А., Рехман ЗУ, Мунтане Дж (ноябрь 2014 г.). «Антисмысловая терапия в онкологии: современное состояние» . Онкомишени и терапия . 7 : 2035–42. дои : 10.2147/ott.s49652 . ПМК 4224095 . ПМИД 25395862 .
- ^ «Терапия на основе антисмысловых олигонуклеотидов», Генная терапия , CRC Press, стр. 365–392, май 2000 г., ISBN. 978-0-429-13193-6
- ^ «Том 49, 2009 г.». Ежегодный обзор фармакологии и токсикологии . 49 . 10 января 2009 г. doi : 10.1146/pharmtox.2009.49.issue-1 .
- ^ Перейти обратно: а б с д и ж г час Ханна Дж., Хоссейн Г.С., Кочерха Дж. (2019). «Потенциал терапии микроРНК и клинических исследований» . Границы генетики . 10 : 478. дои : 10.3389/fgene.2019.00478 . ПМК 6532434 . ПМИД 31156715 .
- ^ Перейти обратно: а б с д и ж г час я дж к Деви Г.Р. (сентябрь 2006 г.). «Подходы на основе миРНК в терапии рака» . Генная терапия рака . 13 (9): 819–29. дои : 10.1038/sj.cgt.7700931 . ПМИД 16424918 . S2CID 23475841 .
- ^ Наполи К, Лемье К, Йоргенсен Р (апрель 1990 г.). «Введение химерного гена халконсинтазы в петунию приводит к обратимой совместной супрессии гомологичных генов в транс» . Растительная клетка . 2 (4): 279–289. дои : 10.1105/tpc.2.4.279 . ПМК 159885 . ПМИД 12354959 .
- ^ Хэннон Дж.Дж. (июль 2002 г.). «РНК-интерференция». Природа . 418 (6894): 244–51. Бибкод : 2002Natur.418..244H . дои : 10.1038/418244a . ПМИД 12110901 . S2CID 4426281 .
- ^ Перейти обратно: а б Томари И., Замор PD (март 2005 г.). «Перспектива: машины для RNAi» . Гены и развитие . 19 (5): 517–29. дои : 10.1101/gad.1284105 . ПМИД 15741316 .
- ^ Перейти обратно: а б Банан М., Пури Н. (октябрь 2004 г.). «Все тонкости РНКи в клетках млекопитающих». Современная фармацевтическая биотехнология . 5 (5): 441–50. дои : 10.2174/1389201043376643 . ПМИД 15544492 .
- ^ Сонг Э, Ли С.К., Дайксхорн Д.М., Новина С., Чжан Д., Кроуфорд К. и др. (июль 2003 г.). «Устойчивое ингибирование вируса иммунодефицита человека типа 1 с помощью малых интерферирующих РНК в первичных макрофагах» . Журнал вирусологии . 77 (13): 7174–81. doi : 10.1128/JVI.77.13.7174-7181.2003 . ПМК 164789 . ПМИД 12805416 .
- ^ Сонг Э, Ли С.К., Ван Дж., Инс Н., Оуян Н., Мин Дж. и др. (март 2003 г.). «РНК-интерференция, направленная на Fas, защищает мышей от молниеносного гепатита». Природная медицина . 9 (3): 347–51. дои : 10.1038/nm828 . ПМИД 12579197 . S2CID 4182632 .
- ^ Лай ЕС (апрель 2002 г.). «МикроРНК комплементарны мотивам последовательности 3'-UTR, которые опосредуют негативную посттранскрипционную регуляцию». Природная генетика . 30 (4): 363–4. дои : 10.1038/ng865 . ПМИД 11896390 . S2CID 33175420 .
- ^ Джексон А.Л., Барц С.Р., Шелтер Дж., Кобаяши С.В., Берчард Дж., Мао М. и др. (июнь 2003 г.). «Профилирование экспрессии показывает нецелевую регуляцию генов с помощью РНКи». Природная биотехнология . 21 (6): 635–7. дои : 10.1038/nbt831 . ПМИД 12754523 . S2CID 24778534 .
- ^ Перейти обратно: а б с д и Бадер А.Г., Браун Д., Винклер М. (сентябрь 2010 г.). «Перспективы заместительной терапии микроРНК» . Исследования рака . 70 (18): 7027–30. doi : 10.1158/0008-5472.CAN-10-2010 . ПМК 2940943 . ПМИД 20807816 .
- ^ Перейти обратно: а б Виггинс Дж. Ф., Руффино Л., Келнар К., Омотола М., Патравала Л., Браун Д., Бадер А.Г. (июль 2010 г.). «Разработка препарата для лечения рака легких на основе микроРНК-супрессора опухолей-34» . Исследования рака . 70 (14): 5923–30. дои : 10.1158/0008-5472.CAN-10-0655 . ПМЦ 2913706 . ПМИД 20570894 .
- ^ Кота Дж., Чивукула Р.Р., О'Доннелл К.А., Вентцель Э.А., Монтгомери К.Л., Хван Х.В. и др. (июнь 2009 г.). «Терапевтическая доставка микроРНК подавляет онкогенез на мышиной модели рака печени» . Клетка . 137 (6): 1005–17. дои : 10.1016/j.cell.2009.04.021 . ПМЦ 2722880 . ПМИД 19524505 .
- ^ Перейти обратно: а б Хуанг Х., Суслов Н.Б., Ли Н.С., Шелке С.А., Эванс М.Э., Колдобская Ю. и др. (август 2014 г.). «РНК, содержащая G-квадруплекс, активирует флуоресценцию GFP-подобного флуорофора» . Химическая биология природы . 10 (8): 686–91. дои : 10.1038/nchembio.1561 . ПМК 4104137 . ПМИД 24952597 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и Чжоу Дж., Росси Дж. (март 2017 г.). «Аптамеры как средства таргетной терапии: текущий потенциал и проблемы» . Обзоры природы. Открытие наркотиков . 16 (3): 181–202. дои : 10.1038/nrd.2016.199 . ПМК 5700751 . ПМИД 27807347 .
- ^ Перейти обратно: а б Го П (декабрь 2010 г.). «Новая область нанотехнологии РНК» . Природные нанотехнологии . 5 (12): 833–42. Бибкод : 2010НатНа...5..833Г . дои : 10.1038/nnano.2010.231 . ПМК 3149862 . ПМИД 21102465 .
- ^ Гелинас А.Д., Дэвис Д.Р., Янич Н. (февраль 2016 г.). «Охват белков: структурные темы аптамер-белковых комплексов» . Современное мнение в области структурной биологии . 36 : 122–32. дои : 10.1016/j.sbi.2016.01.009 . ПМИД 26919170 .
- ^ Гейгер А., Бургсталлер П., фон дер Эльц Х., Редер А., Фамулок М. (март 1996 г.). «РНК-аптамеры, которые связывают L-аргинин с субмикромолярными константами диссоциации и высокой энантиоселективностью» . Исследования нуклеиновых кислот . 24 (6): 1029–36. дои : 10.1093/нар/24.6.1029 . ПМЦ 145747 . ПМИД 8604334 .
- ^ Чен Л., Рашид Ф., Шах А., Аван Х.М., Ву М., Лю А. и др. (август 2015 г.). «Выделение РНК-аптамера, нацеленного на белок p53, с мутацией одной аминокислоты» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (32): 10002–7. Бибкод : 2015PNAS..11210002C . дои : 10.1073/pnas.1502159112 . ПМЦ 4538674 . ПМИД 26216949 .
- ^ Киф А.Д., Пай С., Эллингтон А. (июль 2010 г.). «Аптамеры как терапевтические средства» . Обзоры природы. Открытие наркотиков . 9 (7): 537–50. дои : 10.1038/nrd3141 . ПМК 7097324 . ПМИД 20592747 .
- ^ Шу Ю, Пи Ф, Шарма А, Раджаби М, Хак Ф, Шу Д и др. (февраль 2014 г.). «Стабильные наночастицы РНК как потенциальные препараты нового поколения для терапии рака» . Обзоры расширенной доставки лекарств . 66 : 74–89. дои : 10.1016/j.addr.2013.11.006 . ПМЦ 3955949 . ПМИД 24270010 .
- ^ Перейти обратно: а б Туерк C, Золото L (август 1990 г.). «Систематическая эволюция лигандов путем экспоненциального обогащения: лиганды РНК к ДНК-полимеразе бактериофага Т4». Наука . 249 (4968): 505–10. Бибкод : 1990Sci...249..505T . дои : 10.1126/science.2200121 . ПМИД 2200121 .
- ^ Перейти обратно: а б с Эллингтон А.Д., Шостак Дж.В. (август 1990 г.). «Отбор in vitro молекул РНК, связывающих специфические лиганды». Природа . 346 (6287): 818–22. Бибкод : 1990Natur.346..818E . дои : 10.1038/346818a0 . ПМИД 1697402 . S2CID 4273647 .
- ^ Го К.Т., Цимер Г., Пол А., Вендел Х.П. (апрель 2008 г.). «CELL-SELEX: Новые перспективы терапии на основе аптамеров» . Международный журнал молекулярных наук . 9 (4): 668–78. дои : 10.3390/ijms9040668 . ПМЦ 2635693 . ПМИД 19325777 .
- ^ Охучи С (2012). «Селл-СЕЛЭКС Технология» . Биоисследования в открытом доступе . 1 (6): 265–272. дои : 10.1089/biores.2012.0253 . ПМК 3559206 . ПМИД 23515081 .
- ^ Черкия Л., Джангранде П.Х., Макнамара Дж.О., де Франциск В. (2009). «Клеточно-специфичные аптамеры для таргетной терапии». В Майере Дж. (ред.). Нуклеиновые кислоты и пептидные аптамеры . Методы молекулярной биологии. Том. 535. Тотова, Нью-Джерси: Humana Press. стр. 59–78. дои : 10.1007/978-1-59745-557-2_5 . ISBN 978-1-59745-557-2 . ПМЦ 4443708 . ПМИД 19377980 .
- ^ Перейти обратно: а б Тан З., Шангуань Д., Ван К., Ши Х., Сефа К., Малликратчи П. и др. (июль 2007 г.). «Отбор аптамеров для молекулярного распознавания и характеристики раковых клеток». Аналитическая химия . 79 (13): 4900–7. дои : 10.1021/ac070189y . ПМИД 17530817 .
- ^ Сяо З, Шангуань Д, Цао З, Фанг Икс, Тан В (18 февраля 2008 г.). «Клеточно-специфическое исследование интернализации аптамера, полученного из цельноклеточной селекции». Химия: Европейский журнал . 14 (6): 1769–75. дои : 10.1002/chem.200701330 . ПМИД 18092308 .
- ^ Филлипс Дж. А., Лопес-Колон Д., Чжу З., Сюй Ю., Тан В. (июль 2008 г.). «Применение аптамеров в биологии раковых клеток». Аналитика Химика Акта . 621 (2): 101–8. Бибкод : 2008AcAC..621..101P . дои : 10.1016/j.aca.2008.05.031 . ПМИД 18573375 .
- ^ Перейти обратно: а б с Кон Д.Б., Бауэр Дж., Райс Ч.Р., Ротшильд Дж.К., Карбонаро Д.А., Вальдес П. и др. (июль 1999 г.). «Клиническое испытание опосредованного ретровирусом переноса гена-приманки rev-чувствительного элемента в клетки CD34 (+) из костного мозга детей, инфицированных вирусом иммунодефицита человека-1». Кровь . 94 (1): 368–71. дои : 10.1182/blood.V94.1.368.413a47_368_371 . ПМИД 10381536 .
- ^ Хедри М., Рафатпана Х., Абнус К., Рамесани П., Рамезани М. (декабрь 2015 г.). «Иммунотерапия рака с помощью аптамеров нуклеиновых кислот». Международная иммунофармакология . 29 (2): 926–936. дои : 10.1016/j.intimp.2015.10.013 . ПМИД 26603636 .
- ^ Ши Х, Хэ X, Ван К, Ву X, Е X, Го Q и др. (март 2011 г.). «Активируемый аптамерный зонд для визуализации рака in vivo с контрастным усилением на основе изменения конформации, вызванного белком клеточной мембраны» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (10): 3900–5. Бибкод : 2011PNAS..108.3900S . дои : 10.1073/pnas.1016197108 . ПМК 3054025 . ПМИД 21368158 .
- ^ Чжан Дж., Смага Л.П., Сатьяволу Н.С., Чан Дж., Лу Ю. (декабрь 2017 г.). «Активируемые зонды на основе ДНК-аптамеров для фотоакустической визуализации живых мышей» . Журнал Американского химического общества . 139 (48): 17225–17228. дои : 10.1021/jacs.7b07913 . ПМК 5724028 . ПМИД 29028325 .
- ^ Ми Дж., Лю Ю., Раббани З.Н., Ян З., Урбан Дж.Х., Салленджер Б.А., Клэри Б.М. (январь 2010 г.). «In vivo отбор мотивов РНК, нацеленных на опухоль» . Химическая биология природы . 6 (1): 22–4. дои : 10.1038/nchembio.277 . ПМЦ 2795795 . ПМИД 19946274 .
- ^ Шангуань Д., Ли Ю, Тан З., Цао З.К., Чен Х.В., Малликаратчи П. и др. (август 2006 г.). «Аптамеры произошли из живых клеток и стали эффективными молекулярными зондами для изучения рака» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (32): 11838–43. дои : 10.1073/pnas.0602615103 . ПМЦ 1567664 . ПМИД 16873550 .
- ^ Чен Х.В., Медли К.Д., Сефа К., Шангуань Д., Тан З., Мэн Л. и др. (июнь 2008 г.). «Молекулярное распознавание клеток мелкоклеточного рака легких с использованием аптамеров» . ХимМедХим . 3 (6): 991–1001. дои : 10.1002/cmdc.200800030 . ПМЦ 3544301 . ПМИД 18338423 .
- ^ Грагудас Э.С., Адамис А.П., Каннингем Э.Т., Фейнсод М., Гайер Д.Р. (декабрь 2004 г.). «Пегаптаниб при неоваскулярной возрастной макулярной дегенерации» . Медицинский журнал Новой Англии . 351 (27): 2805–16. doi : 10.1056/NEJMoa042760 . ПМИД 15625332 . S2CID 10050130 .
- ^ Лян С., Го Б., Ву Х., Шао Н., Ли Д., Лю Дж. и др. (март 2015 г.). «Липидные наночастицы, функционализированные аптамерами, нацеленные на остеобласты, как новая костная анаболическая стратегия, основанная на интерференции РНК» . Природная медицина . 21 (3): 288–94. дои : 10.1038/нм.3791 . ПМК 5508976 . ПМИД 25665179 .
- ^ Хелленригель Дж., Зборальски Д., Мааш С., Розин Нью-Йорк, Вирда В.Г., Китинг М.Дж. и др. (февраль 2014 г.). «Spiegelmer NOX-A12, новый ингибитор CXCL12, препятствует подвижности клеток хронического лимфоцитарного лейкоза и вызывает химиосенсибилизацию» . Кровь . 123 (7): 1032–9. дои : 10.1182/blood-2013-03-493924 . ПМК 4123413 . ПМИД 24277076 .
- ^ Муса С.А., Муса СС (июнь 2010 г.). «Текущий статус ингибирования фактора роста эндотелия сосудов при возрастной дегенерации желтого пятна». Биопрепараты . 24 (3): 183–94. дои : 10.2165/11318550-000000000-00000 . ПМИД 20210371 . S2CID 19177321 .
- ^ Феррара Н., Адамис А.П. (июнь 2016 г.). «Десять лет терапии противосудорожным фактором роста эндотелия» . Обзоры природы. Открытие наркотиков . 15 (6): 385–403. дои : 10.1038/nrd.2015.17 . ПМИД 26775688 . S2CID 29441279 .
- ^ Перейти обратно: а б Хили Дж.М., Льюис С.Д., Курц М., Бумер Р.М., Томпсон К.М., Уилсон С., МакКоли Т.Г. (декабрь 2004 г.). «Фармакокинетика и биораспределение новых композиций аптамеров». Фармацевтические исследования . 21 (12): 2234–46. дои : 10.1007/s11095-004-7676-4 . ПМИД 15648255 . S2CID 25786376 .
- ^ Перейти обратно: а б Абейдира Н.Д., Эгли М., Кокс Н., Мерсье К., Конде Дж.Н., Паллан П.С. и др. (сентябрь 2016 г.). «Вызов пикомолярного связывания в РНК с помощью одной фосфородитиоатной связи» . Исследования нуклеиновых кислот . 44 (17): 8052–64. дои : 10.1093/nar/gkw725 . ПМК 5041495 . ПМИД 27566147 .
- ^ Генри С.П., Гиклас ПК, Лидс Дж., Пэнгберн М., Аулетта С., Левин А.А., Корнбруст DJ (май 1997 г.). «Активация альтернативного пути комплемента фосфоротиоатным олигонуклеотидом: потенциальный механизм действия». Журнал фармакологии и экспериментальной терапии . 281 (2): 810–6. ПМИД 9152389 .
- ^ Фарман Калифорния, Корнбруст диджей (17 ноября 2016 г.). «Исследования олигодезоксинуклеотидов на приматах: антисмысловые и иммуностимулирующие показания» . Токсикологическая патология . 31 Приложение: 119–22. дои : 10.1080/01926230390174995 . ПМИД 12597439 . S2CID 22520922 .
- ^ Авчи-Адали М., Стейнле Х., Мишель Т., Шленсак К., Вендел Х.П. (23 июля 2013 г.). «Потенциальная способность аптамеров вызывать иммунную активацию в крови человека» . ПЛОС ОДИН . 8 (7): е68810. Бибкод : 2013PLoSO...868810A . дои : 10.1371/journal.pone.0068810 . ПМЦ 3720859 . ПМИД 23935890 .
- ^ Мена А., Ничани А.К., Попович Ю., Годсон Д.Л., Дент Д., Таунсенд Х.Г. и др. (октябрь 2003 г.). «Врожденные иммунные реакции, индуцированные стимуляцией CpG-олигодезоксирибонуклеотидов мононуклеарных клеток овечьей крови» . Иммунология . 110 (2): 250–7. дои : 10.1046/j.1365-2567.2003.01722.x . ПМК 1783041 . ПМИД 14511239 .
- ^ Мусумечи Д., Монтесарчио Д. (ноябрь 2012 г.). «Поливалентные аптамеры нуклеиновых кислот и модуляция их активности: акцент на аптамере, связывающем тромбин». Фармакология и терапия . 136 (2): 202–15. doi : 10.1016/j.pharmthera.2012.07.011 . ПМИД 22850531 .
- ^ Соул Э.Э., Бомпиани К.М., Вудрафф Р.С., Салленджер Б.А. (февраль 2016 г.). «Нацеливание на две протеазы коагуляционного каскада с помощью двухвалентного аптамера дает мощный антикоагулянт, контролируемый антидотом» . Нуклеиновая кислотная терапия . 26 (1): 1–9. дои : 10.1089/нат.2015.0565 . ПМЦ 4753633 . ПМИД 26584417 .
- ^ Гансон Н.Дж., Повсич Т.Дж., Салленджер Б.А., Александр Дж.Х., Зеленкофске С.Л., Саилстад Дж.М. и др. (май 2016 г.). «Ранее существовавшие антитела против полиэтиленгликоля связаны с аллергическими реакциями при первом контакте с пегнивакогином, ПЭГилированным РНК-аптамером» . Журнал аллергии и клинической иммунологии . 137 (5): 1610–1613.e7. дои : 10.1016/j.jaci.2015.10.034 . ПМЦ 5819876 . ПМИД 26688515 .
- ^ Линкофф А.М., Мехран Р., Повшич Т.Дж., Зеленкофске С.Л., Хуанг З., Армстронг П.В. и др. (январь 2016 г.). «Влияние антикоагулянтной системы REG1 по сравнению с бивалирудином на исходы после чрескожного коронарного вмешательства (REGULATE-PCI): рандомизированное клиническое исследование». Ланцет . 387 (10016): 349–356. дои : 10.1016/s0140-6736(15)00515-2 . ПМИД 26547100 . S2CID 10905525 .
- ^ Шарма Т.К., Бруно Дж.Г., Диман А. (01.03.2017). «Азбука ДНК-аптамера и разработка соответствующих методов анализа». Достижения биотехнологии . 35 (2): 275–301. doi : 10.1016/j.biotechadv.2017.01.003 . ПМИД 28108354 .
- ^ Пикен В.А., Олсен Д.Б., Бенселер Ф., Ауруп Х., Экстайн Ф. (июль 1991 г.). «Кинетическая характеристика устойчивых к рибонуклеазе 2'-модифицированных рибозимов в форме молотка». Наука . 253 (5017): 314–7. Бибкод : 1991Sci...253..314P . дои : 10.1126/science.1857967 . ПМИД 1857967 .
- ^ Фатер А., Клуссманн С. (март 2003 г.). «На пути к аптамерам третьего поколения: шпигельмеры и их терапевтические перспективы». Текущее мнение об открытии и разработке лекарств . 6 (2): 253–61. ПМИД 12669461 .
- ^ Перейти обратно: а б Рускони С.П., Робертс Дж.Д., Питок Г.А., Нимджи С.М., Уайт Р.Р., Квик Дж. и др. (ноябрь 2004 г.). «Антидот-опосредованный контроль аптамера антикоагулянта in vivo». Природная биотехнология . 22 (11): 1423–8. дои : 10.1038/nbt1023 . ПМИД 15502817 . S2CID 5061714 .
- ^ Алдеринг Л.Дж., Тайеб Х., Кришнан С., Флетчер С., Уилтон С.Д., Виду Р.Н. (3 апреля 2015 г.). «Умные функциональные химеры нуклеиновых кислот: возможность таргетной терапии тканеспецифической РНК» . Биология РНК . 12 (4): 412–25. дои : 10.1080/15476286.2015.1017234 . ПМЦ 4615226 . ПМИД 25849197 .
Внешние ссылки
[ редактировать ]- РНК-терапия на подъеме , Природа (апрель 2020 г.)