Флавивирус
Эта статья нуждается в дополнительных цитатах для проверки . ( май 2023 г. ) |
| Флавивирус | |
|---|---|
 | |
| ПЭМ - микрофотография вируса желтой лихорадки . | |
 | |
| вируса Зика Модель вирусной оболочки , раскрашенная цепочками, PDB запись 5ire [2] | |
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Область : | Рибовирия |
| Королевство: | Орторнавиры |
| Тип: | Китриновирикота |
| Сорт: | Фласувирицеты |
| Заказ: | Амарилловирусы |
| Семья: | Флавивирусиды |
| Род: | Флавивирус |
| Разновидность [1] | |
Флавивирус , переименованный в Ортофлавивирус . в 2023 году [3] — род РНК-содержащих вирусов с положительной цепью семейства Flaviviridae . Род включает вирус Западного Нила , вирус денге , вирус клещевого энцефалита , вирус желтой лихорадки , вирус Зика и ряд других вирусов , которые могут вызывать энцефалит . [4] а также специфичные для насекомых флавивирусы (ISF), такие как вирус агента слияния клеток (CFAV), вирус Палм-Крик (PCV) и вирус реки Парраматта (PaRV). [5] Хотя флавивирусы с двойным хозяином могут инфицировать как позвоночных, так и членистоногих, флавивирусы, специфичные для насекомых, ограничены компетентными членистоногими. [6] Способы, с помощью которых флавивирусы создают стойкую инфекцию в своих компетентных векторах и вызывают заболевания у людей, зависят от нескольких взаимодействий вирус-хозяин, включая сложное взаимодействие между кодируемыми флавивирусами иммунными антагонистами и противовирусными эффекторными молекулами врожденного иммунитета хозяина. [7]
Флавивирусы названы в честь вируса желтой лихорадки; Слово flavus означает «желтый» на латыни , а желтая лихорадка, в свою очередь, получила свое название из-за ее склонности вызывать желтую желтуху у жертв. [8]
Флавивирусы имеют несколько общих аспектов: общий размер (40–65 нм), симметрия ( оболочка , икосаэдрический нуклеокапсид ), нуклеиновая кислота ( с положительным смыслом одноцепочечная РНК около 10 000–11 000 оснований) и внешний вид под электронным микроскопом . [ нужна ссылка ]
Большинство этих вирусов в первую очередь передаются через укус инфицированного членистоногого (комара или клеща) и поэтому классифицируются как арбовирусы . Заражение человека большинством этих арбовирусов носит случайный характер, поскольку люди не способны реплицировать вирус до достаточно высоких титров , чтобы повторно заразить членистоногих, необходимых для продолжения жизненного цикла вируса. В этом случае человек становится тупиковым хозяином . Исключением являются вирус желтой лихорадки , вирус денге и вирус Зика . Этим трем вирусам по-прежнему требуются комары-переносчики, но они достаточно хорошо адаптированы к человеку и не обязательно зависят от животных-хозяев (хотя они также по-прежнему имеют важные пути передачи через животных).
Другие пути передачи арбовирусов включают обращение с тушами зараженных животных, переливание крови, секс, роды и употребление непастеризованных молочных продуктов. Однако передача от позвоночных, не являющихся человеком, человеку без промежуточного членистоногого-переносчика в большинстве случаев происходит с низкой вероятностью. Например, ранние тесты на желтую лихорадку показали, что болезнь не заразна .
Известные неарбовирусы семейства флавивирусов размножаются либо у членистоногих, либо у позвоночных, но не у тех и других, причем один нечетный представитель рода поражает нематод . [9]
Структура
[ редактировать ]
Флавивирусы имеют оболочку , сферическую форму, икосаэдрическую геометрию с псевдосимметрией T=3. Диаметр вирусных частиц составляет около 50 нм. [10]
Геном
[ редактировать ]Флавивирусы имеют с положительным смыслом одноцепочечные РНК- геномы , которые не сегментированы и имеют длину около 10–11 т.п.н. [10] В целом геном кодирует три структурных белка (капсид, prM и оболочка) и семь неструктурных белков (NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5). [11] Геномная РНК модифицирована на 5'-конце геномной РНК с положительной цепью и имеет структуру cap-1 (me 7 -GpppA-я 2 ). [12]
Жизненный цикл
[ редактировать ]
Флавивирусы реплицируются в цитоплазме клеток-хозяев. Геном имитирует молекулу клеточной мРНК во всех аспектах, за исключением отсутствия полиаденилированного (поли-А) хвоста . Эта особенность позволяет вирусу использовать клеточные аппараты для синтеза как структурных, так и неструктурных белков во время репликации . Клеточная рибосома имеет решающее значение для репликации флавивируса, поскольку она транслирует РНК аналогично клеточной мРНК, что приводит к синтезу одного полипротеина . [11]
Структуры клеточной РНК-кэпа образуются под действием РНК -трифосфатазы с гуанилилтрансферазой , N7- метилтрансферазой и 2'-O-метилтрансферазой. Вирус кодирует эту активность в своих неструктурных белках. Белок NS3 кодирует РНК-трифосфатазу в своем геликазном домене. Он использует сайт гидролиза АТФ геликазы для удаления γ-фосфата с 5'-конца РНК. N-концевой домен неструктурного белка 5 (NS5) обладает как N7-метилтрансферазной, так и гуанилилтрансферазной активностью, необходимой для формирования зрелых кэп-структур РНК. Сродство связывания РНК снижается в присутствии АТФ или ГТФ и усиливается S-аденозилметионином . [12] Этот белок также кодирует 2'-О-метилтрансферазу.

После трансляции полипротеин расщепляется комбинацией вирусных протеаз и протеаз хозяина с высвобождением зрелых полипептидных продуктов. [13] Тем не менее, клеточная посттрансляционная модификация зависит от присутствия поли-А-хвоста; поэтому этот процесс не зависит от хоста. Вместо этого полипротеин обладает автокаталитической функцией, которая автоматически высвобождает первый пептид, вирус-специфичный фермент. Затем этот фермент способен расщеплять оставшийся полипротеин на отдельные продукты. Одним из расщепляемых продуктов является РНК-зависимая РНК-полимераза , ответственная за синтез молекулы РНК с отрицательным смыслом. Следовательно, эта молекула действует как матрица для синтеза РНК геномного потомства . [ нужна ссылка ]
Репликация геномной РНК флавивируса происходит на шероховатых мембранах эндоплазматического ретикулума в мембранных компартментах. Впоследствии собираются новые вирусные частицы. Это происходит во время процесса почкования , который также отвечает за накопление оболочки и лизис клеток . [ нужна ссылка ]
Киназа 2 рецептора, связанная с AG-белком (также известная как ADRBK1), по-видимому, важна для проникновения и репликации некоторых вирусов у Flaviviridae . [14]
Естественным хозяином служат человек, млекопитающие, комары и клещи. Пути передачи – зооноз и укус. [10]
| Род | Сведения о хосте | Тканевой тропизм | Детали входа | Подробности выпуска | Сайт репликации | Монтажный участок | Передача инфекции |
|---|
Элементы вторичной структуры РНК
[ редактировать ]
Геном положительной смысловой РНК флавивируса содержит 5'- и 3'- нетранслируемые области (UTR).
5'UTR
[ редактировать ]составляет 95–101 нуклеотид Длина 5'UTR вируса Денге . [15] имеются два консервативных структурных элемента Во 5'UTR флавивируса : большая петля стебля (SLA) и петля короткого стебля (SLB). SLA складывается в Y-образную конструкцию с боковой петлей на штоке и небольшой верхней петлей. [15] [16] SLA, вероятно, действует как промотор и необходим для синтеза вирусной РНК. [17] [18] SLB участвует во взаимодействиях между 5'UTR и 3'UTR, которые приводят к циклизации вирусной РНК, что важно для репликации вируса. [19]
3'UTR
[ редактировать ]
3'UTR обычно имеют длину 0,3–0,5 т.п.н. и содержат ряд высококонсервативных вторичных структур , которые консервативны и ограничены семейством флавивирусов . Большая часть анализов проводилась с использованием вируса Западного Нила (ВЗН) для изучения функции 3'UTR. [ нужна ссылка ]
В настоящее время в 3'UTR WNV идентифицировано 8 вторичных структур: SL-I, SL-II, SL-III, SL-IV, DB1, DB2. и КРЕ. [20] [21] Некоторые из этих вторичных структур были охарактеризованы и играют важную роль в облегчении репликации вируса и защите 3'UTR от расщепления 5'- эндонуклеазой . Устойчивость к нуклеазе защищает нижестоящий фрагмент 3'-UTR РНК от деградации и имеет важное значение для вирус-индуцированной цитопатии и патогенности. [ нужна ссылка ]
- СЛ-II
Было высказано предположение, что SL-II способствует устойчивости к нуклеазам. [21] Это может быть связано с другой петлей-шпилькой, идентифицированной в 5'UTR генома вируса японского энцефалита (JEV). [22] Шпилька JEV значительно избыточно представлена при инфицировании клетки-хозяина, и было высказано предположение, что структура шпильки может играть роль в регуляции синтеза РНК. [ нужна ссылка ]
- СЛ-IV
Эта вторичная структура расположена в пределах 3'UTR генома флавивируса выше элементов DB. Функция этой консервативной структуры неизвестна, но считается, что она способствует устойчивости к рибонуклеазе. [ нужна ссылка ]
- БД1/БД2
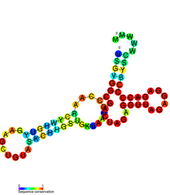
Эти две консервативные вторичные структуры также известны как псевдоповторяющиеся элементы. Первоначально они были идентифицированы в геноме вируса Денге и расположены рядом друг с другом в пределах 3'UTR. Похоже, они широко сохранились среди Flaviviradae. Эти элементы БД имеют вторичную структуру, состоящую из трех спиралей, и играют роль в обеспечении эффективной трансляции. Удаление DB1 приводит к небольшому, но значительному сокращению трансляции, а удаление DB2 малоэффективно. Удаление DB1 и DB2 снизило эффективность трансляции вирусного генома до 25%. [20]
- КРЕ
CRE представляет собой цис-действующий элемент репликации, также известный как элементы 3'SL РНК, и считается, что он необходим для репликации вируса, способствуя образованию «репликационного комплекса». [23] Хотя были представлены доказательства существования структуры псевдоузла в этой РНК, она, по-видимому, не является хорошо консервативной среди флавивирусов. [24] Было показано, что делеции 3'-UTR флавивирусов летальны для инфекционных клонов.
Консервированная шпилька ТЭЦ
[ редактировать ]Консервативная структура шпильки (cHP) позже была обнаружена в нескольких флавивирусов геномах и, как полагают, управляет трансляцией капсидных белков. Он расположен сразу после стартового кодона AUG . [25]
Роль вторичных структур РНК в продукции мфРНК
[ редактировать ]
Субгеномная РНК флавивируса (сфРНК) является продолжением 3'-UTR и, как было показано, играет роль в флавивируса . репликации и патогенезе [26] (XRN1) клеток-хозяев sfRNA продуцируется путем неполной деградации геномной вирусной РНК 5'-3' экзорибонуклеазой 1 . [27] Поскольку XRN1 разрушает вирусную РНК, он останавливается в петлях, образованных вторичной структурой 5'- и 3'-UTR. [28] В результате этой паузы образуется непереваренный фрагмент геномной РНК, известный как sfRNA. sfRNA влияет на жизненный цикл флавивируса в зависимости от концентрации. Накопление sfRNA вызывает (1) антагонизацию врожденного иммунного ответа клетки, тем самым снижая защиту хозяина от вируса. [29] (2) ингибирование активности XRN1 и Dicer для модификации путей РНКи, которые разрушают вирусную РНК [30] (3) модификация комплекса репликации вируса для увеличения репродукции вируса. [31] В целом, sfRNA участвует во многих путях, которые ставят под угрозу защиту хозяина и способствуют заражению флавивирусами. [ нужна ссылка ]
Эволюция
[ редактировать ]
Флавивирусы можно разделить на две клады: одна с трансмиссивными вирусами, а другая с неизвестным вектором. [32] Кладу вектора, в свою очередь, можно разделить на кладу, переносимую комарами, и кладу, переносимую клещами. Эти группы можно еще раз разделить. [33]
Группу комаров можно разделить на две ветви: одна ветвь содержит нейротропные вирусы, часто связанные с энцефалитными заболеваниями у людей или домашнего скота. Эта ветвь, как правило, распространяется видами Culex и имеет резервуары для птиц. Вторая ветвь — это ненейротропные вирусы, вызывающие геморрагические болезни человека. хозяевами обычно являются виды Aedes Переносчиками и приматами- . [ нужна ссылка ]
Клещевые вирусы также образуют две отдельные группы: одна связана с морскими птицами , а другая – вирусы комплекса клещевого энцефалита – связана преимущественно с грызунами . [ нужна ссылка ]
Вирусы, у которых отсутствует известный переносчик, можно разделить на три группы: одна, тесно связанная с вирусами, переносимыми комарами, которая связана с летучими мышами ; второй, генетически более отдаленный, также связан с летучими мышами; и третья группа связана с грызунами. [ нужна ссылка ]
Эволюционные взаимоотношения между эндогенизированными вирусными элементами флавивирусов и современными флавивирусами с использованием подходов максимального правдоподобия показали, что флавивирусы, переносимые членистоногими, вероятно, произошли из источника паукообразных. [34] Это противоречит более ранним работам с меньшим количеством существующих вирусов, показывающим, что клещевые вирусы произошли из группы, переносимой комарами. [35]
Несколько частичных и полных геномов флавивирусов были обнаружены у водных беспозвоночных, таких как морской паук Endeis spinosa. [36] и несколько ракообразных и головоногих моллюсков. [37] Эти последовательности, по-видимому, связаны с последовательностями флавивирусов, специфичных для насекомых, а также с группами вирусов летучих мышей Тамана. Хотя в настоящее время неясно, как водные флавивирусы вписываются в эволюцию этой группы вирусов, есть некоторые свидетельства того, что один из этих вирусов, флавивирус акулы Вэньчжоу, заражает как ракообразных ( Portunus trituberculatus ), так и тихоокеанскую лопатозную акулу ( Scoliodon macrorhynchos ) акулу-хозяина. , [38] [37] что указывает на жизненный цикл водного арбовируса.

Для некоторых из этих вирусов были сделаны оценки времени расхождения. [39] Судя по всему, эти вирусы возникли по крайней мере от 9400 до 14 000 лет назад. Штаммы денге Старого и Нового Света разошлись между 150 и 450 годами назад. Штаммы европейского и дальневосточного клещевого энцефалита разошлись около 1087 (1610–649) лет назад. Вирусы европейского клещевого энцефалита и луппинг-инфекции разошлись около 572 (844–328) лет назад. Эта последняя оценка согласуется с историческими данными. Вирус Кунджин отделился от вируса Западного Нила примерно 277 (475–137) лет назад. Это время соответствует заселению Австралии из Европы. Группа японского энцефалита, по-видимому, возникла в Африке 2000–3000 лет назад, а затем сначала распространилась в Юго-Восточную Азию, а затем мигрировала в остальную часть Азии.
Филогенетические исследования вируса Западного Нила показали, что он возник как отдельный вирус около 1000 лет назад. [40] Этот первоначальный вирус развился в две отдельные линии: линия 1 и ее многочисленные профили являются источником эпидемической передачи в Африке и во всем мире. Линия 2 считалась африканским зоонозом . Однако в 2008 году линия 2, ранее наблюдавшаяся только у лошадей в странах Африки к югу от Сахары и на Мадагаскаре, начала появляться у лошадей в Европе, где в 2008 году первая известная вспышка затронула 18 животных в Венгрии. [41] Lineage 1 Вирус Западного Нила был обнаружен в Южной Африке в 2010 году у кобылы и ее абортированного плода ; ранее только вирус Западного Нила линии 2 был обнаружен у лошадей и людей в Южной Африке. [42] Случай со смертельным исходом у косатки в Техасе в 2007 году расширил известный круг хозяев вируса Западного Нила, включив в него китообразных . [43]
Вирус омской геморрагической лихорадки , по-видимому, эволюционировал в течение последних 1000 лет. [44] Вирусные геномы можно разделить на 2 клады — А и В. Клада А имеет пять генотипов, а клада В — один. Эти клады разделились около 700 лет назад. Такое разделение, судя по всему, произошло в Курганской области. Клада А впоследствии подверглась разделению на клады C, D и E 230 лет назад. Клады C и E, по-видимому, произошли из Новосибирской и Омской областей соответственно. Ондатра Ondatra zibethicus , очень восприимчивая к этому вирусу, была завезена в этот район в 1930-х годах.
Таксономия
[ редактировать ]Разновидность
[ редактировать ]В роде Flavivirus насчитывается 53 определенных вида: [45]
- Тогда вирус
- Эра вируса
- Вирусы Багаза
- Вирус Банзи
- Вирус Бубуи
- Вирус летучих мышей Букаласа
- Вирус Касипакор
- Вирус острова Кэри
- Вирус Ковбоун-Ридж
- Вирус дакарской летучей мыши
- Вирус денге
- Вирус Эдж-Хилл
- Вирус летучих мышей Энтеббе
- Гаджеты Вирус Gully
- Вирус Ильеуса
- Израильский вирус менингоэнцефаломиелита индейки
- Вирус японского энцефалита
- Также вирусы
- Миллионы вирусов
- Когда вирус
- Вирус Кедугу
- Убить вирус
- Вирус Коутанго
- Вирус лесной болезни Кьясанур
- Избавьтесь от вируса
- Вирус Лупинга
- Вирус Меабан
- Модок-вирус
- Вирус лейкоэнцефалита Montana myotis
- Вирус энцефалита долины Мюррей
- Вирус Нтая
- Вирус омской геморрагической лихорадки
- Вирус летучих мышей Пномпеня
- Вирус Повассан
- Вирус Рио-Браво
- Вирус Королевской фермы
- савойский вирус
- Вирус энцефалита Сент-Луиса
- Старый соляной вирус
- Вирус Сан-Перлита
- Вирус Саумарес Рифа
- вирус Сепик
- Проникновение вирусов
- Вирус клещевого энцефалита
- Tyuleniy virus
- Вирус S Уганды
- Вирус Усуту
- Вирус Вессельсброна
- Вирус Западного Нила
- Вирус Яунде
- Вирус желтой лихорадки
- Вирус Йокосе
- вирус Зика
Сортировка по вектору
[ редактировать ]Вакцина
[ редактировать ]
Очень успешная вакцина против желтой лихорадки 17D , представленная в 1937 году, привела к резкому снижению эпидемической активности. [ нужна ссылка ]
Эффективные инактивированные вакцины против японского энцефалита и клещевого энцефалита были внедрены в середине 20 века. Неприемлемые побочные эффекты побудили перейти от вакцины против японского энцефалита, инактивированной мозгом мышей , к более безопасным и эффективным вакцинам второго поколения от японского энцефалита. Они могут найти широкое применение для эффективной профилактики этого тяжелого заболевания среди огромного населения Азии — Северной, Южной и Юго-Восточной. [ нужна ссылка ]
Вирусы денге ежегодно вызывают многие миллионы инфекций в результате передачи успешным глобальным комаром-переносчиком. Поскольку борьба с комарами не удалась, несколько вакцин против денге находятся на разных стадиях разработки. CYD-TDV, продаваемая под торговым названием Dengvaxia, представляет собой четырехвалентную химерную вакцину, которая соединяет структурные гены четырех вирусов денге с основной цепью желтой лихорадки 17D. [50] [51] Денгваксия одобрена в пяти странах. [52]
Альтернативный подход к разработке флавивирусных вакцинных векторов основан на использовании вирусов, инфицирующих насекомых. Специфические для насекомых флавивирусы, такие как вирус Бинджари, не способны реплицироваться в клетках позвоночных. Тем не менее, рекомбинантные вирусы, в которых гены структурных белков (prME) вируса Бинджари заменены генами вируса денге, вируса Зика, вируса Западного Нила, вируса желтой лихорадки или вируса японского энцефалита, эффективно реплицируются в клетках насекомых, где высокие титры инфекционных вирусных частиц. производятся. Иммунизация мышей вакциной Бинджари, несущей структурные белки вируса Зика, защищала мышей от заболевания после заражения . Похожий подход использует специфичный для насекомых альфавирус Эйлатский вирус в качестве платформы для вакцины . ... Эти новые вакцинные платформы, созданные на основе флавивирусов и альфавирусов, специфичных для насекомых, представляют собой доступные, эффективные и безопасные подходы к быстрой разработке инфекционных, ослабленных вакцин против патогенов этих двух семейств вирусов. [53]
Ссылки
[ редактировать ]- ^ «Таксономия вирусов: выпуск 2018b» . Международный комитет по таксономии вирусов (ICTV) . Март 2019 года . Проверено 16 марта 2019 г.
- ^ Сирохи Д., Чен З., Сан Л., Клозе Т., Пирсон Т.К., Россманн М.Г., Кун Р.Дж. (апрель 2016 г.). «Крио-ЭМ структура вируса Зика с разрешением 3,8 Å» . Наука . 352 (6284): 467–470. Бибкод : 2016Sci...352..467S . дои : 10.1126/science.aaf5316 . ПМЦ 4845755 . ПМИД 27033547 .
- ^ Постлер Т.С., Бир М., Блитвич Б.Дж., Бух Дж., де Ламбаллери Х, Дрекслер Дж.Ф., Имри А., Капур А., Карганова Г.Г., Леми П., Ломанн В., Симмондс П., Смит Д.Б., Стэплтон Дж.Т., Кун Дж.Х. (10 августа 2023 г.) . «Переименование рода Flavivirus в Orthoflavivirus и расширение биномиальных видовых названий внутри семейства Flaviviridae» . Архив вирусологии . 168 (9): 224. doi : 10.1007/s00705-023-05835-1 . ISSN 1432-8798 . ПМИД 37561168 .
- ^ Ши, ПЯ, изд. (2012). Молекулярная вирусология и контроль флавивирусов . Кайстер Академик Пресс . ISBN 978-1-904455-92-9 .
- ^ Маклин Б.Дж., Хобсон-Питерс Дж., Уэбб С.Э., Уоттерсон Д., Проу Н.А., Нгуен Х.Д., Холл-Менделин С., Варрилоу Д., Йохансен К.А., Янсен К.С., ван ден Херк А.Ф., Биб Н.В., Шнеттлер Е., Барнард Р.Т., Холл Р.А. (2015). «Новый флавивирус, специфичный для насекомых, реплицируется только в клетках, полученных из Aedes, и сохраняется с высокой распространенностью в диких популяциях Aedes vigilax в Сиднее, Австралия» . Вирусология . 486 : 272–283. дои : 10.1016/j.virol.2015.07.021 . ПМИД 26519596 .
- ^ Эльрефаи А.М., Абдельнаби Р., Росалес Росас А.Л., Ван Л., Басу С., Деланг Л. (сентябрь 2020 г.). «Понимание механизмов, лежащих в основе ограничения хозяином вирусов, специфичных для насекомых» . Вирусы . 12 (9): 964. дои : 10.3390/v12090964 . ПМЦ 7552076 . ПМИД 32878245 .
- ^ Элрефаи А.М., Холлингхерст П., Рейтмайер К.М., Алфи Л., Маринджер К. (ноябрь 2021 г.). «Врожденный иммунный антагонизм флавивирусов, передающихся комарами, у человека и комаров» . Вирусы . 13 (11): 2116. дои : 10.3390/v13112116 . ПМЦ 8624719 . ПМИД 34834923 .
- ↑ Самое раннее упоминание о «жёлтой лихорадке» встречается в рукописи 1744 года Джона Митчелла из Вирджинии; копии рукописи были отправлены г-ну Кадвалладеру Колдену , врачу из Нью-Йорка, и Бенджамину Рашу из Филадельфии; рукопись была переиздана в 1814 году. См.:
- Митчелл, Джон (написано: 1744 г.; переиздано: 1814 г.) «Отчет о желтой лихорадке, которая преобладала в Вирджинии в 1737, 1741 и 1742 годах, в письме покойному Кадвалладеру Колдену, эсквайру из Нью-Йорка, от покойного Джон Митчелл, MDFRS Вирджинии» , Американский медицинский и философский регистр , 4 : 181–215.
- ^ Jump up to: а б Бекал С., Домье Л.Л., Гонфа Б., Маккоппин Н.К., Ламберт К.Н., Балерао К. (2014). «Новый флавивирус соевой нематоды» . Журнал общей вирусологии . 95 (Часть 6): 1272–1280. дои : 10.1099/ вир.0.060889-0 ПМИД 24643877 .
- ^ Jump up to: а б с «Вирусная зона» . ЭксПАСи. Архивировано из оригинала 17 июня 2015 года . Проверено 15 июня 2015 г.
- ^ Jump up to: а б Райс С., Ленчес Э., Эдди С., Шин С., Шитс Р., Штраус Дж. (23 августа 1985 г.). «Нуклеотидная последовательность вируса желтой лихорадки: значение для экспрессии и эволюции гена флавивируса» . Наука . 229 (4715): 726–33. Бибкод : 1985Sci...229..726R . дои : 10.1126/science.4023707 . ПМИД 4023707 . Проверено 14 ноября 2016 г.
- ^ Jump up to: а б Хендерсон Б.Р., Саиди Б.Дж., Кампаньола Дж., Гейсс Б.Дж. (2011). Жанг К. (ред.). «Анализ связывания РНК ферментом, кэпирующим РНК NS5 вируса Денге» . ПЛОС ОДИН . 6 (10): e25795. Бибкод : 2011PLoSO...625795H . дои : 10.1371/journal.pone.0025795 . ПМК 3192115 . ПМИД 22022449 .
- ^ Сунь Г., Ларсен С., Баумгарт Н., Клем Э., Шойерманн Р. (26 января 2017 г.). «Комплексная аннотация зрелых пептидов и генотипов вируса Зика» . ПЛОС ОДИН . 12 (1): e0170462. Бибкод : 2017PLoSO..1270462S . дои : 10.1371/journal.pone.0170462 . ПМК 5268401 . ПМИД 28125631 .
- ^ Ле Соммер С., Бэрроуз, Нью-Джерси, Брэдрик С.С., Пирсон Дж.Л., Гарсиа-Бланко, Массачусетс (2012). Майкл С.Ф. (ред.). «Киназа 2 рецептора, связанная с G-белком, способствует проникновению и репликации флавивирусов» . PLOS Негль Троп Дис . 6 (9): e1820. дои : 10.1371/journal.pntd.0001820 . ПМЦ 3441407 . ПМИД 23029581 .
- ^ Jump up to: а б Гебхард Л.Г., Филоматори К.В., Гамарник А.В. (2011). «Функциональные элементы РНК в геноме вируса денге» . Вирусы . 3 (9): 1739–56. дои : 10.3390/v3091739 . ПМК 3187688 . ПМИД 21994804 .
- ^ Бринтон М.А., Dispoto JH (1988). «Анализ последовательности и вторичной структуры 5'-концевой области РНК генома флавивируса». Вирусология . 162 (2): 290–9. дои : 10.1016/0042-6822(88)90468-0 . ПМИД 2829420 .
- ^ Филоматори К.В., Лодейро М.Ф., Альварес Д.Е., Самса М.М., Пьетрасанта Л., Гамарник А.В. (2006). «5'-элемент РНК способствует синтезу РНК вируса денге в кольцевом геноме» . Генс Дев . 20 (16): 2238–49. дои : 10.1101/gad.1444206 . ПМЦ 1553207 . ПМИД 16882970 .
- ^ Ю Л, Номагути М, Падманабхан Р, Маркофф Л (2008). «Особые требования к элементам 5'- и 3'-концевых областей при синтезе РНК флавивирусов и репликации вируса» . Вирусология . 374 (1): 170–85. дои : 10.1016/j.virol.2007.12.035 . ПМК 3368002 . ПМИД 18234265 .
- ^ Альварес Д.Е., Лодейро М.Ф., Лудуэнья С.Дж., Пьетрасанта Л.И., Гамарник А.В. (2005). «Взаимодействия РНК-РНК дальнего действия образуют кольцевой геном вируса денге» . Дж Вирол . 79 (11): 6631–43. doi : 10.1128/JVI.79.11.6631-6643.2005 . ПМЦ 1112138 . ПМИД 15890901 .
- ^ Jump up to: а б Чиу В.В., Кинни Р.М., Дреер Т.В. (июль 2005 г.). «Контроль трансляции 5'- и 3'-концевых областей генома вируса денге» . Дж. Вирол . 79 (13): 8303–15. doi : 10.1128/JVI.79.13.8303-8315.2005 . ПМЦ 1143759 . ПМИД 15956576 .
- ^ Jump up to: а б Пийльман Г.П., Функ А., Кондратьева Н. и др. (декабрь 2008 г.). «Для патогенности необходима высокоструктурированная, устойчивая к нуклеазе, некодирующая РНК, продуцируемая флавивирусами» . Микроб-хозяин клетки . 4 (6): 579–91. дои : 10.1016/j.chom.2008.10.007 . ПМИД 19064258 .
- ^ Лин К.К., Чанг Х.Л., Чанг Р.Ю. (май 2004 г.). «Накопление 3'-концевого фрагмента генома в клетках млекопитающих и комаров, инфицированных вирусом японского энцефалита» . Дж. Вирол . 78 (10): 5133–8. doi : 10.1128/JVI.78.10.5133-5138.2004 . ПМК 400339 . ПМИД 15113895 .
- ^ Цзэн Л., Фалгоут Б., Маркофф Л. (сентябрь 1998 г.). «Идентификация специфических нуклеотидных последовательностей внутри консервативной 3'-SL в геноме вируса денге типа 2, необходимых для репликации» . Дж. Вирол . 72 (9): 7510–22. doi : 10.1128/JVI.72.9.7510-7522.1998 . ПМК 109990 . ПМИД 9696848 .
- ^ Ши П.И., Бринтон М.А., Вил Дж.М., Чжун Ю.И., Уилсон В.Д. (апрель 1996 г.). «Доказательства существования структуры псевдоузла на 3'-конце геномной РНК флавивируса». Биохимия . 35 (13): 4222–30. дои : 10.1021/bi952398v . ПМИД 8672458 .
- ^ Клайд К., Харрис Э. (2006). «Вторичная структура РНК в кодирующей области вируса денге типа 2 управляет выбором стартового кодона трансляции и необходима для репликации вируса» . Дж Вирол . 80 (5): 2170–2182. doi : 10.1128/JVI.80.5.2170-2182.2006 . ПМЦ 1395379 . ПМИД 16474125 .
- ^ Биде К., Гарсия-Бланко, Массачусетс (1 сентября 2014 г.). «Флавивирусные РНК: оружие и мишени в войне между вирусом и хозяином». Биохимический журнал . 462 (2): 215–230. дои : 10.1042/BJ20140456 . ISSN 0264-6021 . ПМИД 25102029 .
- ^ Чепмен Э.Г., Константино Д.А., Рабе Дж.Л., Мун С.Л., Вилуш Дж., Никс Дж.К., Кифт Дж.С. (18 апреля 2014 г.). «Структурная основа продукции патогенной субгеномной флавивирусной РНК (мфРНК)» . Наука . 344 (6181): 307–310. Бибкод : 2014Sci...344..307C . дои : 10.1126/science.1250897 . ISSN 0036-8075 . ПМК 4163914 . ПМИД 24744377 .
- ^ Функ А., Труонг К., Нагасаки Т., Торрес С., Флоден Н., Мелиан Э.Б., Эдмондс Дж., Донг Х., Ши П.Ю. (1 ноября 2010 г.). «Структуры РНК, необходимые для производства субгеномной РНК флавивируса» . Журнал вирусологии . 84 (21): 11407–11417. дои : 10.1128/JVI.01159-10 . ISSN 0022-538X . ПМЦ 2953152 . ПМИД 20719943 .
- ^ Чанг Р.Ю., Сюй Т.В., Чен Ю.Л., Лю С.Ф., Цай Ю.Дж., Линь Ю.Т., Чен Ю.С., Фань Ю.Х. (27 сентября 2013 г.). «Некодирующая РНК вируса японского энцефалита ингибирует активацию интерферона, блокируя ядерную транслокацию регуляторного фактора 3 интерферона». Ветеринарная микробиология . 166 (1–2): 11–21. дои : 10.1016/j.vetmic.2013.04.026 . ПМИД 23755934 .
- ^ Мун С.Л., Андерсон Дж.Р., Кумагай Ю., Вилуш С.Дж., Акира С., Хромых А.А., Вилуш Дж. (1 ноября 2012 г.). «Некодирующая РНК, продуцируемая флавивирусами, переносимыми членистоногими, ингибирует клеточную экзорибонуклеазу XRN1 и изменяет стабильность мРНК хозяина» . РНК . 18 (11): 2029–2040. дои : 10.1261/rna.034330.112 . ISSN 1355-8382 . ПМЦ 3479393 . ПМИД 23006624 .
- ^ Кларк Б.Д., Роби Дж.А., Слончак А., Хромых А.А. (3 августа 2015 г.). «Функциональные некодирующие РНК, полученные из 3'-нетранслируемой области флавивируса». Вирусные исследования . Специальный выпуск: Функции концов вирусных геномов с положительной цепью РНК. 206 : 53–61. doi : 10.1016/j.virusres.2015.01.026 . ПМИД 25660582 .
- ^ Куно Дж., Чанг Г.Дж., Цучия К.Р., Карабацос Н., Кропп CB (1998). «Филогения рода Flavivirus» . Дж Вирол . 72 (1): 73–83. doi : 10.1128/JVI.72.1.73-83.1998 . ПМК 109351 . ПМИД 9420202 .
- ^ Гонт М.В., Салл А.А., де Ламбаллери X, Фальконар А.К., Дживанян Т.И., Гулд Э.А. (2001). «Филогенетические связи флавивирусов коррелируют с их эпидемиологией, ассоциацией заболеваний и биогеографией» . Джей Ген Вирол . 82 (8): 1867–1876. дои : 10.1099/0022-1317-82-8-1867 . ПМИД 11457992 .
- ^ Бэмфорд CGG, де Соуза WM, Парри Р., Гиффорд Р.Дж. (2022). «Сравнительный анализ закодированных в геноме вирусных последовательностей раскрывает эволюционную историю флавивиридов (семейства Flaviviridae)» . Вирус Эвол . 8 (2): veac085. дои : 10.1093/ve/veac085 . ПМЦ 9752770 . ПМИД 36533146 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Кук С., Холмс ЕС (2006). «Мультигенный анализ филогенетических взаимоотношений между флавивирусами (семейство: Flaviviridae) и эволюция векторной передачи» . Арх Вирол . 151 (2): 309–325. дои : 10.1007/s00705-005-0626-6 . ПМИД 16172840 .
- ^ Конвей М.Дж. (2015). «Идентификация последовательности флавивируса у морских членистоногих» . ПЛОС ОДИН . 10 (12): e0146037. Бибкод : 2015PLoSO..1046037C . дои : 10.1371/journal.pone.0146037 . ПМЦ 4699914 . ПМИД 26717191 .
- ^ Jump up to: а б Парри Р., Асгари С. (2019). «Открытие новых флавивирусов ракообразных и головоногих: понимание эволюции и циркуляции флавивирусов между морскими беспозвоночными и позвоночными-хозяевами» . Дж Вирол . 93 (14). дои : 10.1128/JVI.00432-19 . ПМК 6600200 . PMID 31068424 .
- ^ Ши М., Линь XD, Чен X, Тянь Дж.Х., Чен Л.Дж., Ли К. и др. (2018). «Эволюционная история РНК-вирусов позвоночных» . Природа . 556 (7700): 197–202. Бибкод : 2018Natur.556..197S . дои : 10.1038/s41586-018-0012-7 . ПМИД 29618816 . S2CID 256771319 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Муро Дж., Кук С., Леми П., Нугаирид А., Форрестер Н.Л., Хаснатинов М., Чаррел Р.Н., Ферт А.Е., Гулд Э.А., Де Ламбаллери X (2015). «Новое понимание эволюции, таксономии и биогеографической истории флавивирусов, расширенное за счет анализа канонических и альтернативных последовательностей кодирования» . ПЛОС ОДИН . 10 (2): e0117849. Бибкод : 2015PLoSO..1017849M . дои : 10.1371/journal.pone.0117849 . ПМЦ 4342338 . ПМИД 25719412 .
- ^ Галли М., Бернини Ф., Зехендер Дж. (июль 2004 г.). «Александр Великий и вирусный энцефалит Западного Нила» . Возникающая инфекция. Дис . 10 (7): 1330–2, ответ автора 1332–3. дои : 10.3201/eid1007.040396 . ПМИД 15338540 .
- ^ Уэст, Кристи (8 февраля 2010 г.). «Развитие генетической линии вируса Западного Нила?» . Лошадь . Проверено 10 февраля 2010 г. Из выступлений Орсоли Кутаси, доктора ветеринарной медицины из Университета Сент-Иштван, Венгрия, на съезде Американской ассоциации практикующих лошадей 2009 г., 5–9 декабря 2009 г.
- ^ Вентер М., Хуман С., ван Никерк С., Уильямс Дж., ван Иден С., Фриман Ф. (август 2011 г.). «Смертельное неврологическое заболевание и аборт у кобыл, инфицированных вирусом Западного Нила линии 1, Южная Африка» . Возникающая инфекция. Дис . 17 (8): 1534–6. дои : 10.3201/eid1708.101794 . ПМК 3381566 . ПМИД 21801644 .
- ^ Сент-Леже Дж., Ву Дж., Андерсон М., Далтон Л., Нильсон Э., Ван Д. (2011). «Вирусная инфекция Западного Нила у косатки, Техас, США, 2007 г.» . Возникающая инфекция. Дис . 17 (8): 1531–3. дои : 10.3201/eid1708.101979 . ПМЦ 3381582 . ПМИД 21801643 .
- ^ Каран Л.С., Чикоцци М., Якименко В.В., Прести А.Л., Селла Е., Зехендер Г., Резза Г., Платонов А.Е. (2014). «Выведенная эволюционная история вируса омской геморрагической лихорадки» Журнал медицинской вирусологии . 86 (7): 1181–1187. дои : 10.1002/jmv.23856 . ПМИД 24259273 . S2CID 36929638 .
- ^ «Международный комитет по таксономии вирусов (ICTV)» . talk.ictvonline.org . Проверено 16 ноября 2020 г.
- ^ Робин Ю, Корнет М, Ле Гонидек Г, Шато Р, Гем Г (1978). «[Вирус Кедугу (Ar D14701): новый арбовирус («Флавивирус»), выделенный в Сенегале (перевод автора)]» . Анн Микробиол (Париж) . 129 (2): 239–44. ПМИД 677616 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Янсен ван Вурен П., Парри Р., Хромых А.А., Павеска Дж.Т. (2021). «Изолят вируса Кедугу (KEDV) 1958 года из Ндуму, Южная Африка, расширяет географический и временной диапазон KEDV в Африке» . Вирусы . 13 (7): 1368. дои : 10.3390/v13071368 . ПМК 8309962 . ПМИД 34372574 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ ван ден Хурк А.Ф., Суен В.В., Холл Р.А., О'Брайен К.А., Билефельдт-Оманн Х., Хобсон-Питерс Дж., Колмант А.М. (2016). «Недавно обнаруженный флавивирус из группы вирусов желтой лихорадки демонстрирует ограниченную репликацию у позвоночных» . Журнал общей вирусологии . 97 (5): 1087–1093. дои : 10.1099/jgv.0.000430 . ПМИД 26878841 . S2CID 43127614 .
- ^ Jump up to: а б с д и Парри Р., Асгари С. (15 июля 2019 г.). «Открытие новых флавивирусов ракообразных и головоногих: понимание эволюции и циркуляции флавивирусов между морскими беспозвоночными и позвоночными-хозяевами» . Журнал вирусологии . 93 (14). дои : 10.1128/JVI.00432-19 . ПМК 6600200 . PMID 31068424 .
- ^ Тисякорн У (2014). «Последние разработки и будущие направления в области вакцин против денге» . Терапевтические достижения в области вакцин . 2 (1): 3–9. дои : 10.1177/2051013613507862 . ПМЦ 3991153 . ПМИД 24757522 .
- ^ Яуч Л.Е. (2014). Разработка вакцины против вируса денге . Достижения в области исследования вирусов. Том. 88. стр. 315–372. дои : 10.1016/B978-0-12-800098-4.00007-6 . ISBN 978-0-12-800098-4 . ПМИД 24373316 .
- ^ «Вопросы и ответы ВОЗ по вакцинам против денге» . ВОЗ.int . Проверено 1 октября 2016 г.
- ^ Флинт Дж., Раканиелло В.Р., Ралл Г.Ф., Хациянну Т., Скалка А.М. (3 августа 2020 г.). Принципы вирусологии, Том 2: Патогенез и контроль (5-е изд.). Джон Уайли и сыновья. п. 327. ИСБН 978-1-68367-283-8 .
Дальнейшее чтение
[ редактировать ]- Куно Дж., Чанг Г.Дж., Цучия К.Р., Карабацос Н., Кропп CB (январь 1998 г.). «Филогения рода Flavivirus » . Дж Вирол . 72 (1): 73–83. doi : 10.1128/JVI.72.1.73-83.1998 . ПМК 109351 . ПМИД 9420202 .
- Занотто П.М., Гулд Э.А., Гао Г.Ф., Харви П.Х., Холмс Э.К. (1996). «Популяционная динамика флавивирусов, выявленная с помощью молекулярной филогении» . Труды Национальной академии наук . 93 (2): 548–553. Бибкод : 1996PNAS...93..548Z . дои : 10.1073/pnas.93.2.548 . ПМК 40088 . ПМИД 8570593 .
- Калицкий М (2006). Молекулярная биология флавивируса . Уаймондхэм: Horizon Bioscience. ISBN 978-1-904933-22-9 .
- Ши ПЯ (2012). Молекулярная вирусология и контроль флавивирусов . Норфолк, Великобритания: Caister Academic Press. ISBN 978-1-904455-92-9 .
- Мюррей CL, Джонс CT, Райс CM (2008). «Архитекторы сборки: роль неструктурных белков Flaviviridae в морфогенезе вирионов» . Обзоры природы Микробиология . 6 (9): 699–708. дои : 10.1038/nrmicro1928 . ПМЦ 2764292 . ПМИД 18587411 .
Внешние ссылки
[ редактировать ]- MicrobiologyBytes: Флавивирусы
- Институт тропических болезней Novartis (NITD) – исследование лихорадки денге в Институте тропических болезней Novartis (NITD)
- Dengueinfo.org - Хранилище данных геномной последовательности вируса денге.
- Viralzone : Flavivirus. Архивировано 13 июня 2010 г. в Wayback Machine.
- База данных и ресурс анализа вирусных патогенов (ViPR): Flaviviridae
- Запись Rfam для стволовой петли 3'UTR флавивируса IV
- Запись Rfam для элемента базы данных флавивирусов
- Запись Rfam для цис-действующего репликационного элемента 3' UTR флавивируса (CRE)
- Запись Rfam для структуры шпильки вируса японского энцефалита (JEV). [ постоянная мертвая ссылка ]