Нигростриарный путь
| Нигростриарный путь | |
|---|---|
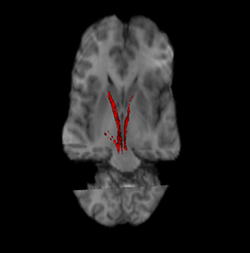 Нигростриатный путь (слева и справа выделены красным). | |
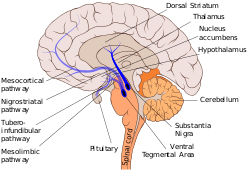 Нигростриатный путь показан здесь сплошным синим цветом и соединяет черную субстанцию с дорсальным полосатым телом. | |
| Анатомическая терминология |
Нигростриарный путь — это двусторонний дофаминергический путь в головном мозге, который соединяет черной субстанции компактную часть (SNc) в среднем мозге с дорсальным полосатым телом (т. е. хвостатым ядром и скорлупой ) в переднем мозге. Это один из четырех основных путей дофамина в мозге, который играет решающую роль в обеспечении движения как часть системы, называемой моторной петлей базальных ганглиев . Дофаминергические нейроны этого пути высвобождают дофамин из окончаний аксонов, которые образуют синапсы с шиповидными нейронами ГАМКергической среды (MSN), также известными как шипиковые проекционные нейроны (SPN). [1] [2] располагается в полосатом теле.
Дегенерация дофаминергических нейронов SNc является одним из основных патологических особенностей болезни Паркинсона . [3] что приводит к заметному снижению функции дофамина и симптоматическому двигательному дефициту болезни Паркинсона, включая гипокинезию , тремор , ригидность и постуральный дисбаланс .
Анатомия
[ редактировать ]Связь между компактной частью черной субстанции и дорсальным полосатым телом опосредована дофаминергическими аксонами.
компактная черная субстанция (SNc)
[ редактировать ]расположена Черная субстанция в вентральной части среднего мозга каждого полушария. Он состоит из двух отдельных частей: компактной части (SNc) и сетчатой части (SNr). Компактная часть содержит дофаминергические нейроны из группы клеток А9 , которые образуют нигростриарный путь, который, поставляя дофамин в полосатое тело , передает информацию в базальные ганглии . Напротив, сетчатая часть содержит в основном ГАМКергические нейроны.
SNc состоит из тонкой полосы клеток, которая покрывает SNr и расположена латеральнее группы A10 дофаминергических нейронов в вентральной покрышке (VTA), которая формирует мезолимбический дофаминовый путь . SNc легко визуализируется на срезах человеческого мозга, поскольку дофаминовые нейроны содержат черный пигмент нейромеланин , который, как известно, накапливается с возрастом. [4] Тела дофаминергических клеток в SNc плотно упакованы примерно от 200 000 до 420 000 дофаминовых клеток в SNc человека и от 8 000 до 12 000 дофаминовых клеток в SNc мыши. [5] Эти тела дофаминовых клеток локализованы в одном из двух химически определенных слоев. [6] Те, что находятся в верхнем слое (или дорсальном слое ), содержат связывающий белок под названием кальбиндин -D28K , который может буферизировать уровень кальция внутри клетки, когда он становится слишком высоким или токсичным. Дофаминовые клетки нижнего слоя (или вентрального слоя ) лишены этого белка и более уязвимы к воздействию нейротоксинов (например, МФТП ), которые могут вызывать симптомы, подобные болезни Паркинсона. [7] [8] Дофаминовые клетки дорсального уровня имеют дендриты , которые расходятся горизонтально через компактную часть, тогда как дофаминовые клетки вентрального уровня имеют дендриты, которые простираются вентрально в сетчатую часть. [6] [9]
Дофаминергические аксоны
[ редактировать ]Аксоны (на одной и той дофаминовых нейронов исходят из первичного дендрита и проецируются ипсилатерально же стороне) через медиальный пучок переднего мозга в дорсальное полосатое тело. Существует грубая топографическая корреляция между анатомической локализацией тела дофаминовой клетки внутри SNc и областью окончания в дорсальном полосатом теле. Дофаминергические клетки в латеральных частях SNc проецируются в основном в латеральную и каудальную (заднюю) части полосатого тела, тогда как дофаминовые клетки в медиальных SNc проецируются в медиальное полосатое тело. [10] [9] Кроме того, дофаминовые клетки дорсального слоя проецируются в вентромедиальное полосатое тело, тогда как нейроны вентрального уровня проецируются в дорсальное хвостатое ядро и скорлупу. [6] [9] В целом, наблюдается большая плотность дофаминергического поступления в дорсолатеральное полосатое тело. [9]
Каждый дофаминовый нейрон имеет чрезвычайно большую немиелиновую ветвь аксонов, которая может иннервировать до 6% объема полосатого тела у крысы. [11] Хотя все дофаминовые клетки SNc проецируются как в стриосому (или участок), так и в матриксный нейрохимический компартмент стриатума, большая часть аксональной территории нейрона дорсального уровня находится в матричном компартменте, в то время как большая часть аксонального поля нейронов вентрального яруса находится в стриосомы. [6] [10] [11] Нигростриарные аксоны дофамина также могут давать начало коллатералям аксонов, которые проецируются в другие области мозга. Например, некоторые нигростриарные дофаминовые аксоны SNc посылают коллатерали аксонов в педункулопонтинное ядро , вентральное паллидум , субталамическое ядро , бледный шар , миндалевидное тело и таламус . [6] [9] [12]
Небольшое количество дофаминовых нейронов дорсального яруса SNc также проецируются непосредственно в кору, хотя большая часть дофаминергической иннервации коры исходит от соседних дофаминовых нейронов VTA. [9]
Дорсальное полосатое тело
[ редактировать ]Дорсальное полосатое тело расположено в подкорковой области переднего мозга . У приматов и других млекопитающих он разделен передней конечностью тракта белого вещества , называемого внутренней капсулой. [13] на две части: хвостатое ядро и скорлупу . [14] У грызунов внутренняя капсула развита слабо, поэтому хвостатое ядро и скорлупа не разделены, а образуют одно большое образование, называемое хвостатой скорлупой (CPu). [15] [16] Большинство (около 95%) клеток дорсального полосатого тела представляют собой ГАМКергические средние шиповидные нейроны (MSN), также известные как шипиковые проекционные нейроны (SPN). Примерно половина этих MSN содержат рецепторы дофамина D1 и проецируются непосредственно на черную субстанцию, образуя прямой путь к базальным ганглиям, тогда как другая половина экспрессирует рецепторы дофамина D2 , которые проецируются опосредованно на черную субстанцию через бледный шар и субталамическое ядро, образуя непрямой путь базальных ганглиев. [17] Остальные 5% клеток представляют собой интернейроны , которые являются либо холинергическими нейронами, либо холинергическими нейронами. [18] или один из нескольких типов ГАМКергических нейронов. [19] Аксоны и дендриты этих интернейронов остаются внутри полосатого тела.
Хвостатое ядро и скорлупа получают возбуждающую информацию из всех областей коры головного мозга . [20] Эти глутаматергические входы обычно топографически организованы таким образом, что скорлупа получает информацию в основном из сенсомоторной коры, тогда как хвостатое ядро получает информацию в основном из ассоциативной коры. [20] Кроме того, дорсальное полосатое тело получает возбуждающие сигналы от других структур мозга, таких как таламус. [21] и незначительные возбуждающие сигналы от гиппокампа и миндалевидного тела .
Дорсальное полосатое тело содержит нейрохимически определенные компартменты, называемые стриосомами (также известными как пятна), которые демонстрируют плотное окрашивание мю-опиоидных рецепторов, встроенное в матричный компартмент, содержащий высшую ацетилхолинэстеразу и кальбиндин-D28K. [22]
Дофаминергические окончания аксонов синапса нигростриарного пути соединяются с ГАМКергическими MSN в дорсальном полосатом теле. Они образуют синапсы на теле клетки и в областях дендритных стержней, но в основном на шейках дендритных отростков , которые также получают глутаматергический входной сигнал к головкам тех же дендритных отростков. [1]
Функция
[ редактировать ]Основная функция нигростриарного пути — влияние на произвольные движения через двигательные петли базальных ганглиев. Наряду с мезолимбическими и мезокортикальными дофаминергическими путями нигростриарный путь дофамина может также влиять на другие функции мозга, включая познание . [23] награда и зависимость . [24] Нигростриарные дофаминергические нейроны демонстрируют тонические и фазовые паттерны активности нейронов. Это может привести к различным закономерностям высвобождения дофамина из окончаний аксонов в дорсальном полосатом теле, а также из тела клетки (сомы) и дендритов в SNc и SNr. [25] [26] Помимо высвобождения дофамина, некоторые аксоны нигростриарного пути также могут совместно высвобождать ГАМК. [27] [28]

Нигростриарный путь влияет на движение двумя путями: прямым путем движения и непрямым путем движения . [29] [30]
Прямой путь движения
[ редактировать ]Прямой путь участвует в облегчении желаемых движений . Проекции дофаминовых D1-рецепторов, содержащих средние шиповидные нейроны в хвостатом ядре и синапсе скорлупы, на тонически активные ГАМКергические клетки сетчатой части черной субстанции и внутреннего сегмента бледного шара (GPi), которые затем проецируются в таламус. Поскольку стриатонигральный/стриатоэнтопедункулярный и нигроталамический пути являются тормозящими, активация прямого пути создает общий чистый возбуждающий эффект на таламус и на движения, генерируемые моторной корой.
Непрямой путь движения
[ редактировать ]Косвенный путь участвует в подавлении нежелательного движения . Проекции дофаминовых D2-рецепторов, содержащих средние шиповидные нейроны в хвостатом ядре и синапсе скорлупы, на тонически активные ГАМКергические клетки во внешнем сегменте бледного шара (GPe), которые затем проецируются на сетчатую часть черной субстанции через возбуждающее субтальмическое ядро (STN). ). Поскольку стриатопаллидный и нигроталамический пути являются тормозящими, а путь от субталамического к черному является возбуждающим, активация непрямого пути создает общий общий тормозящий эффект на таламус и на движения моторной коры.
Клиническое значение
[ редактировать ]болезнь Паркинсона
[ редактировать ]Болезнь Паркинсона характеризуется серьезными двигательными проблемами, главным образом гипокинезией , ригидностью, тремором и постуральным дисбалансом. [31] Потеря дофаминовых нейронов нигростриарного пути является одной из основных патологических особенностей болезни Паркинсона. [32] Дегенерация нейронов, продуцирующих дофамин, в компактной части черной субстанции и хвостатом комплексе скорлупы приводит к снижению концентрации дофамина в нигростриарном пути, что приводит к снижению функции и появлению характерных симптомов. [33] Симптомы заболевания обычно не проявляются до тех пор, пока не потеряется 80–90% функции дофамина.
Другая гипотеза предполагает, что болезнь Паркинсона — это дисбаланс между дофамином (ДА) и ацетилхолином (АХ) в дорсальном полосатом теле, а не просто дефицит дофамина. [34]
Леводопа-индуцированная дискинезия
[ редактировать ]Леводопа-индуцированные дискинезии (ЛИД) — осложнение, связанное с длительным применением лечения болезни Паркинсона L-ДОФА , характеризующееся непроизвольными движениями и мышечными сокращениями. Это нарушение возникает у 90% пациентов после 9 лет лечения. Применение L-ДОФА у пациентов может привести к прерыванию нигростриатальных проекций дофамина, а также к изменениям в постсинаптических нейронах базальных ганглиев. [35]
Шизофрения
[ редактировать ]Пресинаптический метаболизм дофамина изменяется при шизофрении . [36] [37]
Другие пути дофамина
[ редактировать ]Другие основные пути дофамина включают:
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Дэвид Смит, А.; Пол Болам, Дж. (1 июля 1990 г.). «Нейронная сеть базальных ганглиев, выявленная в результате изучения синаптических связей идентифицированных нейронов». Тенденции в нейронауках . 13 (7): 259–265. дои : 10.1016/0166-2236(90)90106-К . ISSN 0166-2236 . ПМИД 1695400 . S2CID 4018397 .
- ^ Трич, Северная Каролина; Дин, Джей Би; Сабатини, Б.Л. (октябрь 2012 г.). «Дофаминергические нейроны ингибируют выход полосатого тела за счет неканонического высвобождения ГАМК» . Природа . 490 (7419): 262–6. Бибкод : 2012Natur.490..262T . дои : 10.1038/nature11466 . ПМЦ 3944587 . ПМИД 23034651 .
- ^ Диас, Хайме. Как наркотики влияют на поведение. Энглвудские скалы: Прентис-холл, 1996.
- ^ Зукка, Фабио А.; Басс, Эми; Купайоли, Франческа А.; Феррари, Эмануэле; Зульцер, Дэвид; Казелла, Луиджи; Зекка, Луиджи (январь 2014 г.). «Нейромеланин черной субстанции человека: обновление». Исследования нейротоксичности . 25 (1): 13–23. дои : 10.1007/s12640-013-9435-y . ISSN 1476-3524 . ПМИД 24155156 . S2CID 8372724 .
- ^ Брихта, Ларс; Грингард, Пол (2014). «Молекулярные детерминанты избирательной дофаминергической уязвимости при болезни Паркинсона: обновленная информация» . Границы нейроанатомии . 8 : 152. дои : 10.3389/fnana.2014.00152 . ISSN 1662-5129 . ПМК 4266033 . ПМИД 25565977 .
- ^ Перейти обратно: а б с д и Пренса, Л.; Хименес-Амайя, Ж.М.; Родитель, А.; Бернасер, Дж.; Себриан, К. (2009). «Нигростриарный путь: аксональная коллатерализация и компартментальная специфичность». Рождение, жизнь и смерть дофаминергических нейронов черной субстанции . стр. 49–58. дои : 10.1007/978-3-211-92660-4_4 . ISBN 978-3-211-92659-8 . ISSN 0303-6995 . ПМИД 20411767 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Немото, К.; Хида, Т.; Арай, Р. (30 октября 1999 г.). «Калретинин и кальбиндин-D28k в дофаминергических нейронах среднего мозга крыс: иммуногистохимическое исследование с тройным мечением». Исследования мозга . 846 (1): 129–136. дои : 10.1016/s0006-8993(99)01950-2 . ISSN 0006-8993 . ПМИД 10536220 . S2CID 26684957 .
- ^ Допесо-Рейес, Ирия Г.; Рико, Альберто Дж.; Рода, Эльвира; Сьерра, Сальвадор; Пиньятаро, Диего; Ланц, Мария; Сукунца, Диего; Чанг-Азанкот, Луис; Лансьего, Хосе Л. (2014). «Содержание кальбиндина и дифференциальная уязвимость эфферентных дофаминергических нейронов среднего мозга у макак» . Границы нейроанатомии . 8 : 146. дои : 10.3389/fnana.2014.00146 . ISSN 1662-5129 . ПМК 4253956 . ПМИД 25520629 .
- ^ Перейти обратно: а б с д и ж Хабер, С.Н. (12 декабря 2014 г.). «Место дофамина в цепи кортико-базальных ганглиев» . Нейронаука . 282 : 248–257. doi : 10.1016/j.neuroscience.2014.10.008 . ISSN 1873-7544 . ПМЦ 5484174 . ПМИД 25445194 .
- ^ Перейти обратно: а б Герфен, ЧР; Херкенхэм, М.; Тибо, Дж. (декабрь 1987 г.). «Неостриатальная мозаика: II. Патч- и матриксно-ориентированные мезостриатальные дофаминергические и недофаминергические системы» . Журнал неврологии . 7 (12): 3915–3934. doi : 10.1523/JNEUROSCI.07-12-03915.1987 . ISSN 0270-6474 . ПМК 6569093 . ПМИД 2891799 .
- ^ Перейти обратно: а б Мацуда, Вакото; Фурута, Такахиро; Накамура, Коичи К.; Хиоки, Хироюки; Фудзияма, Фумино; Арай, Рёхачи; Канеко, Такеши (14 января 2009 г.). «Одиночные нигростриарные дофаминергические нейроны образуют широко распространенные и очень плотные аксональные разветвления в неостриатуме» . Журнал неврологии . 29 (2): 444–453. doi : 10.1523/JNEUROSCI.4029-08.2009 . ISSN 1529-2401 . ПМК 6664950 . ПМИД 19144844 .
- ^ Пренса, Л.; Родитель, А. (15 сентября 2001 г.). «Нигростриатный путь у крыс: одноаксонное исследование взаимоотношений между черными нейронами дорсального и вентрального ярусов и стриатальными отсеками стриосомы/матрикса» . Журнал неврологии . 21 (18): 7247–7260. doi : 10.1523/JNEUROSCI.21-18-07247.2001 . ISSN 1529-2401 . ПМК 6762986 . ПМИД 11549735 .
- ^ Эмос, Марк Кристофер; Агарвал, Санджив (2019), «Нейроанатомия, внутренняя капсула» , StatPearls , StatPearls Publishing, PMID 31194338 , получено 6 октября 2019 г.
- ^ Май, Юрген К. (14 декабря 2015 г.). Атлас человеческого мозга . Майтаник, Милан, Паксинос, Джордж, 1944- (4-е изд.). Амстердам. ISBN 9780128028001 . OCLC 934406284 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Куазе, Вероника; Хейлброннер, Сара Р.; Карсенак, Кэрол; Майли, Филипп; Леман, Джулия Ф.; Саваста, Марк; Дэвид, Оивье; Денио, Жан-Мишель; Гроневеген, Хенк Дж.; Хабер, Сюзанна Н. (8 марта 2017 г.). «Организация передней конечности внутренней капсулы у крысы» . Журнал неврологии . 37 (10): 2539–2554. doi : 10.1523/JNEUROSCI.3304-16.2017 . ISSN 1529-2401 . ПМЦ 5354315 . ПМИД 28159909 .
- ^ Паксинос, Джордж, 1944- (07.11.2013). Мозг крысы в стереотаксических координатах . Уотсон, Чарльз, 1943- (Седьмое изд.). Амстердам. ISBN 9780123919496 . OCLC 859555862 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Герфен, Чарльз Р.; Сюрмайер, Д. Джеймс (2011). «Модуляция дофамином проекционных систем полосатого тела» . Ежегодный обзор неврологии . 34 : 441–466. doi : 10.1146/annurev-neuro-061010-113641 . ISSN 1545-4126 . ПМЦ 3487690 . ПМИД 21469956 .
- ^ Гонсалес, Калинда К.; Смит, Иоланд (сентябрь 2015 г.). «Холенергические интернейроны в дорсальном и вентральном полосатом теле: анатомические и функциональные аспекты в норме и при заболеваниях» . Анналы Нью-Йоркской академии наук . 1349 (1): 1–45. Бибкод : 2015NYASA1349....1G . дои : 10.1111/nyas.12762 . ISSN 1749-6632 . ПМЦ 4564338 . ПМИД 25876458 .
- ^ Теппер, Джеймс М.; Коос, Тибор; Ибаньес-Сандовал, Освальдо; Текуапетла, Фатуэль; Фауст, Томас В.; Ассус, Максим (2018). «Гетерогенность и разнообразие стриарных ГАМКергических интернейронов: обновление 2018 г.» . Границы нейроанатомии . 12:91 . дои : 10.3389/fnana.2018.00091 . ISSN 1662-5129 . ПМК 6235948 . PMID 30467465 .
- ^ Перейти обратно: а б Хабер, Сюзанна Н. (март 2016 г.). «Кортикостриарная схема» . Диалоги в клинической неврологии . 18 (1): 7–21. doi : 10.31887/DCNS.2016.18.1/shaber . ISSN 1958-5969 . ПМЦ 4826773 . ПМИД 27069376 .
- ^ Смит, Иоланд; Гальван, Адриана; Эллендер, Томмас Дж.; Дойг, Натали; Вильяльба, Роза М.; Уэрта-Окампо, Икнелия; Вихманн, Томас; Болам, Дж. Пол (2014). «Таламостриатальная система в норме и при патологии» . Границы системной нейронауки . 8 : 5. дои : 10.3389/fnsys.2014.00005 . ISSN 1662-5137 . ПМК 3906602 . ПМИД 24523677 .
- ^ Бримблкомб, Кэтрин Р.; Крэгг, Стефани Дж. (15 февраля 2017 г.). «Стриосомы и матричные отделы полосатого тела: путь через лабиринт от нейрохимии к функции» . ACS Химическая нейронаука . 8 (2): 235–242. дои : 10.1021/acschemneuro.6b00333 . ISSN 1948-7193 . ПМИД 27977131 .
- ^ Бут, Натали; Баас, Маттейс; ван Гал, Саймон; Круто, Рошан; Де Дре, Карстен К.В. (июль 2017 г.). «Творческое познание и дофаминергическая модуляция лобно-полосатых сетей: интегративный обзор и программа исследований». Неврологические и биоповеденческие обзоры . 78 : 13–23. doi : 10.1016/j.neubiorev.2017.04.007 . ISSN 1873-7528 . ПМИД 28419830 . S2CID 21315163 .
- ^ Уайз, РА (октябрь 2009 г.). «Роль нигростриарного, а не только мезокортиколимбического, дофамина в вознаграждении и зависимости» . Тенденции в нейронауках . 32 (10): 517–524. дои : 10.1016/j.tins.2009.06.004 . ПМЦ 2755633 . ПМИД 19758714 .
- ^ Райс, Мэн; Патель, Дж. К.; Крэгг, SJ (15 декабря 2011 г.). «Выброс дофамина в базальных ганглиях» . Нейронаука . 198 : 112–137. doi : 10.1016/j.neuroscience.2011.08.066 . ISSN 1873-7544 . ПМЦ 3357127 . ПМИД 21939738 .
- ^ Райс, Маргарет Э.; Патель, Джиоти К. (05 июля 2015 г.). «Соматодендритное высвобождение дофамина: последние механистические открытия» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 370 (1672): 20140185. doi : 10.1098/rstb.2014.0185 . ISSN 1471-2970 . ПМЦ 4455754 . ПМИД 26009764 .
- ^ Трич, Николас X.; Грейнджер, Адам Дж.; Сабатини, Бернардо Л. (март 2016 г.). «Механизмы и функции совместного высвобождения ГАМК» . Обзоры природы. Нейронаука . 17 (3): 139–145. дои : 10.1038/nrn.2015.21 . ISSN 1471-0048 . ПМК 6980171 . ПМИД 26865019 .
- ^ Трюдо, Луи-Эрик; Хнаско, Томас С.; Валлен-Маккензи, Аса; Моралес, Марисела; Рэйпорт, Стивен; Зульцер, Дэвид (2014). «Многоязычная природа дофаминовых нейронов». Дофамин . Прогресс в исследованиях мозга. Том. 211. стр. 141–164. дои : 10.1016/B978-0-444-63425-2.00006-4 . ISBN 9780444634252 . ISSN 1875-7855 . ПМЦ 4565795 . ПМИД 24968779 .
- ^ Кравиц, Алексей В.; Крейцер, Анатол К. (июнь 2012 г.). «Стриарные механизмы, лежащие в основе движения, подкрепления и наказания» . Физиология . 27 (3): 167–177. дои : 10.1152/физиол.00004.2012 . ISSN 1548-9221 . ПМЦ 3880226 . ПМИД 22689792 .
- ^ Кравиц, Алексей В.; Фриз, Бенджамин С.; Паркер, Филип Р.Л.; Кей, Кеннет; Твин, Мио Т.; Дейсерот, Карл; Крейцер, Анатоль К. (29 июля 2010 г.). «Регуляция паркинсонического двигательного поведения посредством оптогенетического контроля цепей базальных ганглиев» . Природа . 466 (7306): 622–626. Бибкод : 2010Natur.466..622K . дои : 10.1038/nature09159 . ISSN 1476-4687 . ПМЦ 3552484 . ПМИД 20613723 .
- ^ Ченчи, Анжела М (2006). «Пост- и пресинаптическая пластичность при дискинезии, индуцированной L-ДОФА» (PDF) . Журнал нейрохимии . 99 (2): 381–92. дои : 10.1111/j.1471-4159.2006.04124.x . ПМИД 16942598 . S2CID 9649270 .
- ^ Дойменс, Рональд (21 июня 2002 г.). «Моделирование болезни Паркинсона у крыс: оценка поражений 6-OHDA нигростриарного пути». Экспериментальная неврология . 175 (2): 303–17. doi : 10.1006/exnr.2002.7891 . ПМИД 12061862 . S2CID 2770493 .
- ^ Грогер, Адрен (8 января 2014 г.). «Снижение дофамина в черной субстанции у пациентов с болезнью Паркинсона, подтвержденное с помощью магнитно-резонансной спектроскопии in vivo» . ПЛОС ОДИН . 9 (1): e84081. Бибкод : 2014PLoSO...984081G . дои : 10.1371/journal.pone.0084081 . ПМЦ 3885536 . ПМИД 24416192 .
- ^ Шпельманн, Райнер; Шталь, Стивен М. (3 апреля 1976 г.). «ДФАМИНО-АЦЕТИЛХОЛИНОВЫЙ ДИСБАЛАНС ПРИ БОЛЕЗНИ ПАРКИНСОНА: Возможный регенеративный разрастание холинергических аксонных терминалей» . Ланцет . Первоначально опубликовано как Том 1, выпуск 7962. 307 (7962): 724–726. дои : 10.1016/S0140-6736(76)93095-6 . ISSN 0140-6736 . ПМИД 56538 . S2CID 26024410 .
- ^ Нитхаммер, Мартин (май 2012 г.). «Функциональная нейровизуализация при болезни Паркинсона» . Перспективы Колд-Спринг-Харбора в медицине . 2 (5): а009274. doi : 10.1101/cshperspect.a009274 . ПМЦ 3331691 . ПМИД 22553499 .
- ^ Фусар-Поли, Паоло; Мейер-Линденберг, Андреас (1 января 2013 г.). «Стриарный пресинаптический дофамин при шизофрении, часть II: метаанализ исследований [(18)F/(11)C]-DOPA ПЭТ» . Бюллетень шизофрении . 39 (1): 33–42. дои : 10.1093/schbul/sbr180 . ISSN 1745-1701 . ПМЦ 3523905 . ПМИД 22282454 .
- ^ Вайнштейн, Джоди Дж.; Чохан, Мухаммад О.; Слифштейн, Марк; Кегелес, Лоуренс С.; Мур, Холли; Аби-Даргам, Анисса (1 января 2017 г.). «Нарушения, специфичные для путей дофамина при шизофрении» . Биологическая психиатрия . 81 (1): 31–42. doi : 10.1016/j.biopsych.2016.03.2104 . ISSN 1873-2402 . ПМК 5177794 . ПМИД 27206569 .