Реакция гидразонового алкилирования Эндерса SAMP/RAMP
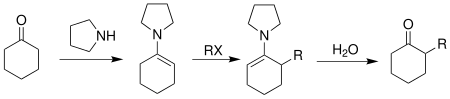
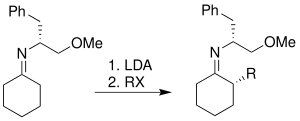
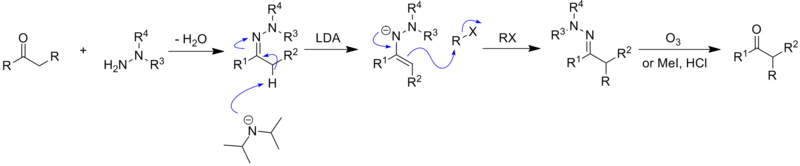
Реакция алкилирования гидразона Эндерса SAMP/RAMP представляет собой реакцию образования асимметричной углерод-углерод, связи которой способствуют пирролидиновые хиральные вспомогательные вещества . Впервые его придумали Э. Дж. Кори и Дитер Эндерс в 1976 году. [ 1 ] и получил дальнейшее развитие Эндерса и его группы. [ 2 ] Этот метод обычно представляет собой трехэтапную последовательность. Первым шагом является образование гидразона между ( S )-1-амино-2-метоксиметилпирролидином (SAMP) или ( R )-1-амино-2-метоксиметилпирролидином (RAMP) и кетоном или альдегидом . После этого гидразон депротонируется диизопропиламидом лития (LDA) с образованием азаенолята , который реагирует с алкилгалогенидами или другими подходящими электрофилами с образованием алкилированных разновидностей гидразона с одновременным образованием нового хирального центра . Наконец, алкилированный кетон или альдегид можно регенерировать путем озонолиза или гидролиза . [ 3 ]

Эта реакция является полезным методом асимметричного α-алкилирования кетонов и альдегидов, которые являются обычными синтетическими промежуточными соединениями для получения интересных с медицинской точки зрения натуральных продуктов и других родственных органических соединений . Эти натуральные продукты включают (-)-C10-деметил артеаннуин B, структурный аналог противомалярийного артемизинина, [ 4 ] полипропионатный метаболит (-)-дентикулатин А и В, выделенный из Siphonaria denticulata , [ 5 ] сарагозиновая кислота А, мощный ингибитор синтеза стеринов , [ 6 ] и эпотилон А и В, которые оказались очень эффективными противораковыми препаратами. [ 7 ]
История
[ редактировать ]Региоселективное и стереоселективное образование углерод-углеродных связей, прилегающих к карбонильной группе, является важной процедурой в органической химии. Реакция алкилирования енолятов была основным направлением этой области. И А.Г. Майерс, и Д.А. Эванс разработали реакции асимметричного алкилирования енолятов. [ 8 ] [ 9 ]

Очевидным недостатком реакций енолятного алкилирования является чрезмерное алкилирование, даже если количество основания, добавляемого для енолирования, а также температуру реакции тщательно контролируют. Образование кетена в процессе депротонирования для субстратов, содержащих оксазолидинон Эванса, также является основной побочной реакцией соответствующих реакций алкилирования. Развитие в области химии енаминов и использование иминных производных енолятов позволило обеспечить альтернативу реакциям енолятного алкилирования.
В 1963 г. Г. Сторк сообщил о первой реакции енаминного алкилирования кетонов — енаминного алкилирования Стора . реакции [ 10 ]
В 1976 году Мейерс сообщил о первой реакции алкилирования металлированных азаенолятов гидразонов вспомогательным веществом на основе ациклических аминокислот . По сравнению со свободными карбонильными соединениями и хиральными видами енаминов, о которых сообщалось ранее, гидразоны проявляют более высокую реакционную способность, региоселективность и стереоселективность . [ 11 ]
Комбинация производных циклических аминокислот ( SAMP и RAMP ) и мощных гидразонных методов была впервые предложена Э. Дж. Кори и Д. Эндерсом в 1976 году и позднее была независимо разработана Д. Эндерсом. И SAMP , и RAMP синтезируются из аминокислот. Подробный синтез этих двух вспомогательных веществ показан ниже. [ 12 ] [ 13 ]

Механизм
[ редактировать ]Алкилирование гидразона Enders SAMP/RAMP начинается с синтеза гидразона из N,N-диалкилгидразина и кетона или альдегида. [ 14 ]
Затем гидразон депротонируется по α-углеродному положению сильным основанием, таким как диизопропиламид лития (LDA), что приводит к образованию резонансно стабилизированного аниона - азаенолята. Этот анион является очень хорошим нуклеофилом и легко атакует электрофилы , такие как алкилгалогениды, с образованием алкилированных гидразонов с одновременным образованием нового хирального центра у α-углерода.
Стереохимия этой реакции подробно обсуждается в следующем разделе.
Стереохимия
[ редактировать ]Стереохимия азаенолята
[ редактировать ]После депротонирования гидразон превращается в азаенолят с катионом лития, хелатирующим как азот, так и кислород. Есть два возможных варианта хелатирования лития. Во-первых, литий антиперипланарен приводит к конформации ZCN связи C=C (синий цвет), что ; другой заключается в том, что литий и связь C = C находятся на одной стороне связи CN (красного цвета), что приводит к конформеру E CN . Также существуют две доступные ориентации хелатирующего азота и R. 2 группа, являющаяся либо E C=C , либо Z C=C . Это приводит к четырем возможным промежуточным соединениям азаенолата ( A , B , C и D ) для реакции алкилирования гидразона SAMP/RAMP Эндерса.
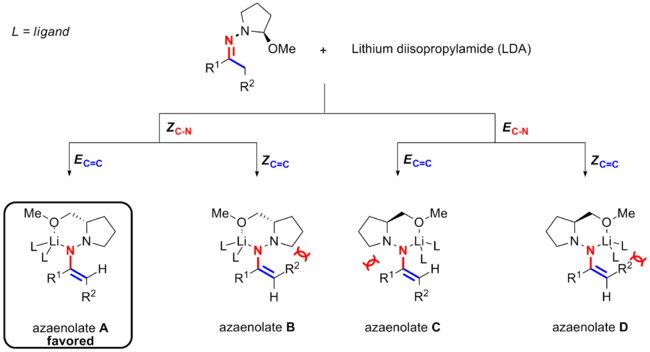
Эксперименты и расчеты [ 2 ] [ 15 ] [ 16 ] показывают, что один конкретный стереоизомер азаенолята предпочтительнее трех других возможных кандидатов. Следовательно, хотя для азаенолята возможны четыре изомера, только один (азаенолят A ), у которого стереохимия его двойных связей C=C является E, а стереохимия его связи CN - Z, является доминирующим (EC = C Z C-N ) для азаенолята. как циклические, так и ациклические кетоны. [ 17 ]
Стереохимия алкилирования
[ редактировать ]Предпочтительный азаенолат является доминирующей исходной молекулой для последующей реакции алкилирования. Есть два возможных пути доступа любого электрофила к реакции. Стерическое взаимодействие между пирролидиновым кольцом и электрофильным реагентом препятствует атаке электрофила с верхней грани. Напротив, когда электрофил атакует с нижней грани, такого неблагоприятного взаимодействия не существует. Следовательно, электрофильная атака исходит со стерически более доступной стороны. [ 18 ]

Варианты
[ редактировать ]Хелатирование лития катиона с метоксигруппой является одной из наиболее важных особенностей переходного состояния реакции гидразонового алкилирования Эндерса. Этот хелатирующий эффект необходим для достижения высокой стереоселективности . Разработка и модификация реакции алкилирования гидразона Эндерса в основном сосредоточены на добавлении большего количества стерических препятствий к пирролидиновым кольцам как SAMP, так и RAMP, сохраняя при этом метоксигруппу для хелатирования лития .
Наиболее известные четыре варианта SAMP и RAMP — это SADP, SAEP, SAPP и RAMBO. [ 19 ] [ 20 ] структуры которых показаны ниже.

В 2011 году несколько N-аминоциклических карбаматов были синтезированы и изучены в реакциях асимметричного гидразонового алкилирования. [ 21 ] Как стереохимия, так и региоселективность реакций оказались весьма перспективными. Эти новые соединения состоят из нового класса хиральных вспомогательных веществ, основанных на карбаматной структуре, и, следовательно, больше не принадлежат к семейству SAMP и RAMP. Но они представляют собой очень мощную альтернативу традиционным пирролидиновым системам.

Вспомогательный выпуск
[ редактировать ]Гидразоны обычно очень устойчивы к сольволизу , и превращение в кетон может потребовать энергичных условий. Кроме того, альдегидные гидразоны часто непропорциональны нитрилу и амину . [ 22 ]
две основные среды обработки Распространены : окисление и сольволиз. Восстановительные превращения возможны с низковалентными переходными металлами , но по состоянию на 2000 год оставались относительно неизученными. [update]. [ 22 ]
Окислительное расщепление имеет высокие выходы и используется наиболее часто. Озон или синглетный кислород могут озонолизировать диазеновую связь (и любые присутствующие олефиновые фрагменты), оставляя карбонил, нитрозамин и дикислород . Более мягкое окисление Лемье допускает ацетали и бензиловые эфиры . Пероксидные реагенты (например, NaBO 3 , ( t Bu 4 NSO 4 ) 2 или m -ClBzO 2 H ) расщепляют гидразон с различной скоростью, селективностью и механизмом, но окисление Байера-Виллигера является распространенной побочной реакцией. высоковалентных переходных металлов Оксигалогениды (например, WF 6 , CoF 3 , MoOCl 3 ), по-видимому, расщепляются главным образом посредством радикалов. Все, кроме озона и синглетного кислорода, образуют нитрилы из альдегидразонов в качестве основного или существенного второстепенного продукта. [ 22 ]
Некоторые электрофилы также выделяют нитрилы: хлорформиаты , сильно активированные алкины или метилиодид и затрудненное основание . Метилиодид полезен также для гидролиза: алкилированный гидразониййодид легко гидролизуется до карбонила и гидразоформы, а воздух расщепляет гидразоформ до гидразина и углекислого газа . [ 22 ]
самые разные кислоты Действительно, гидролизу способствуют . Трихлорид висмута расщепляет произвольные гидразоны в микроволновой печи . Щавелевая кислота отделяет гидразин от кетоновых гидразонов; оксалатный аддукт затем разлагается до исходного вспомогательного вещества в водной основе. Силикагель прекрасно гидролизует чувствительные к кислоте субстраты, но слишком слаб, чтобы воздействовать на кетоновые гидразоны, соседствующие с первичным углеродом . Кетоновые гидразоны, соседствующие с вторичным или третичным углеродом, гидролизуются в присутствии каталитических меди солей ; эта процедура также сохраняет субстраты, нарушенные окислителями или сильными кислотами. [ 22 ]
Эфират трифторида бора катализирует тиокетализацию , а пекарские дрожжи гидролизуют небиоактивные субстраты . [ 22 ]
Карбаматы гидразона расщепляются гораздо легче, чем их исходные гидразоны: пара-толуолсульфоновая кислота дает соответствующие кетоны с выходами, близкими к количественным. [ 21 ]

Условия
[ редактировать ]Реакция алкилирования гидразона Эндера обычно проходит в три этапа. [ 14 ] Первым шагом всегда должен быть синтез гидразонов. Кетон или альдегид смешивают либо с SAMP, либо с RAMP и оставляют реагировать в атмосфере аргона в течение 12 часов. Полученный сырой гидразон очищают перегонкой или перекристаллизацией . При температуре 0 градусов Цельсия гидразон переносят в эфирный раствор диизопропиламида лития. Затем эту смесь охлаждают до -110 градусов Цельсия и медленно добавляют алкилгалогенид. Затем этой смеси дают нагреться до комнатной температуры. После 12 часов реакции при комнатной температуре сырому алкилированному гидразону дают возможность вступить в реакцию с озоном в трубке Шленка с разрывом связи C=N. После перегонки или колоночной хроматографии можно получить чистый продукт алкилирования.
Приложения
[ редактировать ]Синтез зарагозовой кислоты А
[ редактировать ]К.С. Николау и его коллеги из Научно-исследовательского института Скриппса получили хиральный гидразон посредством реакции алкилирования гидразона Эндерса с высокой стереоселективностью ( de > 95%). Последующий озонолиз и реакция Виттига привели к получению фрагмента боковой цепи сарагозиевой кислоты А, которая является мощным лекарством от ишемической болезни сердца. [ 6 ]

Синтез дентикулатина А и В
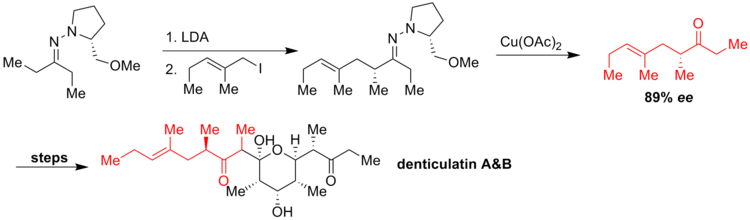
[ редактировать ]его коллеги прореагировали аллилиодид Циглер и с азаенолятом с образованием хиральной углеводородной цепи. Чтобы избежать потери энантиомерной чистоты продукта, авторы использовали ацетат меди для регенерации карбонильной группы, получив лишь умеренный выход при разрыве связи C=N, но хорошую энантиоселективность ( ее = 89%). Кетон после нескольких стадий трансформировался в дентикулатин А и В-полипропионатные метаболиты, выделенные из Siphonaria Denticulata . [ 5 ]
Синтез производного артеаннуина
[ редактировать ](-)-C 10 -деметил артеаннуин B является структурным аналогом противомалярийного артемизинина . Он проявляет мощную противомалярийную активность даже в отношении штамма, устойчивого к лекарствам. Литтл и его коллеги получили алкилированный гидразон в диастереомерно чистой форме ( de > 95%) посредством реакции алкилирования Эндерса. Это промежуточное соединение затем было преобразовано в (-)-C 10 -деметилартеаннуин B. [ 4 ]

Синтез эпотилона А
[ редактировать ]Сообщается, что эпотилоны А и В являются высокоэффективными противораковыми препаратами. Некоторые из их структурных производных демонстрируют весьма многообещающее ингибирование рака молочной железы с лишь легкими побочными эффектами, и некоторые из них сейчас проходят испытания. В 1997 году К.С. Николау и его коллеги сообщили о первом полном синтезе эпотилона А и В. Реакция алкилирования Эндера использовалась в самом начале синтеза для установки стереогенного центра в положении С8. Реакция протекала как с высоким выходом, так и с высокой диастереоселективностью. [ 7 ]

См. также
[ редактировать ]- Асимметричное алкилирование Майерса
- Алкилирование енамина аиста
- Реактивы Эндерса
- Реакция Хайоса-Пэрриша-Эдера-Зауэра-Вихерта
Ссылки
[ редактировать ]- ^ Кори, Э.Дж.; Эндерс, Д. (1976). «Применение N,N-диметилгидразонов в синтезе. Использование для эффективного, позиционно и стереохимически селективного образования связей CC; окислительный гидролиз до карбонильных соединений». Буквы тетраэдра . 17 (1): 3–6. дои : 10.1016/s0040-4039(00)71307-4 .
- ^ Jump up to: а б Курти, Л.; Чако, Б. (2005). Стратегическое применение названных реакций в органическом синтезе . Берлингтон, Массачусетс: Elsevier Academic Press. стр. 150–151. ISBN 0-12-369483-3 .
- ^ Иов, А.; Янек, CF; Беттрей, В.; Питерс, Р.; Эндерс, Д. (2002). «Методология SAMP-/RAMP-гидразона в асимметричном синтезе». Тетраэдр . 58 (12): 2253–2329. дои : 10.1016/s0040-4020(02)00080-7 .
- ^ Jump up to: а б Швебе, М.; Литтл, Р.Д. (1996). «Асимметричная восстановительная циклизация. Полный синтез (-)-C10-десметил артеаннуина B». Журнал органической химии . 61 (10): 3240–3244. дои : 10.1021/jo9600417 .
- ^ Jump up to: а б Зиглер, FE; Беккер, MR (1990). «Тотальный синтез (-)-дентикулатинов А и В: морские полипропионаты из Siphonaria denticulata». Журнал органической химии . 55 (2): 2800–2805. дои : 10.1021/jo00296a044 .
- ^ Jump up to: а б Надин, А.; Николау, КЦ (1996). «Химия и биология сарагозовых кислот (сквалестатинов)». Angewandte Chemie International Edition на английском языке . 35 (15): 1622–1656. дои : 10.1002/anie.199616221 .
- ^ Jump up to: а б Николау, КЦ; Нинкович, С.; Сарабия, Ф.; Вурлумис, Д.; Привет.; Вальберг, Х.; Финли, MRV; Ян, З. (1997). «Полный синтез эпотилонов A и B с помощью стратегии, основанной на макролактонизации». Журнал Американского химического общества . 119 (34): 7974–7991. дои : 10.1021/ja971110h .
- ^ Майерс, А.Г., Ян, Б.Х., Чен, Х., МакКинстри, Л. Копецки, DJ, Глисон, JL (1997). «Псевдоэфедрин как практическое хиральное вспомогательное средство для синтеза высокоэнантиомерно обогащенных карбоновых кислот, спиртов, альдегидов и кетонов». Журнал Американского химического общества . 119 (28): 6496–6511. дои : 10.1021/ja970402f .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Эванс, Д.А.; Эннис, доктор медицины; Матре, диджей (1982). «Реакции асимметричного алкилирования енолятов хиральных имидов. Практический подход к энантиоселективному синтезу производных α-замещенных карбоновых кислот». Журнал Американского химического общества . 104 (6): 1737–1739. дои : 10.1021/ja00370a050 .
- ^ Аист, Г.; Дауд, СР (1996). «Новый метод алкилирования кетонов и альдегидов: C-алкилирование магниевых солей N-замещенных иминов». Журнал Американского химического общества . 85 (14): 2178–2180. дои : 10.1021/ja00897a040 .
- ^ Мейерс, А.И.; Уильямс, доктор медицинских наук; Дрюлингер, М. (1976). «Энантиоселективное алкилирование циклогексанона с помощью хиральных литийхелатных енаминов». Журнал Американского химического общества . 98 (10): 3032–3033. дои : 10.1021/ja00426a068 .
- ^ Эндерс, Д.; Эйхенауэр, Х.; Питер, Р. (1979). «Энантиоселективный синтез (-)-(R)-и (+)-(S)-[6]-гингерол-приправы имбиря». Химические отчеты . 112 (11): 3703–3714. дои : 10.1002/cber.19791121118 .
- ^ Эндерс, Д.; Эйхенауэр, Х. (1979). «Асимметричные синтезы с помощью металлированных хиральных гидразонов. Энантиоселективное алкилирование циклических кетонов и альдегидов». Химические отчеты . 112 (8): 2933–2960. дои : 10.1002/cber.19791120820 .
- ^ Jump up to: а б Эндерс Д., Киппхардт Х., Фей1 П. (1987). «Асимметричный синтез с использованием метода SAMP-/RAMP-гидразона: (S)-(+)-4-метил-3-гептаноэ» (PDF) . Органические синтезы . 65 : 183. дои : 10.15227/orgsyn.065.0183 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) [ постоянная мертвая ссылка ] - ^ Альбрехт, Х.; Дюбер, Э.О.; Эндерс, Д.; Эйхенауэр, Х.; Вестер, П. (1978). «ЯМР-спектроскопические исследования депротонированных иминов и гидразонов». Буквы тетраэдра . 19 (39): 3691–3694. дои : 10.1016/s0040-4039(01)95032-4 .
- ^ Эндерс, Д.; Баус, У. (1983). «Асимметричный синтез обоих энантиомеров (Е)-4,6-диметил-6-октен-3-она - защитного вещества сенокосцев Leiobunum vittatum и L.calcar (Opiliones)». «Анналы химии» Либиха . 1983 (8): 1439–1445. дои : 10.1002/jlac.198319830816 .
- ^ Эндерс, Д.; Бахштедтер, Г.; Кремер, КАМ; Марш, М.; Хармс, К.; Бош, Г. (1988). «Структура хирального азаенолята лития: мономерный внутримолекулярный хелатный литио-2-ацетилнафталин-SAMP-гидразон». Angewandte Chemie International Edition на английском языке . 27 (11): 1522–1524. дои : 10.1002/anie.198815221 .
- ^ Бауэр, В.; Сибах, Д. (1984). «Определение степени агрегации литийорганических соединений методом криоскопии в тетрагидрофуране». Helvetica Chimica Acta . 67 (7): 1972–1988. дои : 10.1002/hlca.19840670736 .
- ^ Мартенс, Дж.; Люббен, С. (1990). «(1S,3S,5S)-2-Амино-3-метоксиметил-2-азабицикло[3.3.0]октан: САМБО — новый хиральный вспомогательный препарат». «Анналы химии» Либиха . 1990 (9): 949-952. дои : 10.1002/jlac.1990199001175 .
- ^ Уилкен, Дж.; Тори, К.; Грегер, Х.; Хаазе, Д.; Саак, В.; Пол, С.; Мюзарт Дж.; Мартенс, Дж. (1997). «Утилизация промышленных отходов», 11. Синтез новых хиральных β-втор-аминоспиртов – диастереодивергентное присоединение реагентов Гриньяра к α-аминоальдегидам на основе (all-R)-2-азабицикло[3.3.0]октановой системы ". Либигс Аннален . 1997 (10): 2133–2146. дои : 10.1002/jlac.199719971016 .
- ^ Jump up to: а б Венгринюк, С.Э.; Лим, Д.; Кольтарт, DM (2011). «Региоселективное асимметрическое α,α-бисалкилирование кетонов посредством комплексно-индуцированного син-депротонирования хиральных N-аминоциклических карбаматных гидразонов». Журнал Американского химического общества . 133 (22): 8714–8720. дои : 10.1021/ja202267k . ПМИД 21510644 .
- ^ Jump up to: а б с д и ж Эндерс Д., Вортманн Л. Петерс Р. (2000). «Восстановление карбонильных соединений из N,N-диалкилгидразонов». Отчеты о химических исследованиях . 33 (3): 157–169. дои : 10.1021/ar990062y . ПМИД 10727205 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )