Леггемоглобин
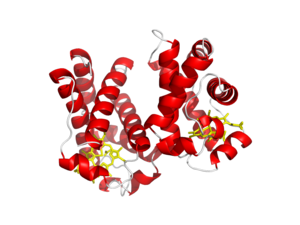
| Леггемоглобин, сайт связывания железа | |
|---|---|
| Идентификаторы | |
| Символ | Леггемоглобин_Fe_BS |
| ИнтерПро | ИПР019824 |
| PROSITE | PS00208 |
Леггемоглобин (также леггемоглобин или легоглобин ) представляет собой переносящий кислород фитоглобин обнаруженный в азотфиксирующих корневых клубеньках бобовых , растений. Он вырабатывается этими растениями в ответ на колонизацию корней азотфиксирующими бактериями, называемыми ризобиями , как часть симбиотического взаимодействия между растением и бактерией: корни, не колонизированные ризобиями, не синтезируют леггемоглобин. Леггемоглобин имеет близкое химическое и структурное сходство с гемоглобином и, как и гемоглобин, имеет красный цвет. Первоначально считалось, что простетическая группа гема растительного легоглобина обеспечивается бактериальным симбионтом в симбиотических корневых клубеньках. [ 1 ] [ 2 ] Однако последующая работа показала, что растение-хозяин сильно экспрессирует гены биосинтеза гема внутри клубеньков и что активация этих генов коррелирует с экспрессией генов леггемоглобина в развивающихся клубеньках. [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ] [ 9 ] [ 10 ]
У растений, колонизированных Rhizobium , таких как люцерна или соевые бобы , присутствие кислорода в корневых клубеньках снижает активность кислородчувствительной нитрогеназы , которая является ферментом, ответственным за фиксацию атмосферного азота. Показано, что леггемоглобин буферизует концентрацию свободного кислорода в цитоплазме инфицированных растительных клеток, обеспечивая правильное функционирование корневых клубеньков. При этом азотфиксация — чрезвычайно энергетически затратный процесс, поэтому аэробное дыхание , требующее высокой концентрации кислорода. в клетках корневого клубенька необходимо [ 11 ] Леггемоглобин поддерживает концентрацию свободного кислорода, достаточно низкую для функционирования нитрогеназы, но достаточно высокую концентрацию общего кислорода (свободного и связанного с леггемоглобином) для аэробного дыхания.
Леггемоглобин относится к классу симбиотических глобинов , к которым относятся также глобины клубеньков актиноризных растений, таких как казуарина . Симбиотический глобин Casuarina занимает промежуточное положение между леггемоглобином и несимбиотическим фитоглобином-2. [ 12 ] [ 13 ]
Структура
[ редактировать ]Леггемоглобины представляют собой мономерные белки массой около 16 кДа, структурно подобные миоглобину . [ 14 ] Один белок легоглобина состоит из гема, связанного с железом, и одной полипептидной цепи (глобина). [ 14 ] Подобно миоглобину и гемоглобину, железо гема in vivo находится в двухвалентном состоянии и представляет собой фрагмент, связывающий кислород. [ 14 ] Несмотря на сходство в механизме связывания кислорода между леггемоглобином и животным гемоглобином, а также тот факт, что леггемоглобин и животный гемоглобин произошли от общего предка, различия в аминокислотной последовательности между этими белками наблюдаются примерно в 80% положений. [ 14 ]

кислорода Сродство связывания леггемоглобинов в 11–24 раза выше, чем сродство связывания кислорода миоглобина кашалота. [ 15 ] Различия в сродстве обусловлены разной скоростью ассоциации между двумя типами белков. [ 15 ] Одно из объяснений этого явления состоит в том, что в миоглобине связанная молекула воды стабилизируется в кармане, окружающем гемовую группу. Эта водная группа должна быть вытеснена, чтобы кислород мог связываться. В аналогичном кармане леггемоглобина такая вода не связана, поэтому молекуле кислорода легче приблизиться к гему легоглобина. [ 14 ] Леггемоглобин имеет медленную скорость диссоциации кислорода, аналогичную миоглобину. [ 16 ] Подобно миоглобину и гемоглобину, леггемоглобин обладает высоким сродством к монооксиду углерода. [ 16 ]
В первичной структуре леггемоглобина А соевых бобов валин (F7) находится на месте серина (F7) в миоглобине. Без водородной связи, фиксирующей ориентацию проксимальной боковой цепи гистидина, имидазольное кольцо может занимать шахматную конформацию между атомами азота пиррола и легко перемещаться вверх к плоскости гема. Это значительно увеличивает реакционную способность атома железа и сродство к кислороду. В легоглобине А дистальная боковая цепь гистидина также отклоняется от связанного лиганда за счет образования водородной связи с тирозином. [ 17 ]
Гемовые группы одинаковы во всех известных леггемоглобинах, однако аминокислотная последовательность глобина незначительно различается в зависимости от штамма бактерий и видов бобовых. [ 14 ] Даже в пределах одного бобового растения могут существовать несколько изоформ леггемоглобинов. Они часто различаются по сродству к кислороду и помогают удовлетворить потребности клетки в определенной среде внутри узелка. [ 18 ]
Дебаты об основной функции
[ редактировать ]Результаты исследования 1995 года показали, что низкая концентрация свободного кислорода в клетках корневых клубеньков на самом деле связана с низкой проницаемостью кислорода клеток клубеньков. [ 19 ] Отсюда следует, что основная цель леггемоглобина — убирать ограниченный свободный кислород в клетке и доставлять его в митохондрии для дыхания. Но ученые в более поздней статье 2005 года предполагают, что леггемоглобин отвечает как за буферизацию концентрации кислорода, так и за доставку кислорода в митохондрии. [ 20 ] леггемоглобина Их исследования по нокауту показали, что леггемоглобин действительно значительно снижает концентрацию свободного кислорода в клетках корневых клубеньков и что экспрессия нитрогеназы устраняется у мутантов с нокаутом легоглобина, предположительно из-за деградации нитрогеназы с высокой концентрацией свободного кислорода. Их исследование также показало более высокое соотношение АТФ / АДФ в клетках корневых клубеньков дикого типа с активным леггемоглобином, что позволяет предположить, что леггемоглобин также способствует доставке кислорода для дыхания.
Растения содержат как симбиотические, так и несимбиотические гемоглобины. Считается, что симбиотические гемоглобины важны для симбиотической азотфиксации (SNF). У бобовых SNF находится в специализированных органах, называемых клубеньками, которые содержат бактероиды или азотфиксирующие ризобии. Развитие клубеньков сопровождается индукцией специфичных для клубеньков растительных генов, в том числе тех, которые кодируют симбиотические леггемоглобины (Lb). Леггемоглобины накапливаются до миллимолярных концентраций в цитоплазме инфицированных растительных клеток до фиксации азота для буферизации свободного кислорода в наномолярном диапазоне, что позволяет избежать инактивации кислородлабильной нитрогеназы, сохраняя при этом достаточно высокий поток кислорода для дыхания в клетке. Леггемоглобины необходимы для ОЯТ, но не необходимы для роста и развития растений в присутствии внешнего источника фиксированного азота. Леггемоглобины вносят существенный вклад в установление низких концентраций свободного кислорода, сохраняя при этом высокий энергетический статус в клетках. Это условия, необходимые для эффективного СЯС. [ 20 ]
Другие растительные гемоглобины
[ редактировать ]С тех пор глобины были идентифицированы как белок, общий для многих таксонов растений, а не только для симбиотических. В свете этого открытия было предложено использовать термин «фитоглобины» для обозначения растительных глобинов в целом. [ 12 ]
Фитоглобины можно разделить на две клады. 3/3-кратный тип содержит классы I и II фитоглобинов покрытосеменных растений и является общим для всех эукариот ( HGT бактериального флавогемоглобина). Леггемоглобин в строгом смысле представляет собой фитоглобин II класса. 2/2-кратный тип «TrHb2» относится к классу III в номенклатуре покрытосеменных и, по-видимому, заимствован у Chloroflexota (ранее Chloroflexi) предком наземных растений. [ 12 ]
Коммерческое использование
[ редактировать ]Компания Impossible Foods обратилась в американское FDA за разрешением на использование рекомбинантного соевого легоглобина в пищевых продуктах в качестве аналога , полученного из мяса гемоглобина . [ 21 ] [ 22 ] Одобрение FDA было получено в июле 2019 года. [ 23 ] был брошен вызов, [ а ] и позже поддержан 3 мая 2021 года федеральным апелляционным судом Сан-Франциско. [ 24 ] [ 25 ] В настоящее время он используется в их продуктах для имитации цвета, вкуса и текстуры мяса. [ 26 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Надлер К.Д., Ависар Ю.Ю. (сентябрь 1977 г.). «Синтез гема в корневых клубеньках сои: I. О роли бактероидной синтазы дельта-аминолевулиновой кислоты и дегидразы дельта-аминолевулиновой кислоты в синтезе гема леггемоглобина» . Физиология растений . 60 (3): 433–6. дои : 10.1104/стр.60.3.433 . ПМК 542631 . ПМИД 16660108 .
- ^ О'Брайан М.Р., Киршбом П.М., Майер Р.Дж. (декабрь 1987 г.). «Бактериальный синтез гема необходим для экспрессии голопротеина легоглобина, но не апопротеина в клубеньках корня сои» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (23): 8390–3. Бибкод : 1987PNAS...84.8390O . дои : 10.1073/pnas.84.23.8390 . ПМК 299548 . ПМИД 3479799 .
- ^ Сангван I, О'Брайан MR (март 1991 г.). «Доказательства межорганизменного пути биосинтеза гема в симбиотических клубеньках корня сои». Наука . 251 (4998): 1220–2. Бибкод : 1991Sci...251.1220S . дои : 10.1126/science.251.4998.1220 . ПМИД 17799282 . S2CID 11471787 .
- ^ Сангван I, О'Брайан MR (март 1992 г.). «Характеристика образования дельта-аминолевулиновой кислоты в корневых клубеньках сои» . Физиология растений . 98 (3): 1074–9. дои : 10.1104/стр.98.3.1074 . ПМК 1080310 . ПМИД 16668729 .
- ^ Сангван I, О'Брайан MR (июль 1993 г.). «Экспрессия гена глутамат-1-полуальдегид-аминотрансферазы сои (Glycine max) в симбиотических корневых клубеньках» . Физиология растений . 102 (3): 829–34. дои : 10.1104/стр.102.3.829 . ПМК 158853 . ПМИД 8278535 .
- ^ Мэдсен О., Сандал Л., Сандал Н.Н., Маркер К.А. (октябрь 1993 г.). «Ген копропорфириногеноксидазы сои высоко экспрессируется в корневых клубеньках». Молекулярная биология растений . 23 (1): 35–43. дои : 10.1007/BF00021417 . ПМИД 8219054 . S2CID 23011457 .
- ^ Качор CM, Смит MW, Сангван I, О'Брайан MR (апрель 1994 г.). «Дегидратаза дельта-аминолевулиновой кислоты растений. Экспрессия в корневых клубеньках сои и свидетельства бактериального происхождения гена Alad» . Физиология растений . 104 (4): 1411–7. дои : 10.1104/стр.104.4.1411 . ПМК 159307 . ПМИД 8016269 .
- ^ Фрустачи Дж. М., Сангван I, О'Брайан М. Р. (март 1995 г.). «gsa1 представляет собой универсальный ген синтеза тетрапиррола в соевых бобах и регулируется элементом GAGA» . Журнал биологической химии . 270 (13): 7387–93. дои : 10.1074/jbc.270.13.7387 . ПМИД 7706283 .
- ^ Сантана М.А., Пихакаски-Маунсбах К., Сандал Н., Маркер К.А., Смит А.Г. (апрель 1998 г.). «Доказательства того, что растение-хозяин синтезирует гемовую часть леггемоглобина в корневых клубеньках» . Физиология растений . 116 (4): 1259–69. дои : 10.1104/стр.116.4.1259 . ПМК 35032 . ПМИД 9536042 .
- ^ Сангван I, О'Брайан MR (февраль 1999 г.). «Экспрессия гена сои, кодирующего фермент синтеза тетрапиррола глутамил-тРНК-редуктазу, в симбиотических корневых клубеньках» . Физиология растений . 119 (2): 593–8. дои : 10.1104/стр.119.2.593 . ПМК 32136 . ПМИД 9952455 .
- ^ Берг, Дж.; Тимочко Дж.; Гатто-младший, Г.; Страйер, Л. (2015). Биохимия (8-е изд.). Компания WH & Freeman.
- ^ Jump up to: а б с Бекана, Мануэль; Ируэла, Инмакулада; Сарат, Гаутама; Каталан, Пилар; Харгроув, Марк С. (сентябрь 2020 г.). «Растительные гемоглобины: путь от одноклеточных зеленых водорослей к сосудистым растениям» . Новый фитолог . 227 (6): 1618–1635. дои : 10.1111/nph.16444 . hdl : 10261/219101 . ПМИД 31960995 .
- ^ Хилл Р., Харгроув М.С., Арредондо-Питер Р. (2016). «Фитоглобин: новая номенклатура растительных глобинов, принятая глобиновым сообществом на XVIII конференции 2014 года по кислородсвязывающим и сенсорным белкам» . F1000Исследования . 5 : 212. doi : 10.12688/f1000research.8133.1 . ПМЦ 4792203 . ПМИД 26998237 .
- ^ Jump up to: а б с д и ж Сингх С., Варма А. (2017) Структура, функции и оценка легоглобина. В: Хансен А., Чоудхари Д., Агравал П., Варма А. (ред.) Биология и биотехнология Rhizobium. Биология почвы, том 50. Спрингер, Чам.
- ^ Jump up to: а б Арутюнян Э.Х., Сафонова Т.Н., Куранова ИП, Попов АН, Тепляков А.В., Обмолова Г.В., Русаков А.А., Вайнштейн Б.К., Додсон Г.Г., Уилсон Дж.К. «Структура дезокси- и оксилеггемоглобина люпина».
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) [ нужна полная цитата ] - ^ Jump up to: а б Виттенберг Дж. Б., Эпплби Калифорния, Виттенберг Б. А. (январь 1972 г.). «Кинетика реакций леггемоглобина с кислородом и окисью углерода» . Журнал биологической химии . 247 (2): 527–531. дои : 10.1016/S0021-9258(19)45734-7 . ПМИД 4333266 .
- ^ Смагге, Бенуа Дж.; Хой, Джули А.; Персифилд, Райан; Кунду, Суман; Харгроув, Марк С.; Сарат, Гаутама; Гильберт, Жан-Луи; Уоттс, Ричард А.; Деннис, Элизабет С.; Пикок, В. Джеймс; Девильд, Сильвия; Моэнс, Люк; Блуэн, Джордж К.; Олсон, Джон С.; Эпплби, Сирил А. (декабрь 2009 г.). «Обзор: корреляция между сродством к кислороду и классификацией последовательностей растительных гемоглобинов». Биополимеры . 91 (12): 1083–1096. дои : 10.1002/bip.21256 . ISSN 0006-3525 . ПМИД 19441024 . S2CID 1891302 .
- ^ Кавасима К., Суганума Н., Тамаоки М., Коучи Х. (2001). «Два типа генов легоглобина гороха, демонстрирующие разное сродство к связыванию O2 и разные модели пространственной экспрессии в клубеньках» . Физиол растений . 125 (2): 641–651. дои : 10.1104/стр.125.2.641 . ПМК 64866 . ПМИД 11161022 .
- ^ Людвиг Р.А., де Врис Г.Е. (1986). «Биохимическая физиология азотфиксации ризобий» . В Broughton WJ, Pühler S (ред.). Азотфиксация, Vol. 4: Молекулярная биология . Оксфорд, Великобритания: Издательство Кларендонского университета. стр. 50–69 . ISBN 978-0-19-854575-0 .
- ^ Jump up to: а б Отт, Томас; ван Донген, Йост Т.; Гюнтер, Катрин; Круселл, Лен; Деброс, Гильем; Вигеолас, Элен; Бок, Вивьен; Чеховский, Томаш; Гейгенбергер, Питер; Удварди, Майкл К. (29 марта 2005 г.). «Симбиотические леггемоглобины имеют решающее значение для фиксации азота в корневых клубеньках бобовых, но не для общего роста и развития растений» . Современная биология . 15 (6): 531–535. Бибкод : 2005CBio...15..531O . дои : 10.1016/j.cub.2005.01.042 . ISSN 0960-9822 . ПМИД 15797021 .
- ^ «Уведомление GRAS 540» . www.accessdata.fda.gov . Архивировано из оригинала 30 июня 2017 г. Проверено 21 января 2018 г.
- ^ «Уведомление GRAS 737» . www.accessdata.fda.gov . Проверено 22 августа 2018 г. [ постоянная мертвая ссылка ]
- ^ «Конкурент Beyond Meat, компания Impossible Foods, планирует начать продажи в продуктовых магазинах в сентябре после получения одобрения FDA» . CNBC . 31 июля 2019 года . Проверено 31 июля 2019 г.
- ^ Жюстин Кальма (3 мая 2021 г.). «Impossible Foods завершила судебную тяжбу по поводу ингредиента, который вызывает кровотечение из мяса » . theverge.com . Архивировано из оригинала 07 мая 2021 г.
- ^ Салли Хо (6 мая 2021 г.). «Impossible Foods выиграла юридическую битву из-за гемового ингредиента, лежащего в основе «кровоточащего» растительного бургера» . greenqueen.com.hk . Архивировано из оригинала 6 мая 2021 г.
- ^ Бандоим, Л. (20 декабря 2019 г.). «Что решение FDA относительно соевого леггемоглобина означает для невозможного бургера» . Форбс . Проверено 4 марта 2020 г.
Примечания
[ редактировать ]- ^ подано некоммерческой правозащитной организацией Центр безопасности пищевых продуктов.
Дальнейшее чтение
[ редактировать ]- Виртанен А.И. (1948). «Биологическая азотфиксация». Ежегодный обзор микробиологии . 2 (1): 485–506. дои : 10.1146/annurev.mi.02.100148.002413 . ПМИД 18122253 .
- Таиз, Л.; Зейгер, Э. (2006). Физиология растений онлайн (3-е изд.). Сандерленд, Массачусетс: Sinauwr Associates, Inc. п. 269. ИСБН 978-0-87893-856-8 . Архивировано из оригинала 9 мая 2008 г. Проверено 3 мая 2008 г.
- «Секретный соус» невозможного бургера подчеркивает проблемы пищевых технологий
- Обновления FDA объявляет дату вступления в силу окончательного правила о добавлении соевого леггемоглобина в список цветовых добавок, освобожденных от сертификации