Энергетический профиль (химия)
В теоретической химии энергетический профиль представляет собой теоретическое представление химической реакции или процесса как единого энергетического пути, по которому реагенты превращаются в продукты . Этот путь проходит по координате реакции , которая представляет собой параметрическую кривую , повторяющую путь реакции и указывающую ее ход; таким образом, энергетические профили также называют диаграммами координат реакций . Они получены на основе соответствующей поверхности потенциальной энергии (PES), которая используется в вычислительной химии для моделирования химических реакций путем связывания энергии молекулы (молекул) с ее структурой (в рамках приближения Борна-Оппенгеймера ).

Качественно диаграммы координат реакций (одномерные энергетические поверхности) имеют множество приложений. Химики используют диаграммы координат реакций как аналитическое, так и педагогическое средство для рационализации и иллюстрации кинетических и термодинамических явлений. Цель энергетических профилей и поверхностей — предоставить качественное представление о том, как потенциальная энергия меняется в зависимости от движения молекул для данной реакции или процесса. [ 1 ]
Потенциальные энергетические поверхности
[ редактировать ]Проще говоря, поверхность потенциальной энергии или ППЭ — это математическое или графическое представление связи между энергией молекулы и ее геометрией. Методы описания потенциальной энергии подразделяются на классическую механическую интерпретацию ( молекулярную механику ) и квантовомеханическую интерпретацию. В квантово-механической интерпретации точное выражение для энергии может быть получено для любой молекулы, полученной на основе квантовых принципов (хотя может потребоваться бесконечный базисный набор), но в расчетах/методах ab initio часто используются приближения для снижения вычислительных затрат. [ 2 ] [ 3 ] Молекулярная механика основана на эмпирическом опыте, и потенциальная энергия описывается как функция составляющих членов, которые соответствуют отдельным потенциальным функциям, таким как кручение , растяжение, изгибы, энергии Ван-дер-Ваальса , электростатика и перекрестные члены. [ 3 ] [ 4 ] [ 5 ] Каждая потенциальная функция компонента соответствует экспериментальным данным или свойствам, предсказанным расчетами ab initio . [ 4 ] Молекулярная механика полезна для прогнозирования равновесной геометрии и переходных состояний , а также относительной конформационной стабильности. Когда происходит реакция, атомы участвующих молекул обычно претерпевают некоторые изменения в пространственной ориентации из-за внутреннего движения, а также своего электронного окружения. [ 1 ] Искажения геометрических параметров приводят к отклонению от равновесной геометрии (локальные минимумы энергии). Эти изменения геометрии молекулы или взаимодействия между молекулами представляют собой динамические процессы, которые требуют понимания всех сил, действующих внутри системы. Поскольку эти силы могут быть математически выведены как первая производная потенциальной энергии по смещению, имеет смысл отобразить потенциальную энергию E системы как функцию геометрических параметров q 1 , q 2 , q 3 и так далее. [ 1 ] Потенциальная энергия при заданных значениях геометрических параметров ( q 1 , q 2 , ..., q n ) представляется как гиперповерхность (когда n > 2 ) или поверхность (когда n ≤ 2 ). Математически это можно записать как
Для квантово-механической интерпретации ППЭ обычно определяется в рамках приближения Борна-Оппенгеймера (чтобы различать ядерное и электронное движение и энергию), которое утверждает, что ядра неподвижны относительно электронов. Другими словами, приближение позволяет пренебречь кинетической энергией ядер (или движением ядер) и поэтому отталкивание ядер является постоянной величиной (как статические точечные заряды ) и учитывается только при расчете полной энергии системы. . Затем считается, что электронная энергия параметрически зависит от ядерных координат, а это означает, что новая электронная энергия ( E e ) должна быть рассчитана для каждой соответствующей атомной конфигурации. [ 2 ] [ 3 ]
PES является важной концепцией в вычислительной химии и очень помогает в оптимизации геометрии и переходного состояния.
Степени свободы
[ редактировать ]Система n -атомов определяется 3 n координатами: ( x , y , z ) для каждого атома. Эти 3n степеней свободы можно разбить на 3 общие поступательные и 3 (или 2) общие вращательные степени свободы для нелинейной системы (для линейной системы). Однако общие степени поступательного или вращательного движения не влияют на потенциальную энергию системы, которая зависит только от ее внутренних координат. Таким образом, система n -атомов будет определяться 3 n – 6 (нелинейными) или 3 n – 5 (линейными) координатами. [ 1 ] [ 3 ] Эти внутренние координаты могут быть представлены простыми координатами растяжения, изгиба, кручения или адаптированными к симметрии линейными комбинациями, или избыточными координатами, или координатами нормальных мод и т. д. Для системы, описываемой n -внутренними координатами, можно записать отдельную функцию потенциальной энергии. относительно каждой из этих координат, удерживая другие n – 1 параметров при постоянном значении, позволяя отслеживать вклад потенциальной энергии от конкретного молекулярного движения (или взаимодействия), в то время как другие n – 1 параметров определяются.
Рассмотрим двухатомную молекулу AB, которую макроскопически можно представить как два шарика (которые изображают два атома A и B), соединенных посредством пружины, которая изображает связь. Когда эта пружина (или связь) растягивается или сжимается, потенциальная энергия системы шарик-пружина (молекула AB) изменяется, и это можно отобразить на двумерном графике как функцию расстояния между A и B, т.е. длины связи. .

Эту концепцию можно расширить до трехатомной молекулы, такой как вода, где у нас есть два атома. связи O-H и H−O−H Валентный угол как переменные, от которых будет зависеть потенциальная энергия молекулы воды. Мы можем с уверенностью предположить, что два Связи O-H должны быть равны. Таким образом, можно построить ПЭС, отображающую потенциальную энергию E молекулы воды как функцию двух геометрических параметров: q 1 O–H = длина связи и q 2 H–O–H = валентный угол . Самая нижняя точка такого ПЭС будет определять равновесную структуру молекулы воды.
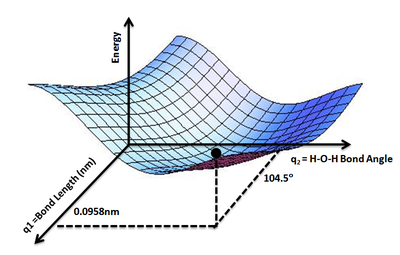
Показывает минимум энергии, соответствующий оптимизированной молекулярной структуре воды. O-H 0,0958 нм и Длина связи H-O-H Валентный угол 104,5 °.
Та же концепция применяется к органическим соединениям, таким как этан , бутан и т. д., чтобы определить их наименьшую энергию и наиболее стабильные конформации .
Характеристика PES
[ редактировать ]Наиболее важными точками ППЭ являются стационарные точки , где поверхность плоская, т.е. параллельна горизонтальной линии, соответствующей одному геометрическому параметру, плоскости, соответствующей двум таким параметрам, или даже гиперплоскости, соответствующей более чем двум геометрическим параметрам. Значения энергии, соответствующие переходным состояниям и основному состоянию реагентов и продуктов, можно найти с помощью функции потенциальной энергии путем расчета критических точек функции или стационарных точек. Стационарные точки возникают, когда первая частная производная энергии по каждому геометрическому параметру равна нулю.
Используя аналитические производные полученного выражения для энергии, можно найти и охарактеризовать стационарную точку как минимум, максимум или седловую точку . Основные состояния представлены локальными минимумами энергии, а переходные состояния — седловыми точками.
Минимумы представляют собой стабильные или квазистабильные виды, т.е. реагенты и продукты с конечным временем жизни. Математически минимальная точка определяется как
Точка может быть локальным минимумом, если ее энергия ниже по сравнению только с ее окружением, или глобальным минимумом, который является точкой с самой низкой энергией на всей поверхности потенциальной энергии.
Седловая точка представляет собой максимум только в одном направлении (координате реакции) и является минимумом во всех остальных направлениях. Другими словами, седловая точка представляет собой переходное состояние по координате реакции. Математически седловая точка возникает, когда
для всех q, кроме координаты реакции и
вдоль координаты реакции.
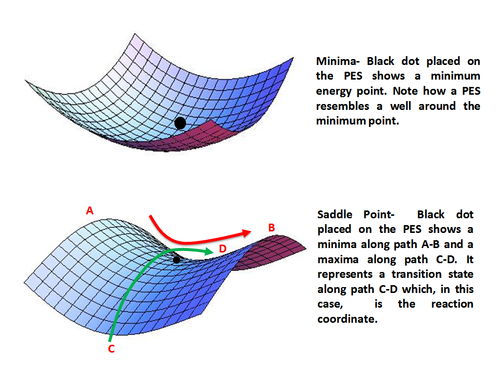
Минимумы (вверху) и седловая точка (внизу) на поверхности потенциальной энергии
Диаграммы координат реакции
[ редактировать ]Собственная координата реакции [ 6 ] (IRC), полученная на основе поверхности потенциальной энергии, представляет собой параметрическую кривую, соединяющую два минимума энергии в направлении, пересекающем минимальный энергетический барьер (или наименьший подъем), проходящий через одну или несколько седловых точек. Однако на самом деле, если реагирующие виды получают достаточно энергии, они могут в некоторой степени отклоняться от IRC. [ 1 ] Значения энергии (точки на гиперповерхности) вдоль координаты реакции образуют одномерную энергетическую поверхность (линию), а при построении графика относительно координаты реакции (энергия против координаты реакции) получается так называемая диаграмма координат реакции (или энергетический профиль). Другой способ визуализации энергетического профиля — это поперечное сечение гиперповерхности или поверхности вдоль координаты реакции. На рисунке 5 показан пример поперечного сечения, представленного плоскостью, взятой вдоль координаты реакции, а потенциальная энергия представлена как функция или совокупность двух геометрических переменных, образующих двумерную энергетическую поверхность. В принципе, функция потенциальной энергии может зависеть от N переменных, но поскольку точное визуальное представление функции трех или более переменных невозможно (исключая гиперповерхности уровней ), была показана двумерная поверхность. Точки на поверхности, пересекающие плоскость, затем проецируются на диаграмму координат реакции (показана справа), чтобы создать одномерный срез поверхности вдоль IRC. Координата реакции описывается ее параметрами, которые часто задаются как совокупность нескольких геометрических параметров и могут менять направление по мере развития реакции до тех пор, пока преодолевается наименьший энергетический барьер (или энергия активации (Ea)). [ 1 ] Седловая точка представляет собой точку с наивысшей энергией, лежащую на координате реакции, соединяющей реагент и продукт; это известно как переходное состояние. Диаграмма координат реакции также может иметь один или несколько переходных промежуточных продуктов, которые показаны высокоэнергетическими ямами, соединенными пиком переходного состояния. Любая химическая структура, которая сохраняется дольше, чем время типичных колебаний связи (10 −13 – 10 −14 s) можно рассматривать как промежуточный. [ 4 ]

В реакции, включающей более одной элементарной стадии, образуется один или несколько промежуточных продуктов, что, в свою очередь, означает, что необходимо преодолеть более одного энергетического барьера. Другими словами, на пути реакции лежит более одного переходного состояния. Поскольку интуитивно понятно, что преодоление энергетического барьера или прохождение пика переходного состояния повлечет за собой наибольшую энергию, становится ясно, что это будет самый медленный шаг на пути реакции. Однако, когда необходимо преодолеть более одного такого барьера, становится важным определить самый высокий барьер, который будет определять скорость реакции. Эта стадия реакции, скорость которой определяет общую скорость реакции, известна как стадия определения скорости или стадия ограничения скорости. Высота энергетического барьера всегда измеряется относительно энергии реагента или исходного материала. Различные возможности показаны на рисунке 6.

Диаграммы координат реакции также дают информацию о равновесии между реагентом или продуктом и промежуточным продуктом. Если барьерная энергия перехода от промежуточного продукта к продукту намного выше, чем энергия перехода реагента к промежуточному продукту, можно с уверенностью заключить, что между реагентом и промежуточным продуктом устанавливается полное равновесие. Однако если два энергетических барьера для превращения реагента в промежуточный продукт и промежуточного продукта в продукт почти равны, то полное равновесие не устанавливается и для получения выражений кинетической скорости такой реакции используется приближение стационарного состояния. [ 7 ]

Построение диаграммы координат реакции
[ редактировать ]Хотя диаграмма координат реакции по существу получается на основе поверхности потенциальной энергии, не всегда возможно построить ее на основе ППЭ. Химик рисует диаграмму координат реакции, основываясь на знаниях об изменении свободной энергии или энтальпии, связанном с превращением, что помогает ему представить реагент и продукт в перспективе и определить, образуется ли какое-либо промежуточное соединение или нет. Одним из руководящих указаний для рисования диаграмм сложных реакций является принцип наименьшего движения , который гласит, что предпочтительной реакцией, протекающей от реагента к промежуточному соединению или от одного промежуточного соединения к другому или продукту, является та, которая имеет наименьшее изменение положения ядра или электронной конфигурации. Таким образом, можно сказать, что реакции, связанные с резким изменением положения ядер, на самом деле происходят посредством серии простых химических реакций. Постулат Хаммонда — еще один инструмент, который помогает определить энергию переходного состояния относительно реагента, промежуточного продукта или продукта. В нем говорится, что переходное состояние напоминает реагент, промежуточное соединение или продукт, к которому оно наиболее близко по энергии, при условии, что разница в энергии между переходным состоянием и соседней структурой не слишком велика. Этот постулат помогает точно предсказать форму координатной диаграммы реакции, а также дает представление о молекулярной структуре в переходном состоянии.
Кинетические и термодинамические соображения
[ редактировать ]Химическую реакцию можно определить двумя важными параметрами: свободной энергией Гиббса , связанной с химическим превращением, и скоростью такого превращения. Эти параметры независимы друг от друга. В то время как изменение свободной энергии описывает стабильность продуктов по отношению к реагентам, скорость любой реакции определяется энергией переходного состояния по отношению к исходному материалу. В зависимости от этих параметров реакция может быть благоприятной или неблагоприятной, быстрой или медленной, обратимой или необратимой, как показано на рисунке 8.
Благоприятной реакцией является та, при которой изменение свободной энергии ∆G ° отрицательно ( экзергонично ) или, другими словами, свободная энергия продукта, G ° продукта , меньше свободной энергии исходных веществ, G ° реагента . ∆G ° >0 ( эндэргоническая ) соответствует неблагоприятной реакции. ∆G ° можно записать как функцию изменения энтальпии ∆H ° ) и изменения энтропии ( ∆S °) как ∆G ° = ∆H ° – T ∆S ° . ( является ли реакция благоприятной или неблагоприятной, используются энтальпии, а не свободная энергия, поскольку ∆H ° легче измерить, а T ∆S Практически для определения того , ° обычно слишком мала, чтобы иметь какое-либо значение (при T < 100 °C). . Реакция с ∆H ° <0 называется экзотермической , а с ∆H ° >0 — эндотермической .

Относительная стабильность реагента и продукта сама по себе не определяет возможность любой реакции. Чтобы любая реакция протекала, исходный материал должен иметь достаточно энергии, чтобы преодолеть энергетический барьер. Этот энергетический барьер известен как энергия активации (∆ G ≠ ) и скорость реакции зависит от высоты этого барьера. Низкий энергетический барьер соответствует быстрой реакции, а высокий энергетический барьер соответствует медленной реакции. Реакция находится в равновесии, когда скорость прямой реакции равна скорости обратной реакции. Такая реакция называется обратимой. Если исходный материал и продукт(ы) находятся в равновесии, то их относительное содержание определяется разницей в свободной энергии между ними. В принципе, все элементарные стадии обратимы, но во многих случаях равновесие настолько сильно смещено в сторону продукта, что исходный материал фактически больше не наблюдается или присутствует в достаточной концентрации, чтобы влиять на реакционную способность. Практически говоря, реакция считается необратимой.
Хотя большинство обратимых процессов будут иметь достаточно небольшой K , равный 10 3 или меньше, это не строгое правило, и ряд химических процессов требуют обратимости даже очень благоприятных реакций. Например, реакция карбоновой кислоты с аминами с образованием соли протекает при K 10. 5–6 , а при обычных температурах этот процесс считается необратимым. Тем не менее, при достаточном нагревании происходит обратная реакция, позволяющая образовывать тетраэдрический промежуточный продукт и, в конечном итоге, амид и воду. (Для крайнего примера, требующего обратимости шага с K > 10 11 , см. деметилирование .) Реакция также может стать необратимой, если происходит последующий, более быстрый этап потребления исходного продукта (продуктов) или если в открытой системе выделяется газ. Таким образом, не существует значения К , которое служило бы «разделительной линией» между обратимыми и необратимыми процессами. Вместо этого обратимость зависит от времени, температуры, условий реакции и общего энергетического ландшафта.
Когда реагент может образовывать два разных продукта в зависимости от условий реакции, становится важным выбрать правильные условия, способствующие получению желаемого продукта. Если реакция проводится при относительно более низкой температуре, то образующийся продукт лежит через меньший энергетический барьер. Это называется кинетическим контролем, и соотношение образующихся продуктов зависит от относительных энергетических барьеров, ведущих к продуктам. Относительная стабильность продуктов не имеет значения. Однако при более высоких температурах у молекул достаточно энергии, чтобы преодолеть оба энергетических барьера, приводя к образованию продуктов. В таком случае соотношение продуктов определяется исключительно энергиями продуктов, а энергии барьера не имеют значения. Это известно как термодинамический контроль, и его можно достичь только тогда, когда продукты могут взаимопревращаться и уравновешиваться в условиях реакции. Диаграмму координат реакции также можно использовать для качественной иллюстрации кинетического и термодинамического контроля реакции.

Приложения
[ редактировать ]Ниже приведены несколько примеров того, как интерпретировать диаграммы координат реакций и использовать их при анализе реакций.
Эффект растворителя: В общем, если переходное состояние на этапе определения скорости соответствует более заряженным частицам по сравнению с исходным материалом, то увеличение полярности растворителя приведет к увеличению скорости реакции, поскольку более полярный растворитель более эффективен для стабилизации. переходное состояние (ΔG ‡ уменьшится). Если структура переходного состояния соответствует менее заряженным частицам, то увеличение полярности растворителя приведет к снижению скорости реакции, поскольку более полярный растворитель будет более эффективным для стабилизации исходного материала (ΔG тот уменьшится, что, в свою очередь, увеличит ΔG ‡ ). [ 8 ]
СН 1 против СН 2
Механизмы S N 1 и S N 2 используются в качестве примера, чтобы продемонстрировать, как эффекты растворителя могут быть указаны на диаграммах координат реакции.
- S N 1: На рисунке 10 показан этап, определяющий скорость для механизма S N 1, образование промежуточного карбокатиона и соответствующая координатная диаграмма реакции. Для механизма S N 1 структура переходного состояния демонстрирует частичную плотность заряда по сравнению со структурой нейтрального основного состояния. Следовательно, увеличение полярности растворителя, например, от гексана (показано синим цветом) до эфира (показано красным), приведет к снижению скорости реакции. Как показано на рисунке 9, исходный материал имеет примерно одинаковую стабильность в обоих растворителях (следовательно, ΔΔG тот =ΔG тот полярный – ΔG тот неполярность мала), и переходное состояние более стабилизируется в эфире, что означает ΔΔG ≠ = ΔG ≠ полярный – ΔG ≠ неполярный большой.

- S N 2: Для механизма S N 2 предпочтительным является сильноосновный нуклеофил (т.е. заряженный нуклеофил). стадия определения скорости синтеза эфира Вильямсона . На рисунке 11 ниже показана [ 9 ] [ 10 ] Исходным материалом является метилхлорид и этоксид-ион, который имеет локализованный отрицательный заряд, что означает, что он более стабилен в полярных растворителях. На рисунке показана структура переходного состояния, когда метилхлорид подвергается нуклеофильной атаке. В структуре переходного состояния заряд распределяется между атомами Cl и O, и более полярный растворитель менее эффективен для стабилизации структуры переходного состояния по сравнению с исходными материалами. Другими словами, разница в энергии между полярным и неполярным растворителем больше для основного состояния (исходного вещества), чем для переходного состояния.

Катализаторы. Существует два типа катализаторов : положительные и отрицательные. Положительные катализаторы увеличивают скорость реакции, а отрицательные катализаторы (или ингибиторы) замедляют реакцию и, возможно, приводят к тому, что реакция вообще не происходит. Целью катализатора является изменение энергии активации. Рисунок 12 иллюстрирует назначение катализатора, заключающееся в том, что изменяется только энергия активации , а не относительная термодинамическая стабильность продуктов и реагентов, показанная на рисунке как ΔH. Это означает, что катализатор не изменит равновесные концентрации продуктов и реагентов, а лишь позволит реакции быстрее достичь равновесия. На рисунке 13 показан катализируемый путь, происходящий в несколько стадий, что является более реалистичным изображением катализируемого процесса. Новый катализируемый путь может происходить по тому же механизму, что и некатализируемая реакция, или по альтернативному механизму. [ 4 ] Фермент — это биологический катализатор, который увеличивает скорость многих жизненно важных биохимических реакций. На рисунке 13 показан распространенный способ иллюстрации влияния фермента на данную биохимическую реакцию. [ 11 ]


См. также
[ редактировать ]- Свободная энергия Гиббса
- Энтальпия
- Энтропия
- Вычислительная химия
- Молекулярная механика
- Приближение Борна – Оппенгеймера
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Льюарс, Э.Г. (2011). Вычислительная химия . Спрингер. стр. 9–43. ISBN 978-9048138616 .
- ^ Jump up to: а б Сабо, Аттила; Остлунд, Нил (1989). Современная квантовая химия: введение в продвинутую теорию электронной структуры . Дувр. ISBN 0-486-69186-1 .
- ^ Jump up to: а б с д Шерилл, Дэвид. «Поверхности потенциальной энергии» (PDF) . Проверено 27 октября 2013 г.
- ^ Jump up to: а б с д и ж г Анслин, Догерти, Эрик, Деннис (2006). Современная физико-органическая химия . Университетские научные книги. ISBN 1-891389-31-9 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Шерилл, Дэвид. «Введение в молекулярную механику» (PDF) .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Координата внутренней реакции ». дои : 10.1351/goldbook.IT07057
- ^ Jump up to: а б Гроссман, Роберт (31 июля 2007 г.). Искусство написания разумных механизмов органических реакций, 2-е изд . Спрингер. ISBN 978-0-387-95468-4 .
- ^ Брюс, Паула (2007). Органическая химия, 5-е изд . Нью-Джерси: Пирсон Прентис Холл. ISBN 978-0-13-196316-0 .
- ^ Нойман, Роберт (2013). Органическая химия . Роберт К. Нойман-младший, стр. Глава 7, 1–71.
- ^ Портал органической химии. «Нуклеофильное замещение» . Проверено 25 октября 2013 г.
- ^ Сильверман, Ричард (2004). Органическая химия дизайна и действия лекарств, 2-е изд . Эльзевир. п. 178 . ISBN 0-12-643732-7 .






