Стрелка нажимает
Толкание стрел или электрон -толчок - это метод, используемый для описания прогрессирования органической химии механизмов реакции . [ 1 ] Впервые он был разработан сэром Робертом Робинсоном . Используя толкание стрел, «изогнутые стрелки» или «кудрявые стрелки» нарисованы на структурных формулах реагентов в химическом уравнении , чтобы показать механизм реакции . Стрелки иллюстрируют движение электронов , поскольку связи между атомами разбиты и образуются. Важно отметить, что толкание стрелы никогда не показывает движение атомов; Он используется для демонстрации движения электронной плотности, что косвенно показывает движение самих атомов. Толкание стрел также используется для описания того, как положительные и отрицательные заряды распределяются вокруг органических молекул посредством резонанса . Однако важно помнить, что толкание стрелы - это формализм, а электроны (или, скорее, плотность электронов) не перемещаются так аккуратно и дискретно в реальности.
Толкание стрелы было распространено на неорганическую химию , особенно на химию элементов S- и P- блока . Было показано, что он хорошо работает для гипервалентных соединений. [ 2 ]
Обозначение
[ редактировать ]
Представление механизмов реакции с использованием изогнутых стрелок для обозначения электронного потока было разработано сэром Робертом Робинсоном в 1922 году. [ 3 ] [ 4 ] [ 5 ] Органические химики используют два типа стрелок в молекулярных структурах для описания перемещения электронов. Траектории одиночного электрона обозначены с помощью одноразовых стрел, в то время как стрелки с двойным обменом показывают движение электронов. Хвост стрелы нарисуется либо в одиночной паре электронов на атоме, либо на связи между атомами, источником электронов или площадью, где существует относительно высокая плотность электронов. Его голова указывает на электронные раковины или области относительно низкой плотности электронов. [ 6 ]


Когда связь нарушается, электроны уходят, где была связь; Это представлено изогнутой стрелкой, указывающей в сторону от связи и заканчивая стрелкой, указывающей на следующую незанятую молекулярную орбиту. Электроны могут быть перенесены в определенный атом или могут быть перенесены в одну (сигма) связь, что делает его двойной (PI) связью, но стрелка всегда указывает на определенный атом, потому что электроны всегда перемещаются к новому атому Всякий раз, когда они "толкают". Органические химики представляют образование связи с помощью изогнутой стрелки, указывающей между двумя видами. [ 7 ]
Для ясности при толчке стрел лучше всего нарисовать стрелки, начиная с одиночной пары электронов или σ или π -связи и заканчивая в положении, которое может принять пару электронов, позволяя читателю точно знать, какие электроны движутся и где они заканчиваются. Облигации разбиваются в местах, где заполняется соответствующая орбиталь антипонтирования. Некоторые власти [ 1 ] Разрешить упрощение, что стрелка может возникнуть при формальном отрицательном заряде, который соответствует одиночной паре. Однако не все формальные отрицательные заряды соответствуют наличию одинокой пары (например, B в F 4 B − ), и необходимо заботиться с этим использованием.
Разрыв облигаций
[ редактировать ]Ковалентная связь, соединяющая атомы в органической молекуле, состоит из группы из двух электронов. Такая группа называется электронной парой. Реакции в органической химии проходят последовательное разрыв и образование таких связей. Органические химики распознают два процесса для разрыва химической связи. Эти процессы известны как гомолитическое расщепление и гетеролитическое расщепление. [ 8 ]
Гомолитическая связь расщепления
[ редактировать ]гомолитической Расщепление связи - это процесс, в котором электронная пара, содержащая связь, разделяется, в результате чего связь сломается. Это обозначается двумя изогнутыми стрелками с одной колючей колючей колючей силой, указывающими от связи. Следствием этого процесса является сохранение одного непарного электрона, обозначаемого точкой на каждом из атомов, которые ранее соединяли связь. Единственное электронное движение может быть обозначено изогнутой стрелкой, обычно называемой рыбным крючком. [ 9 ] Эти единственные виды электронов известны как свободные радикалы . Тепло или свет требуется, чтобы обеспечить достаточно энергии для этого процесса. [ 10 ]

Например, ультрафиолетовый свет заставляет связующую хлор -хлор разрываться гомолитически. Пара электронов становится разделенной, обозначаемых двумя стрелками для рыбного крючка между обоими атомами, указывающими на обоих атомов хлора. После возникновения реакции это приводит к обеим молекулам хлора, оставленным с одним непарным электроном. Это стадия инициации галогеникации свободных радикалов .

Гетеролитическое расщепление связи
[ редактировать ]Гетеролитическое расщепление связей - это процесс, в котором электронная пара, которая включала связь, перемещается к одному из атомов, к которому ранее соединялась связь. Бонд разрывается, образуя отрицательно заряженные виды ( анион ) и положительно заряженные виды (катион ) . Анион - это вид, который сохраняет электроны от связи, в то время как катион лишен электронов из связи. Анион обычно образуется на самом электроотрицании , в этом примере Atom A. Это связано с тем, что самый электроотрицательный атом естественным образом привлечет электроны к себе к себе более сильно, что приводит к его отрицательному заряду.
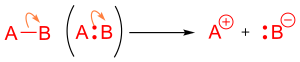
Кислотные реакции
[ редактировать ]Кислотная реакция Льюиса возникает, когда молекула с одиночной парой электронов или основание жертвует свои электроны на акцептор электронной пары, также известный как кислота. [ 11 ] Это может быть показано в реакции с изогнутой стрелкой, указывающей из не борьбы с парой электронов на акцептор электрона. В реакции с участием кислот и оснований Brønsted-Lowry, стрелки используются таким же образом, и они помогают указать атакующий протон. [ 12 ] В реакции с кислотой-базой Brønsted стрелка начнется с кислоты, акцептора протона, до основания, донора Proton. [ 13 ]
S n 1 реакции
[ редактировать ]Реакция S N 1 возникает, когда молекула разделяется на положительно заряженный компонент и отрицательно заряженный компонент. Обычно это происходит в высокополярных растворителях посредством процесса, называемого сольволизом . Положительно заряженный компонент затем реагирует с нуклеофилом, образующим новое соединение. S N 1 Реакции - это реакции, скорость которых зависит только от концентрации галоалкана.

На первой стадии этой реакции (сольволиз) связь CL разрывается и оба электрона из этой связи соединяют LG ( уходная группа ), чтобы сформировать LG − и r 3 c + ионы Это представлено изогнутой стрелкой, указывающей в сторону от связи C-LG и к LG. Нуклеофил ню − , будучи привлеченным к R 3 C + , затем жертвует пару электронов, образующих новую связь C-NU.
Поскольку реакция S N 1 продолжается с помощью S -Ubstitution уходной группы с N Ucleophile, S N. используется обозначение Поскольку начальная стадия сольволиза в этой реакции включает в себя одну молекулу, диссоциирующую от ее уходной группы, начальная стадия этого процесса считается одномолекулярной реакцией. Участие только 1 вида в начальной фазе реакции усиливает механистическое обозначение до S N 1 . [ 14 ] Реакция S N 1 имеет два шага.
S N 2 реакции
[ редактировать ]Реакция S N 2 возникает, когда нуклеофил вытесняет уходную группу, проживающую на молекуле из задней части уходной группы. Это смещение или замена приводит к формированию продукта замещения с инверсией стереохимической конфигурации. Нуклеофил образует связь с ее одинокой парой в качестве источника электронов. Электронная раковина, которая в конечном итоге принимает электронную плотность, является ядром (оставляя группу), с формированием связей и разрывом связи, происходящими одновременно в переходном состоянии (отмечено двойным гадче). Скорости реакций S N 2 зависят от концентрации галоалкана и нуклеофила.

Поскольку реакция S N 2 продолжается с помощью S -Ubstitation уходной группы с N Ucleophile, S N. используется обозначение Поскольку этот механизм происходит с взаимодействием двух видов в переходном состоянии, он называется BI -молекулярный процесс, что приводит к обозначению S N 2 . [ 15 ] Реакция S N 2 является согласованным процессом, что означает, что связи разбиваются и образуются одновременно. Таким образом, движение электронов, показанное нажатием стрелки, происходит одновременно. [ 16 ] Реакция S N 2 имеет один шаг.
E1 Устранения
[ редактировать ]E1 Элиминация происходит, когда протон, прилегающий к положительному заряду, и генерирует двойную связь .

Поскольку начальное образование катиона необходимо для возникновения реакций E1, реакции E1 часто наблюдаются в качестве побочных реакций на механизмы S N 1.
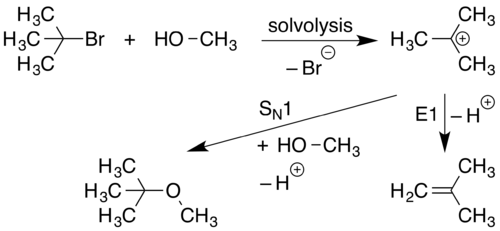
Устранения E1 продолжаются с ликвидацией уходящей группы, ведущей к E. обозначению Поскольку этот механизм продолжается с начальной диссоциацией одного начального материала, образующего карбокацию, этот процесс считается униомолекулярной реакцией. Участие только 1 вида в начальной фазе реакции усиливает механистическое обозначение до E1 .
E2 Устранения
[ редактировать ]Элиминация E2 происходит, когда протон, прилегающий к оставшейся группе, извлекается основом с одновременным устранением уходной группы и генерации двойной связи.

Подобно взаимосвязи между выбросами E1 и механизмами S N 1, E2 -levinations часто возникают в конкуренции с реакциями S N 2. Это наблюдение чаще всего отмечается, когда основание также является нуклеофилом. Чтобы свести к минимуму эту конкуренцию, неклеофильные основы обычно используются для воздействия на элинации E2.

Элементации E2 происходят посредством первоначальной экстракции протона основом или нуклеофилом, что приводит к ограничению E уходной группы, оправдывающей E. обозначение Поскольку этот механизм проходит через взаимодействие двух видов (субстрат и основание/нуклеофил), реакции E2 распознаются как би-молекулярный. Таким образом, участие 2 видов в начальную фазу реакции усиливает механистическое обозначение до E2 .
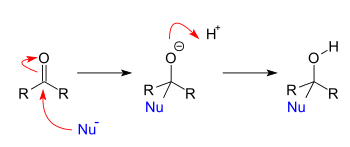
Реакции дополнения
[ редактировать ]Реакции добавления возникают, когда нуклеофилы реагируют с карбонилами . Когда нуклеофил добавляет к простому альдегиду или кетону , результатом является 1,2-добавление. Когда нуклеофил добавляет конъюгированную карбонильную систему, результатом является 1,4-аддиция. Обозначения 1,2 и 1,4 получены из нумерации атомов стартового соединения, где кислород помечен «1», и каждый атом, прилегающий к кислороду, последовательно пронумерована в месте нуклеофильного добавления. 1,2-добавление происходит с нуклеофильным добавлением к положению 2, в то время как 1,4-добавление происходит с нуклеофильным добавлением к положению 4.

Реакции с добавлением элиминации
[ редактировать ]Реакции с добавлением элиминации являются реакциями добавления сразу же с последующими реакциями элиминации. В целом, эти реакции происходят, когда сложные эфиры (или связанные функциональные группы) реагируют с нуклеофилами. Фактически, единственным требованием для реализации элиминации дополнения является то, что устранение группы-это лучшая группа, чем входящий нуклеофил.

Смотрите также
[ редактировать ]Примечания
[ редактировать ]- ^ Jump up to: а беременный Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Wothers, Peter (2001). Органическая химия (1 -е изд.). Издательство Оксфордского университета. С. 123–133. ISBN 978-0-19-850346-0 .
- ^ Абхик Гош, Штеффен Берг, Стрелка, проталкивающая неорганическую химию: логический подход к химии элементов основной группы (John Wiley & Sons, 2014).
- ^ Кермак, Уильям Огилви; Робинсон, Роберт (1922). «Объяснение свойства индуцированной полярности атомов и интерпретации теории частичных валентных веществ на электронных основаниях» . Журнал химического общества, транзакции . 121 : 427–440. doi : 10.1039/ct9222100427 .
- ^ Гош, Абхик; Вамзер, Карл (2022). «Кудрявая стрела химии достигает 100» . Американский ученый . 110 (6): 338. doi : 10.1511/2022.110.6.338 . ISSN 0003-0996 . S2CID 252883623 .
- ^ Мяч, Филипп (2022-02-14). «Столетие вьющихся стрел» . Chemistryworld.com . Получено 2022-12-22 .
- ^ Boikess, Robert S. (2015). Химические принципы для органической химии . Стэмфорд, Ct. ISBN 978-1-285-45769-7 Полем OCLC 881840629 .
{{cite book}}: CS1 Maint: местоположение отсутствует издатель ( ссылка ) - ^ «Примечания на толкание стрелки (кудрявые стрелки)» (PDF) . Имперский колледж Лондон . Получено 2009-04-27 .
- ^ «Реакции свободных радикалов - один электронный промежуточный продукт» . Вашингтонский государственный университет . Получено 2009-05-02 .
- ^ «3.3: Средства стрелы» . Химия Либретлекты . 2019-04-15 . Получено 2022-11-18 .
- ^ Лю, Синь (2021-12-09). «9.1 гомолитическое и гетеролитическое расщепление». Органическая химия i . Прессбуки .
- ^ «Определения кислот и оснований Льюиса» . Chemed.chem.purdue.edu . Получено 2022-11-18 .
- ^ Ричардсон, Жаки (2020-09-16). «Loudon Ch. 3 Обзор: кислоты/основания/изогнутые стрелки» (PDF) .
- ^ "Бренстеды кислоты и основания" . Chemed.chem.purdue.edu . Получено 2022-11-18 .
- ^ «11.5: Характеристики реакции SN1» . Химия Либретлекты . 2015-05-03 . Получено 2022-10-31 .
- ^ «11.3: Характеристики реакции SN2» . Химия Либретлекты . 2015-05-03 . Получено 2022-10-31 .
- ^ Кляйн, Дэвид Р. (2012). Органическая химия . Хобокен, Нью -Джерси: Уайли. ISBN 978-0-471-75614-9 Полем OCLC 729915305 .
Ссылки
[ редактировать ]- Даниэль Э. Леви, стрельба из органической химии: легкий подход к пониманию механизмов реакции - второе издание (John Wiley & Sons, 2017)
- Даниэль П. Уикс, Толкание электронов: руководство для студентов органической химии (Brooks Cole, 1998)
- Абхик Гош, Штеффен Берг, Стрелка, проталкивающая неорганическую химию: логический подход к химии элементов основной группы (John Wiley & Sons, 2014)
- Роберт Б. Гроссман, Искусство написания разумных механизмов органической реакции, (Springer, 2007)
Внешние ссылки
[ редактировать ]- Mit.edu , Opencourseware: органическая химия I
- Haverford.edu , Органическая химическая лекции, видео и текст
- Cem.msu.edu , Виртуальный учебник органической химии