Кислотно-щелочная экстракция
Кислотно-основная экстракция представляет собой подкласс жидкостно-жидкостных экстракций и включает отделение химических веществ от других кислотных или основных соединений. [1] Обычно это выполняется на этапе обработки после химического синтеза для очистки сырых соединений. [2] и в результате продукт практически не содержит кислотных или основных примесей. . делительную воронку Для проведения кислотно-щелочной экстракции обычно используют [3]
Кислотно-основная экстракция использует разницу в растворимости соединения в его кислотной или основной форме, чтобы вызвать разделение. [4] Обычно желаемое соединение преобразуется в заряженную кислотную или основную форму, в результате чего оно становится растворимым в водном растворе и, таким образом, экстрагируется из неводного (органического) слоя. [5] Кислотно-основная экстракция является простой альтернативой более сложным методам, таким как хроматография . Этим простым методом невозможно разделить химически схожие кислоты и основания. [6]
Фоновая теория
[ редактировать ]Кислотно-основная экстракция основана на фундаментальном принципе, согласно которому соли представляют собой ионные соединения с высокой растворимостью в воде, тогда как нейтральные молекулы обычно не растворяются в воде. [1]
Рассмотрим смесь кислотных и основных соединений, растворенную в органическом растворителе . Добавление водной кислоты приведет к тому, что кислотный компонент останется незаряженным, в то время как основной компонент будет протонирован с образованием соли. [6] Незаряженный кислотный компонент останется растворенным в органическом растворителе, тогда как сильно заряженная основная соль мигрирует в водный растворитель. [3] Поскольку кислотные и основные компоненты теперь находятся в двух разных слоях, их можно легко разделить.

Альтернативно, добавление водного основания приведет к депротонированию кислотного компонента и образованию соли, в то время как основной компонент останется незаряженным. [6] В этом случае незаряженное основание останется в органическом слое, а сильнозаряженная кислая соль мигрирует в водный слой.
Если компонент органической кислоты относительно слабый и имеет pK значение ~ 5 (например, карбоновая кислота ), добавление дополнительной кислоты может еще больше улучшить разделение за счет снижения pH раствора. Это сводит к минимуму самоионизацию компонента органической кислоты и ограничивает ее склонность к проникновению в водный слой. [6] Этот принцип также применим к органическому основанию, если оно является относительно слабым основанием. [6]
Хотя кислотно-основные экстракции чаще всего используются для отделения кислот от оснований, их можно использовать для отделения двух кислот или двух оснований друг от друга. Однако кислоты и основания должны сильно различаться по силе, например, одна сильная кислота и одна очень слабая кислота. [1] Следовательно, две кислоты должны иметь pK a (или pK b как можно большую разницу ). Например, можно выделить:
- Очень слабые кислоты, такие как фенолы (pK около 10), от более сильных кислот, таких как карбоновые кислоты. [1] (pK a около 4–5).
- Очень слабые основания (pK b около 13–14) от более сильных оснований (pK b около 3–4). Это часто используется при очистке почвы для определения концентрации микроэлементов. [7]
При разделении двух кислот или двух оснований pH обычно доводят до значения, примерно находящегося между константами pK a (или pK b ). [1] Разделение происходит при этом промежуточном значении pH, поскольку один компонент полностью ионизирован, а другой полностью находится в нейтральной форме. Часто растворы, используемые для экстракции кислот или оснований, также можно использовать для контроля pH. При разделении двух кислот смесь сначала промывают слабым основанием (например, бикарбонатом натрия ) для извлечения сильной кислоты, затем промывают сильным основанием (например, гидроксидом натрия ) для извлечения слабой кислоты. [8] Для разделения основных компонентов слабая кислота (например, разбавленная уксусная кислота сначала используется ) для извлечения более сильного основания, затем используется более концентрированная кислота (например, соляная кислота или азотная кислота ) для создания сильнокислых значений pH и отделения более слабого основания. [3] [7]
Техника
[ редактировать ]При проведении кислотно-щелочной экстракции смеси, содержащей кислотное и/или основное соединение, обычно соблюдают следующую процедуру:
- Смесь соединений растворяют в подходящем органическом растворителе, таком как дихлорметан или диэтиловый эфир .
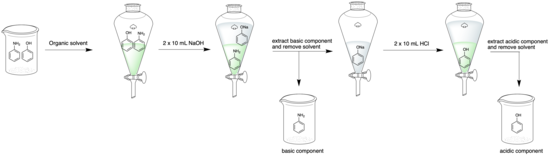
Пример кислотно-основной экстракции двух компонентов: кислого фенола и основного фениламина. Фениламин сначала собирают в органическом слое, затем фенол собирают из водного слоя. Зеленый слой в делительной воронке указывает на органический слой, а бесцветный слой — на водный слой. - Раствор добавляют в делительную воронку. Если желаемое соединение является основным, раствор промывают водным раствором кислоты (например, 5% HCl); если он кислый, раствор промывают водным основанием (например, 5% NaOH). [9]
- Затем фракции встряхивают и две фазы разделяют. Делительную воронку необходимо часто проветривать, чтобы уменьшить повышение давления, особенно если в ней содержатся водные растворы, при нейтрализации которых выделяется углекислый газ (например, бикарбонат натрия ). [9]
- Затем собирают фракцию, содержащую интересующий аналит. Обычно это водный слой, поскольку добавление кислоты или основания привело к тому, что аналит стал заряженным и хорошо растворился в водном слое. [9] Идентичность водного слоя критически зависит от плотности органического растворителя. Органические растворители с плотностью более 1,00 г/мл (например, дихлорметан) заставляют водный слой всплывать вверх, а растворители с плотностью ниже 1,00 г/мл (например, эфир) заставляют водный слой опускаться на дно. [9]
- Органическую фракцию снова добавляют в делительную воронку, и шаги 2–4 повторяют еще дважды, чтобы максимизировать выход экстракции. При окончательном промывании соляной раствор вытесняет оставшийся водный раствор из органического слоя. [10]
- Если оставшийся органический слой не содержит представляющих интерес аналитов, его отбрасывают; в противном случае растворитель сушат над подходящим сушильным агентом (таким как безводный сульфат натрия ), фильтруют, затем выпаривают при пониженном давлении с получением чистого соединения. Если водный слой содержит интересующий аналит, его pH доводят до противоположного значения (например, от основного до кислого). Шаги 1-4 повторяются с этой фракцией, используя водный раствор с противоположным pH (например, от NaOH до HCl). Эта круговая процедура выполняется, поскольку обычно гораздо легче удалить органический растворитель с помощью роторного испарения, чем водный растворитель. [11]
Обычное использование в химическом синтезе
[ редактировать ]Кислотно-основная экстракция часто используется в качестве первого этапа процедуры обработки после химического синтеза. [2] для удаления кислотных и основных исходных материалов или примесей. [3] Кислотно-основная экстракция обычно является предшественником более сложных методов очистки, таких как перекристаллизация , если синтезированный продукт еще не является полностью чистым. [12]
В органическом синтезе при обработке часто используются кислотно-щелочные экстракции. Например, рассмотрим этерификацию по Фишеру – конденсацию карбоновой кислоты со спиртом с образованием сложного эфира . Постреакционная смесь часто состоит из небольших количеств остатков кислоты и спирта в дополнение к желаемому эфиру. [13] Кислотно-основную экстракцию можно использовать для легкого отделения кислотных исходных веществ от сложного эфира. При промывании смеси сырых продуктов слабым основанием (например, бикарбонатом натрия ) карбоновая кислота и спирт вымываются водным слоем, оставляя очищенный эфир в органическом слое. [14] Выбор основания, используемого для экстракции, имеет решающее значение, поскольку сильное основание (например, гидроксид натрия ) гидролизует сложный эфир.
Другой распространенный пример кислотно-основной экстракции происходит после связывания пептидов , когда амидный продукт необходимо отделить от остатков карбоновой кислоты и амина . Карбоновую кислоту можно удалить промывкой органического слоя слабым основанием (бикарбонатом натрия), а амин можно удалить промывкой слабой кислотой (10%-ной соляной кислотой ). [15] После этих двух экстракций амид останется в органическом слое и будет значительно очищен.
Поиск неисправностей
[ редактировать ]Следующие проблемы обычно наблюдаются во время кислотно-щелочной экстракции и обычно имеют простые решения.
- В делительной воронке наблюдается только один слой.
- Это связано с использованием органического растворителя, хорошо смешивающегося с водой (например, ацетонитрила ). Используемый органический растворитель должен быть нерастворимым в воде, чтобы обеспечить разделение фаз и провести кислотно-щелочную экстракцию. [9]
- В делительной воронке образуются три слоя.
- Часто это является результатом недостаточного перемешивания, и легкое перемешивание решит проблему. [9]
- Граница между органическим слоем и водным слоем не наблюдается .
- Лед можно использовать для определения границы, поскольку он будет плавать между двумя слоями. [9]
- Образуется эмульсия , и один слой суспендируется в другом в виде крошечных капель.
- Эту проблему можно решить, используя стеклянную палочку для перемешивания, чтобы аккуратно «вталкивать» крошечные капли друг в друга, что в конечном итоге приводит к разделению и появлению двух слоев. Для разрушения эмульсии можно также добавить небольшое количество рассола; этот процесс называется «высаливанием». [16] Образование эмульсий можно предотвратить, смешивая растворы осторожно, а не энергично.
- Относительные положения водного/органического слоев неизвестны.
- В делительную воронку можно добавить небольшое количество воды. В какой бы слой ни попадали эти капли, он определяется как водный слой. [17]
Ограничения
[ редактировать ]Кислотно-основная экстракция эффективна при разделении соединений с большой разницей в растворимости между их заряженной и незаряженной формой. [4] Таким образом, эта процедура не подойдет для:
- Цвиттер-ионы с кислотными и основными функциональными группами в одной молекуле.
- Например, глицин растворим в воде при большинстве значений pH. [18] и поэтому его трудно экстрагировать в органическую среду.
- Липофильные соединения.
- Такие соединения, как соли тетрабутиламмония или жирные кислоты, с трудом растворяются в водной фазе в заряженной форме. [19]
- Основные амины.
- Аммины, такие как аммиак , метиламин или триэтаноламин, смешиваются или значительно растворимы в воде при большинстве значений pH и не могут быть экстрагированы в органические среды. [20]
- Гидрофильные неорганические кислоты.
- Кислоты, такие как уксусная кислота, неограниченно смешиваются с водой и имеют ограниченную растворимость в органических растворителях. [21]
Альтернативы
[ редактировать ]Альтернативы кислотно-щелочной экстракции включают:
- Фильтрация смеси через пробку из силикагеля или оксида алюминия . Если продукт представляет собой заряженную соль, он останется прочно адсорбированным на силикагеле или оксиде алюминия. [22]
- Ионообменная хроматография позволяет разделять кислоты, основания или смеси сильных и слабых кислот и оснований в зависимости от их разного сродства к среде колонки при разных значениях pH. [23]
- Использование колоночной хроматографии для разделения нейтральных соединений в соответствии со значениями их отношения фронтов. [24]
- Гель-электрофорез , который разделяет крупные биомолекулы в зависимости от их заряда и размера. [25]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и «Кислотно-щелочная экстракция» . Химия LibreTexts . 03.10.2013 . Проверено 23 октября 2022 г.
- ^ Jump up to: а б Сюй, Бо; Хаммонд, Джеральд Б. (17 октября 2014 г.). «Быстрая химическая реакция на основе экстракции жестким растворителем» . Органические письма . 16 (20): 5238–5241. дои : 10.1021/ol501418t . ISSN 1523-7052 . ПМИД 25296390 .
- ^ Jump up to: а б с д «Экстракция в теории и практике (часть I)» . www.chem.ucla.edu . Проверено 11 октября 2022 г.
- ^ Jump up to: а б Асадискандар, Амир; Резенде Миранда, Рената; Бройер, Ребекка М. (12 мая 2020 г.). «Визуальное отслеживание кислотно-щелочной экстракции с использованием красочных соединений» . Журнал химического образования . 97 (5): 1402–1405. Бибкод : 2020JChEd..97.1402A . doi : 10.1021/acs.jchemed.0c00196 . ISSN 0021-9584 . S2CID 219025790 .
- ^ «7.5: Водные растворы и растворимость – соединения, растворенные в воде» . Химия LibreTexts . 01.07.2019 . Проверено 22 октября 2022 г.
- ^ Jump up to: а б с д и Купер, Раймонд; Дикин, Джеффри Джон (2016). Ботанические чудеса: химия растений, изменивших мир . ЦРК Пресс. п. 125. ИСБН 9780367076214 .
- ^ Jump up to: а б Фаландыш, Ежи; Чудзинский, Кшиштоф; Койта, Анна К.; Яжиньска, Гражина; Древновская, Малгожата (01 сентября 2012 г.). «Сравнение двух методов кислотной экстракции для определения минералов в почвах под подберезовиком лиственницы (Suillus grevillei) с целью оценки потенциала секвестрации минералов в плодовых телах» . Журнал экологических наук и здоровья, часть A. 47 (11): 1607–1613. дои : 10.1080/10934529.2012.680781 . ISSN 1093-4529 . ПМИД 22702820 . S2CID 24133083 .
- ^ Килуэй, Кэтлин; Клевенджер, Роберт (2006). «Извлечение» (PDF) . Университет Миссури — Канзас-Сити .
- ^ Jump up to: а б с д и ж г «Экстракция в теории и практике (часть I)» . www.chem.ucla.edu . Проверено 11 октября 2022 г.
- ^ «Советы и подсказки MedChem » Портал фармацевтического круглого стола ACS GCI» . Проверено 17 октября 2022 г.
- ^ «Индекс /mcdaniel/chem269/experiments/acidbase» . люди.chem.umass.edu . Проверено 17 октября 2022 г.
- ^ Джасперс, Крейг. «Жидкие жидкие экстракты» (PDF) . Государственный университет Миннесоты .
- ^ «Кислотно-щелочная экстракция» . Химия LibreTexts . 03.10.2013 . Проверено 23 октября 2022 г.
- ^ Кам, Калеб М.Т.; Левонис, Стефан М.; Швейкер, Стефани С. (14 июля 2020 г.). «Визуальная органохимическая реакция: синтез метилового эфира 4-амино-3-нитробензойной кислоты посредством этерификации по Фишеру» . Журнал химического образования . 97 (7): 1997–2000. Бибкод : 2020ЮЧЭд..97.1997К . doi : 10.1021/acs.jchemed.9b01168 . ISSN 0021-9584 . S2CID 225653198 .
- ^ «Связывающие реагенты» (PDF) . Парижский университет — Сакле .
- ^ «Экстракция в теории и практике (часть I)» . www.chem.ucla.edu . Проверено 11 октября 2022 г.
- ^ «4.4: Какой слой какой?» . Химия LibreTexts . 21 октября 2017 г. Проверено 23 октября 2022 г.
- ^ Ян, Ся; Ван, Сюцзюань; Чинг, Чи Бун (1 мая 2008 г.). «Растворимость формы α и формы γ глицина в водных растворах» . Журнал химических и инженерных данных . 53 (5): 1133–1137. дои : 10.1021/je7006988 . ISSN 0021-9568 .
- ^ «Липофильность — обзор | Темы ScienceDirect» . www.sciencedirect.com . Проверено 23 октября 2022 г.
- ^ ПабХим. «Триэтиламин» . pubchem.ncbi.nlm.nih.gov . Проверено 23 октября 2022 г.
- ^ ПабХим. «Уксусная кислота» . pubchem.ncbi.nlm.nih.gov . Проверено 23 октября 2022 г.
- ^ «Процедура органического синтеза» . orgsyn.org . Проверено 23 октября 2022 г.
- ^ Кунин, Роберт; МакГарви, FX (1 апреля 1962 г.). «Ионообменная хроматография» . Аналитическая химия . 34 (5): 48р–50р. дои : 10.1021/ac60185a005 . ISSN 0003-2700 .
- ^ «Хроматография» , ACS Reagent Chemicals , Вашингтон, округ Колумбия: Американское химическое общество, январь 2017 г., номер документа : 10.1021/acsreagents.2007 , ISBN 978-0-8412-3046-0 , получено 23 октября 2022 г.
- ^ Бутс, Шэрон (15 апреля 1989 г.). «Гель-электрофорез ДНК» . Аналитическая химия . 61 (8): 551А–553А. дои : 10.1021/ac00183a002 . ISSN 0003-2700 . ПМИД 2719273 .
Внешние ссылки
[ редактировать ]- Экстракция кислотной основы. Архивировано 3 марта 2016 г. в Wayback Machine.


