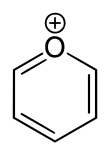
Пирилий
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
Пирилий [1] | |||
| Другие имена
Пираниум
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 1421881 | |||
| КЭБ |
| ||
| ХимическийПаук | |||
| 558560 | |||
ПабХим CID
|
|||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 5 Н 5 О + | |||
| Молярная масса | 81.09 g/mol | ||
| Родственные соединения | |||
Родственные соединения
|
тиопирилий , селенопирилий , теллуропирилий | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Пирилий представляет собой катион (положительный ион ) с формулой С 5 Н 5 О + , состоящий из шестичленного кольца из пяти атомов углерода , каждый из которых содержит один атом водорода и один положительно заряженный кислорода атом . Связи в кольце сопряжены , как в бензоле , что придает ему ароматический характер. В частности, из-за положительного заряда атом кислорода трехвалентен . Пирилий — моноциклическое и гетероциклическое соединение , один из ионов оксония .
Соли
[ редактировать ]Пирилий и его производные образуют стабильные соли с множеством анионов. [2] [3] [4] [5] [6] [7]
Производные
[ редактировать ]Многие важные катионы формально образуются из пирилия путем замещения различных функциональных групп на некоторые или все атомы водорода в кольце. , 2,4,6-трифенилпирилий называемый солью Катрицкого (в честь Алана Р. Катрицкого ), является важным примером, используемым во многих современных примерах перекрестных связей , катализируемых металлами . [8]
Химические свойства
[ редактировать ]Как и другие ионы оксония , пирилий нестабилен в нейтральной воде. Однако пирилий гораздо менее реакционноспособен, чем обычные ионы оксония, из-за ароматической стабилизации. Соль 2,4,6-трифенила обычно реагирует с алифатическими аминами в положении 1, образуя соли пиридиния и активируя их в сторону окислительного присоединения с помощью комплексов металлов, особенно с никелем . [9] Катионы пирилия также реагируют с нуклеофилами в положениях 2, 4 и 6, что может вызывать различные реакции. Высокая электроотрицательность кислорода приводит к сильному однократному возмущению одним гетероатомом в шестичленном кольце.
Синтез
[ редактировать ]Соли пирилия легко получают из простых исходных материалов посредством реакции конденсации .
Соли пирилия с ароматическими заместителями, такие как тетрафторборат 2,4,6-трифенилпирилия, можно получить из двух молей ацетофенона и одного моля бензальдегида в присутствии тетрафторборной кислоты и окислителя (синтез Дилти). Для солей пирилия с алкильными заместителями, например солей 2,4,6-триметилпирилия, наилучшим методом является синтез Балабана — Неницеску — Прайля из третичного бутанола и уксусного ангидрида в присутствии тетрафторборной, хлорной или трифторметансульфоновой кислот. [10] [11] Соли 2,4,6-трифенилпирилия под действием оснований превращаются в стабильный 1,5-ендион (псевдобоснование), а соли 2,4,6-триметилпирилия при обработке горячими гидроксидами щелочных металлов образуют нестабильное псевдооснование, которое подвергается внутримолекулярной конденсации с образованием 3 ,5- диметилфенол . В теплом оксиде дейтерия соли 2,4,6-триметилпирилия подвергаются изотопному обмену 4-метиловых атомов водорода быстрее, чем 2- и 6-метильных групп, что позволяет синтезировать региоселективно дейтерированные соединения.
Производные
[ редактировать ]Реакционная способность солей пирилия по отношению к нуклеофилам делает их полезными материалами для получения других соединений с более сильным ароматическим характером. Соли пирилия дают пиридины с аммиаком . [12] соли пиридиния с первичными аминами, пиридин -N -оксиды с гидроксиламином , фосфабензолы с производными фосфина , соли тиопирилия с сероводородом и производные бензола с ацетонитрилом или нитрометаном .
Пироны
[ редактировать ]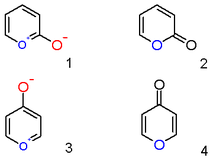
Катион пирилия с гидроксильным заместителем цвиттерионное в положении 2 представляет собой не ароматическое соединение ( 1 ), а нейтральный ненасыщенный лактон 2-пирон или пиран-2-он ( 2 ). Важными представителями этого класса являются кумарины . Аналогичным образом соединение 4-гидроксипирилия представляет собой γ-пирон или пиран-4-он ( 4 ), к группе которого принадлежат такие соединения, как мальтол .
Химические свойства
[ редактировать ]
Известно, что 2-пироны реагируют с алкинами по реакции Дильса-Альдера с образованием ареновых соединений с выделением углекислого газа , например: [13]
Полициклические ионы пирилия
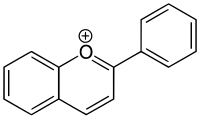
[ редактировать ]Хроменилий ион
[ редактировать ]Один бициклический ион пирилия называется ионом бензопирилия ( IUPAC : ион хроменила) (формула: C9H7C9H7O + , молярная масса: 131,15 г/моль, точная масса: 131,04968983). Его можно рассматривать как заряженное производное 2 H -1- бензопирана (IUPAC: 2 H -хромен, C 9 H 8 O ), или (заряженное) замещенное гетероциклическое производное нафталина ( С 10 Н 8 ).
Флавилий ион
[ редактировать ]В биологии ион 2-фенилбензопирилия (2-фенилхроменилия) называют флавилием. Класс соединений, производных флавилия, — это антоцианидины и антоцианы — пигменты, которые отвечают за окраску многих цветов. [ нужна ссылка ]
Катион нафтоксантения
[ редактировать ]Существуют также высшие полициклические производные пирилия. Хорошим примером является нафтоксантений . Этот краситель очень стабилен, ароматичен и плоский. Он поглощает УФ- и синий диапазон и обладает исключительными фотофизическими свойствами. Его можно синтезировать химическими или фотохимическими реакциями. [14]
-
Бензопирилий хлорид (хроменилий хлорид), соль с хлоридом в качестве противоиона.
-
Катион флавилия
-
Катион нафтоксантения
См. также
[ редактировать ]- 6-членные ароматические кольца с заменой одного углерода на другую: борабензол , силабензол , германбензол , оловобензол , пиридин , фосфорин , арсабензол , стибабензол , бисмабензол , пирилий , тиопирилий , селенопирилий , теллуропирилий.
- Пиран , C 5 H 6 O (пироны, лишенные кетоновой группы)
Ссылки
[ редактировать ]- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество . п. 1097. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Гилкрист, ТЛ (1997). Гетероциклическая химия . ISBN 0-582-27843-0 .
- ^ Балабан, АТ; Шрот, В.; Фишер, Г. (1969). Катрицкий, Арканзас; Бултон, Эй Джей (ред.). Пирилиевые соли. I. Синтез . Достижения гетероциклической химии. Том. 10. Нью-Йорк: Академик Пресс. стр. 241–326. дои : 10.1016/S0065-2725(08)60499-7 .
- ^ Балабан, АТ; Динкулеску, А.; Дорофеенко Г.Н.; Фишер, Г.В.; Коблик А.В.; Межерицкий В.В.; Шрот, В. (1982). Катрицкий, А.Р. (ред.). Соли пирилия. Синтезы, реакции и физические свойства . Достижения гетероциклической химии: Приложение. Том. 2. Нью-Йорк: Академик Пресс. ISBN 978-0-12-020652-0 .
- ^ Балабан, АТ (1979). «Катион пирилия как синтон в органической химии» . в Митре, РБ; Айянгар, Северная Каролина; Гогте, В.Н.; Ачесон, РМ; Кромвель, Н. (ред.). Новые тенденции в гетероциклической химии . Исследования по органической химии. Том. 3. Амстердам: Эльзевир. стр. 79–111 . ISBN 978-0-444-41737-4 .
- ^ Балабан, АТ (1987). «Соли пирилия как полезные синтоны». В Чизов О. (ред.). Органический синтез: современные тенденции . Оксфорд: Блэквелл. стр. 263–274. ISBN 0-632-02014-8 .
- ^ Балабан, Т.С.; Балабан, АТ (2003). «Соли пирилия». Гетарены и родственные кольцевые системы. Шестичленные гетарены с одним халькогеном . Наука синтеза; Методы молекулярных превращений Губена-Вейля. Том. 14. Штутгарт: Георг Тиме Верлаг. стр. 11–200. ISBN 978-3-13-118641-6 .
- ^ Балабан, АТ; Рэй, В. (1977). " 13 Спектры ЯМР С некоторых солей пирилия и родственных соединений». Органический магнитный резонанс . 9 (1): 16–22. doi : 10.1002/mrc.1270090105 .
- ^ Панг, Юэ; Мозер, Дэниел; Корнелла, Хосеп (2020). «Соли пирилия: селективные реагенты для активации первичных аминогрупп в органическом синтезе» . Синтез . 52 (4): 489–503. дои : 10.1055/s-0039-1690703 . S2CID 208705148 .
- ^ Балабан, АТ; Бултон, Эй Джей (1973). «2,4,6-Триметилпирилий тетрафторборат» (PDF) . Органические синтезы ; Сборник томов , т. 5, стр. 1112–1113 .
- ^ Балабан, АТ; Бултон, Эй Джей (1973). «Трифторметансульфонат 2,4,6-триметилпирилия» (PDF) . Органические синтезы ; Сборник томов , т. 5, стр. 1114–1116 .
- ^ Андерсон, АГ; Стэнг, Пи Джей (1981). «2,6-Дит - трет -Бутил-4-метилпиридин» (PDF) . Органические синтезы . 60:34 ; Сборник томов , т. 7, с. 144 .
- ^ Делани, премьер-министр; Мур, Дж. Э.; Харрити, JPA (2006). «Путь циклоприсоединения алкинилбороновых эфиров к функционализированным ароматическим эфирам бороновой кислоты». Химические коммуникации . 2006 (31): 3323–3325. дои : 10.1039/b607322k . ПМИД 16883424 .
- ^ Бучер, Г.; Брезоли-Обах, Р.; Броза, К.; Флорс, К.; Луис, Дж.Л.; Грилло, штат Калифорния; Нонелл, С. (2014). «β-Фениловое тушение 9-фенилфеналенонов: новая реакция фотоциклизации с биологическими последствиями». Физическая химия Химическая физика . 16 (35): 18813–18820. Бибкод : 2014PCCP...1618813B . дои : 10.1039/C4CP02783C . ПМИД 25079707 .