Тейкопланин
 | |
| Клинические данные | |
|---|---|
| Произношение | / ˌ t aɪ k oʊ ˈ p l eɪ n ɪ n / ТИ -ты- ИГРАЕШЬ -ниндзя |
| Торговые названия | Таргоцид |
| AHFS / Drugs.com | Международные названия лекарств |
| Беременность категория |
|
| Маршруты администрация | Внутривенно , внутримышечно |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Биодоступность | 90% (с учетом IM ) |
| Связывание с белками | от 90% до 95% |
| Метаболизм | ноль |
| Период полувыведения | от 70 до 100 часов |
| Экскреция | Почки (97% без изменений) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| НИАИД Химическая база данных | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
| Формула | Переменная |
| Молярная масса | от 1564,3 до 1907,7 г/моль |
| Температура плавления | 260 °C (500 °F) (разл.) |
| | |
Тейкопланин — полусинтетический гликопептидный антибиотик со спектром активности, сходным с ванкомицином . Механизм его действия заключается в ингибировании клеточной стенки бактерий. [ 3 ] пептидогликан [ 4 ] синтез. Он используется для профилактики и лечения серьезных инфекций, вызванных грамположительными бактериями , включая метициллин-резистентный Staphylococcus aureus и Enterococcus faecalis . [ 3 ]
Тейкопланин продается компанией Санофи-Авентис под торговым названием Таргоцид . Другие торговые названия включают Тикоцин , продаваемый компанией Cipla (Индия).
Было продемонстрировано, что пероральный тейкопланин эффективен при лечении псевдомембранозного колита и диареи, вызванной Clostridium difficile , с сопоставимой эффективностью с ванкомицином. [ 5 ]
Считается, что его прочность обусловлена длиной углеводородной цепи. [ 6 ]
Тейкопланин продуцируется так называемой «редкой» актинобактерией Actinoplanes teichomyceticus ATCC 31121, [ 7 ] Относятся к семейству Микромоноспоровые . Путь биосинтеза, ведущий к тейкопланину, а также регуляторная цепь, регулирующая биосинтез, в последние годы интенсивно изучаются, что позволяет построить интегрированную модель биосинтеза. [ 8 ]
Показания
[ редактировать ]Тейкопланин применим для лечения широкого спектра инфекций, вызванных грамположительными бактериями, включая эндокардит, сепсис, инфекции мягких тканей и кожи, а также инфекции, связанные с венозным катетером. [ 9 ]
Восприимчивые организмы
[ редактировать ]Тейкопланин продемонстрировал эффективность in vitro против грамположительных бактерий, включая стафилококки (включая MRSA), стрептококки, энтерококки, а также против анаэробных грамположительных бактерий, включая Clostridium spp. Тейкопланин не эффективен против грамотрицательных бактерий, поскольку крупные полярные молекулы соединения не могут проходить через внешнюю мембрану этих организмов. [ 9 ] Ниже представлены данные о чувствительности МПК к некоторым значимым с медицинской точки зрения патогенам: [ 4 ]
- Clostridium difficile : 0,06 мкг/мл - 0,5 мкг/мл
- Золотистый стафилококк : ≤0,06 мкг/мл - ≥128 мкг/мл
- Staphylococcus epidermidis : ≤0,06 мкг/мл - 32 мкг/мл
Фармакология
[ редактировать ]Тейкопланин имеет очень длительный биологический период полувыведения, составляющий около 45–70 часов (таким образом, при приеме один раз в день можно поддерживать достаточные уровни в плазме). Элиминация происходит почти исключительно почками. Чаще всего выводится в неизмененном виде. [ 9 ]
Побочные эффекты
[ редактировать ]Побочные эффекты тейкопланина обычно ограничиваются местными эффектами или реакциями гиперчувствительности. Хотя существует потенциал нефротоксичности и ототоксичности, случаи такой органной токсичности редки, если успешно поддерживается рекомендуемая концентрация в сыворотке крови. [ 9 ]
Соображения
[ редактировать ]Снижение функции почек замедляет клиренс тейкопланина, что приводит к увеличению периода его полувыведения. Период полувыведения длиннее у пожилых людей из-за сниженной функции почек в этой группе населения. [ 9 ]
Химия
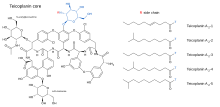
[ редактировать ]Тейкопланин (ТАРГОКИД, продаваемый компанией Sanofi Aventis Ltd) на самом деле представляет собой смесь нескольких соединений: пяти основных (названных тейкопланином от А 2 -1 до А 2 -5 ) и четырех второстепенных (названных тейкопланином от RS-1 до RS-4 ). [ 10 ] [ 11 ] Все тейкопланины имеют одно и то же гликопептидное ядро, называемое тейкопланином А 3 -1 — слитую кольцевую структуру, к которой два углевода ( манноза и N -ацетилглюкозамин присоединены ). Мажорный и минорный компоненты также содержат третий углеводный фрагмент — β- D -глюкозамин — и различаются только длиной и конформацией присоединенной к нему боковой цепи . Тейкопланин А 2-4 и RS-3 имеют хиральные боковые цепи, тогда как все остальные боковые цепи являются ахиральными. В тейкопланине А3 отсутствуют как боковые цепи, так и фрагмент β- D -глюкозамина .
Структуры ядра тейкопланина и боковых цепей, которые характеризуют пять основных, а также четыре второстепенных соединения тейкопланина, показаны ниже.

Тейкопланин относится к комплексу родственных натуральных продуктов, выделенных из ферментационного бульона штамма Actinoplanes teichomyceticus . [ 12 ] состоящий из группы из пяти структур. Эти структуры обладают общим агликоном, или ядром, состоящим из семи аминокислот, связанных пептидными и эфирными связями, образующими четырехкольцевую систему. Эти пять структур различаются идентичностью жирной ацильной боковой цепи, прикрепленной к сахару. Происхождение этих семи аминокислот в биосинтезе тейкопланина изучали 1 Рука 13 С ядерный магнитный резонанс. [ 13 ] Исследования показывают, что аминокислоты 4-Hpg , 3-Cl-Tyr и 3-хлор-β-гидрокситирозин происходят из тирозина, а аминокислота 3,5-дигидроксифенилглицин (3,5-Dpg) — из ацетата. Тейкопланин содержит 6 непротеиногенных аминокислот и три сахарных фрагмента: N -ацил-β-D-глюкозамин, N -ацетил-β-D-глюкозамин и D-маннозу.
Генный кластер
[ редактировать ]Исследование генетического кластера, кодирующего биосинтез тейкопланина, выявило 49 предполагаемых открытых рамок считывания (ORF), участвующих в биосинтезе, экспорте, устойчивости и регуляции этого соединения. Тридцать пять из этих ORF подобны тем, которые обнаружены в других кластерах генов гликопептидов. Функция каждого из этих генов описана Ли и соавторами. [ 14 ] Краткое описание структуры и назначения гена показано ниже.
Генная раскладка . Гены пронумерованы. Буквы L и R обозначают направление транскрипции. Наличие символа * означает, что ген обнаружен после NRP, которые представлены буквами A, B, C и D. На основе рисунка: Li, TL.; Хуанг, Ф.; Хейдок, Сан-Франциско; Мироненко Т.; Лидли, ПФ; Спенсер, Дж. Б. Химия и биология. 2004, 11, с. 109.
[11-Л] [10-Л] [9-П] [8-П] [7-П] [6-П] [5-П] [4-Л][3-Л] [2-Л] [1-Р] [АР] [БР] [CR] [DR] [1*-R] [2*-R] [3*-R] [4*-R] [5*-R] [6*-R] [7*-R] [8*-R] [9*-R] [10*-R] [11*-R] [12*-R] [13 *-Р] [14*-П] [15*-П] [16*-П] [17*-П] [18*-П] [19*-П] [20*-П] [21*-П] [22 *-R] [23*-R] [24*-R] [25*-Л] [26*-Л] [27*-П] [28*-П] [29*-П] [30*-П][31*-П] [32*-Л] [33 *-Л] [34*-Р]
| Фермент, продуцируемый последовательностью гена | Регуляторные белки | Другие ферменты | Устойчивые ферменты | Ферменты биосинтеза β-гидрокситирозина и 4-гидроксифенилглицина. | Гликозилтрансферазы | Пептидсинтетазы | P450 оксигеназы | Галогеназа | Ферменты биосинтеза 3,5-дигидроксифенилглицина |
| Гены | 11, 10, 3, 2, 15*, 16*, 31* | 9, 8, 1*, 2*, 4*, 11*, 13*, 21*, 26*, 27*, 30*, 32*, 33*, 34* | 7, 6, 5 | 4, 12*, 14*, 22*, 23*, 24*, 25*, 28*, 29* | 1, 3*, 10* | А, Б, В, Г | 5*, 6*, 7*, 9* | 8* | 17*, 18*, 19*, 20*, 23* |
Синтез гептапептидного остова
[ редактировать ]Гептапептидный остов тейкопланина собирается нерибосомальными пептидными синтетазами (NRPS) TeiA, TeiB, TeiC и TeiD. Вместе они включают семь модулей, каждый из которых содержит несколько доменов, причем каждый модуль отвечает за включение одной аминокислоты. Модули 1, 4 и 5 активируют L-4-Hpg как аминоацил-АМФ, модули 2 и 6 активируют L-Tyr, а модули 3 и 7 активируют L-3,5-Dpg. Активированные аминокислоты ковалентно связаны с NRPS в виде тиоэфиров с помощью кофактора фосфопантетеина, который присоединен к домену белка-переносчика пептидила (PCP). Аминокислоты, связанные с ферментом, затем соединяются амидными связями под действием домена конденсации (C).
Гептапетид тейкопланина содержит 4 D-аминокислоты, образующиеся в результате эпимеризации активированных L-аминокислот. Каждый из модулей 2, 4 и 5 содержит домен эпимеризации (E), который катализирует это изменение. Модуль 1 не содержит домена E, и предполагается, что эпимеризация катализируется доменом C. [ 15 ] В целом шесть из семи аминокислот скелета тейкопланина состоят из непротеиногенных или модифицированных аминокислот. Одиннадцать ферментов координационно индуцируются для производства этих шести необходимых остатков. [ 16 ] Тейкопланин содержит две хлорированные позиции: 2 (3-Cl-Tyr) и 6 (3-Cl-β-Hty). Галогеназа Tei8* катализирует галогенирование обоих остатков тирозина. Хлорирование происходит на уровне аминоацил-ПХФ во время биосинтеза, до фенольного окислительного связывания, причем субстратом хлорирования может быть тирозин или β-гидрокситирозин. [ 17 ] Гидроксилирование остатка тирозина модуля 6 также происходит в транс во время сборки гептапептидного остова.
Модификация после образования гептапептидного остова
[ редактировать ]После образования гептапептидного остова линейный связанный с ферментом промежуточный продукт циклизуется. [ 16 ] Исследования разрушения генов показывают, что оксигеназы цитохрома P450 являются ферментами, осуществляющими реакции сочетания. X-домен в последнем модуле NRPS необходим для рекрутирования ферментов оксигеназы. [ 18 ] OxyB образует первое кольцо путем соединения остатков 4 и 6, а затем OxyE соединяет остатки 1 и 3. OxyA соединяет остатки 2 и 4 с последующим образованием связи CC между остатками 5 и 7 с помощью OxyC. [ 19 ] Было высказано предположение, что региоселективность и селективность атропизомеров этих вероятных реакций одноэлектронного сочетания обусловлены требованиями сворачивания и ориентации частично сшитых субстратов в активном центре фермента. [ 16 ] Реакции сочетания показаны ниже.

Было показано, что специфическое гликозилирование происходит после образования гептпептидагликона. [ 20 ] Для гликозилирования агликона тейкопланина необходимы три отдельные гликозилтрансферазы. Tei10* катализирует присоединение GlcNAc к остатку 4 с последующим деацетилированием Tei2*. Ацильная цепь (образующаяся под действием Tei30* и Tei13*) затем добавляется Tei11*. Затем Tei1 добавляет второй GlcNAc к β-гидроксильной группе остатка 6 с последующим маннозилированием остатка 7, катализируемым Tei3*. [ 21 ]
Ссылки
[ редактировать ]- ^ «Лекарственные средства по рецепту: регистрация новых дженериков и биоаналогов, 2017» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 30 марта 2024 г.
- ^ Отдел оценки лекарственных средств для человека (10 декабря 2020 г.). «Активное вещество: тейкопланин» (PDF) . Список разрешенных на национальном уровне лекарственных средств . Европейское агентство лекарственных средств.
- ^ Jump up to: а б Рейнольдс PE (ноябрь 1989 г.). «Строение, биохимия и механизм действия гликопептидных антибиотиков». Европейский журнал клинической микробиологии и инфекционных заболеваний . 8 (11): 943–950. дои : 10.1007/BF01967563 . ПМИД 2532132 . S2CID 21551939 .
- ^ Jump up to: а б «Данные о чувствительности к тейкопланину и минимальной ингибирующей концентрации (МИК)» (PDF) . ТОКУ-Э .
- ^ де Лалла Ф., Николин Р., Ринальди Э., Скарпеллини П., Риголи Р., Манфрин В. и др. (октябрь 1992 г.). «Проспективное исследование перорального тейкопланина по сравнению с пероральным ванкомицином для терапии псевдомембранозного колита и диареи, связанной с Clostridium difficile» . Антимикробные средства и химиотерапия . 36 (10): 2192–2196. дои : 10.1128/AAC.36.10.2192 . ПМК 245474 . ПМИД 1444298 .
- ^ Гилпин М., Милнер П. (1997). «Сопротивление изменениям. За последние 40 лет гликопептидные антибиотики сыграли решающую роль в лечении бактериальных инфекций. Но как долго это может продолжаться?» . Королевское химическое общество . Архивировано из оригинала 21 декабря 2002 г. Проверено 15 октября 2006 г. - включает изображение структуры тейкопланина.
- ^ «Actinoplanes teichomyceticus Parenti et al» . ATCC (Коллекция американских типовых культур) .
- ^ Ющук О, Осташ Б, Трумэн А.В., Маринелли Ф., Федоренко В. (апрель 2020 г.). «Биосинтез тейкопланина: раскрытие взаимодействия структурных, регуляторных генов и генов устойчивости». Прикладная микробиология и биотехнология . 104 (8): 3279–3291. дои : 10.1007/s00253-020-10436-y . ПМИД 32076781 . S2CID 211170874 .
- ^ Jump up to: а б с д и Камполи-Ричардс Д.М., Брогден Р.Н., Фолдс Д. (сентябрь 1990 г.). «Тейкопланин. Обзор его антибактериальной активности, фармакокинетических свойств и терапевтического потенциала». Наркотики . 40 (3): 449–486. дои : 10.2165/00003495-199040030-00007 . ПМИД 2146108 . S2CID 195699141 .
- ^ Бернареджи А., Борги А., Боргонови М., Кавенаги Л., Феррари П., Векей К. и др. (август 1992 г.). «Метаболизм тейкопланина у человека» . Антимикробные средства и химиотерапия . 36 (8): 1744–1749. дои : 10.1128/AAC.36.8.1744 . ПМК 192040 . ПМИД 1416858 .
- ^ Гейбель С., Ольферт М., Кнаппе С., Серафимов К., Ламмерхофер М. (февраль 2023 г.). «Профилирование разветвленных жирных кислот со средней длиной цепи и разделение энантиомеров антеизо-форм жирноацильной боковой цепи RS3 тейкопланина с использованием УВЭЖХ-МС/МС с полисахаридными колонками». Журнал фармацевтического и биомедицинского анализа . 224 : 115162. doi : 10.1016/j.jpba.2022.115162 . ПМИД 36423498 . S2CID 253529204 .
- ^ Юнг Х.М., Джея М., Ким С.Ю., Мун Х.Дж., Кумар Сингх Р., Чжан Ю.В. и др. (сентябрь 2009 г.). «Биосинтез, биотехнологическое производство и применение тейкопланина: современное состояние и перспективы». Прикладная микробиология и биотехнология . 84 (3): 417–428. дои : 10.1007/s00253-009-2107-4 . ПМИД 19609520 . S2CID 45038487 .
- ^ Хейдорн А., Петерсен Б.О., Дуус Дж.О., Бергманн С., Зур-Йессен Т., Нильсен Дж. (март 2000 г.). «Биосинтетические исследования гликопептида тейкопланина методами ЯМР (1) Н и (13) С» . Журнал биологической химии . 275 (9): 6201–6206. дои : 10.1074/jbc.275.9.6201 . ПМИД 10692413 .
- ^ Ли Т.Л., Хуанг Ф., Хейдок С.Ф., Мироненко Т., Лидли П.Ф., Спенсер Дж.Б. (январь 2004 г.). «Биосинтетический кластер генов гликопептидного антибиотика тейкопланина: характеристика двух гликозилтрансфераз и ключевой ацилтрансферазы» . Химия и биология . 11 (1): 107–119. doi : 10.1016/j.chembiol.2004.01.001 . ПМИД 15113000 .
- ^ Каниусайте М., Тайхадес Дж., Киттиля Т., Фаге К.Д., Гуд Р.Дж., Шиттенхельм Р.Б. и др. (январь 2021 г.). «Понимание ранних стадий образования пептидов во время биосинтеза тейкопланина и родственных гликопептидных антибиотиков» . Журнал ФЭБС . 288 (2): 507–529. дои : 10.1111/февраль 15350 . ПМИД 32359003 . S2CID 218481859 .
- ^ Jump up to: а б с Кане Д., Леймкулер С., Лу В., Уолш С. (февраль 2005 г.). «Гликопептидные и липогликопептидные антибиотики». Химические обзоры . 105 (2): 425–448. дои : 10.1021/cr030103a . ПМИД 15700951 .
- ^ Киттиля Т., Киттель С., Тайхадес Дж., Бутц Д., Шоппет М., Бюттнер А. и др. (сентябрь 2017 г.). «Галогенирование гликопептидных антибиотиков происходит на уровне аминокислот во время нерибосомального пептидного синтеза» . Химическая наука . 8 (9): 5992–6004. дои : 10.1039/C7SC00460E . ПМК 5620994 . ПМИД 28989629 .
- ^ Хаслингер К., Пешке М., Брике С., Максимович Э., Крайл М.Дж. (май 2015 г.). «X-домен пептидсинтетаз рекрутирует оксигеназы, имеющие решающее значение для биосинтеза гликопептидов». Природа . 521 (7550): 105–109. Бибкод : 2015Natur.521..105H . дои : 10.1038/nature14141 . ПМИД 25686610 . S2CID 4466657 .
- ^ Пешке М., Брике С., Крайл М.Дж. (октябрь 2016 г.). «Формирование FOG-кольца при биосинтезе гликопептидных антибиотиков катализируется OxyE» . Научные отчеты . 6 (1): 35584. Бибкод : 2016НатСР...635584П . дои : 10.1038/srep35584 . ПМК 5067714 . ПМИД 27752135 .
- ^ Каплан Дж., Корти Б.Д., Аксельсен П.Х., Лолл П.Дж. (май 2001 г.). «Роль остатков сахара в молекулярном распознавании ванкомицином». Журнал медицинской химии . 44 (11): 1837–1840. дои : 10.1021/jm0005306 . ПМИД 11356118 .
- ^ Ющук О, Осташ Б, Фам Т.Х., Лужецкий А, Федоренко В, Трумэн А.В. и др. (август 2016 г.). «Характеристика процессов адаптации после сборочной линии при биосинтезе тейкопланина». АКС Химическая биология . 11 (8): 2254–2264. doi : 10.1021/acschembio.6b00018 . ПМИД 27285718 .