хондробласт
| хондробласт | |
|---|---|
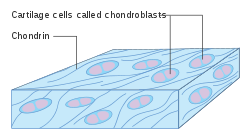 Схема хондробластов | |
| Подробности | |
| Идентификаторы | |
| латинский | хондробласт |
| ТД | Х2.00.03.5.00002 |
| ФМА | 66783 |
| Анатомические термины микроанатомии | |
Хондробласты , или перихондриальные клетки, — это название, данное мезенхимальным клеткам-предшественникам in situ, которые в результате эндохондрального окостенения образуют хондроциты в растущем хрящевом матриксе . Другое их название — субхондральные кортико-губчатые предшественники. [1] Они имеют эухроматические ядра и окрашиваются основными красителями.
Эти клетки чрезвычайно важны в хондрогенезе из-за их роли в формировании как хондроцитов, так и хрящевого матрикса, который в конечном итоге образует хрящ. Использование этого термина технически неточно, поскольку мезенхимальные предшественники также технически могут дифференцироваться в остеобласты или жир . Хондробласты называются хондроцитами, когда они внедряются в хрящевой матрикс, состоящий из протеогликановых и коллагеновых волокон матрикса , до тех пор, пока не окажутся в лакунах . Как только они внедряются в хрящевой матрикс, они выращивают хрящевой матрикс за счет увеличения количества хрящевого внеклеточного матрикса, а не за счет дальнейшего деления. [ нужна ссылка ]
Структура
[ редактировать ]У взрослых и развивающихся взрослых большинство хондробластов расположены в надхрящнице. Это тонкий слой соединительной ткани, который защищает хрящ, и именно там хондробласты помогают увеличивать размер хряща, когда к этому побуждают такие гормоны , как ГР , ТГ и гликозаминогликаны . [2] Они расположены на надхрящнице, потому что надхрящница, расположенная снаружи развивающейся кости, не так сильно покрыта хрящевым внеклеточным матриксом, как внутренняя часть, и потому что здесь капилляры расположены . Тип роста, поддерживаемый хондробластами, называется аппозиционным ростом кости и увеличивает рождение пораженной ткани. Важно отметить, что надхрящница и, следовательно, хондробласты не обнаруживаются на суставных хрящевых поверхностях суставов . [ нужна ссылка ]
Формирование и состав матрицы
[ редактировать ]Внеклеточный матрикс, секретируемый хондробластами, состоит из волокон , коллагена , гиалуроновой кислоты , протеогликанов , гликопротеинов , воды и множества макромолекул . В готовом хряще коллагеновые волокна составляют 10-20% объема, вода 65-80%, а протеогликан-гиалуроновая кислота агрегирует оставшуюся часть. Из-за пролиферативной природы хондробластов клетки составляют большую часть состава, чем то, что обычно содержится в готовом хряще. [3]
Волокна коллагена типа II отвечают за придание будущей хрящевой матрице прочности на растяжение . Структура этих волокон, как и большинства коллагеновых волокон, образует тройную спираль. [3]
Протеогликаны противостоят сжатию, обычно оказываемому на хрящ, и создают давление набухания , отвечающее за защиту матрицы от сжимающей нагрузки. Они прикрепляются к 100 молекулам хондроитинсульфата кератансульфата гликоаминогликанов и до 50 цепям . Эти цепи вместе прикреплены к основной цепи гиалуроновой кислоты, которая вместе с коллагеновыми фибриллами создает интерстициальное внутрифибриллярное пространство, в котором вода удерживается отрицательным зарядом протеогликанов. [4]
Разработка
[ редактировать ]Как следует из названия, мезенхимальные предшественники происходят из мезодермы . Эти клетки , формируясь из мезодермы, специфически формируются из эмбриональных стволовых клеток посредством индукции с помощью BMP4 и фактора роста фибробластов FGF2, пока плод находится внутри матки. Было высказано предположение, что дифференцировка эмбриональных стволовых клеток с помощью этих факторов роста может предотвратить , вызванных стволовыми клетками после инъекции потенциальным пациентам образование тератом или опухолей . [5]
Сигнализация, транскрипция и факторы окружающей среды, ответственные за создание хондробластов
[ редактировать ]Транскрипционные факторы
[ редактировать ]Важным генетическим компонентом этого процесса является Sox9, транскрипционный фактор HMG-бокса , который маркирует клетки-предшественники для хондрогенной дифференцировки. Инактивация гена Sox9 приведет к потере всего хряща и, следовательно, образования хондробластов. Этот фактор также выражается вместе с Sox5 и Sox6. [1]
Runx2 — еще один важный генетический компонент формирования хондробластов. Было обнаружено, что экспрессия этого гена приводит к подавлению дифференцировки хондробластов. Экспрессия этого гена также побуждает уже сформированный хрящ подвергаться эндохондральному оссификации , что побуждает хрящ образовывать кость. [ нужна ссылка ]
Здесь важно отметить, что эти гены — не единственные факторы, определяющие, будут ли образовываться хондробласты. Общая инактивация или активация этих генов не переводит все пораженные клетки в тот или иной тип. Внешние факторы окружающей среды действуют выше, определяя, какой тип клеток сформируется из той или иной конкретной мезенхимальной клетки-предшественника. [ нужна ссылка ]
Передача сигналов Wnt/β-катенин
[ редактировать ]Wnt14 контролируется Col2a1 и проходит через β-катенин-опосредованный путь Wnt . Более высокие уровни Wnt14 предотвращали дифференцировку хондроцитов, тогда как более низкие уровни, по-видимому, позволяли это. Если путь Wnt/β-катенин активируется, то стимулируется эндохондральная оссификация, которая способствует оссификации сформированного хряща. Этот путь является каноническим путем Wnt из-за β-катенина, который накапливается после инициации передачи сигналов Wnt14. После инициации Wnt14 фосфорилирование β-катенина, который обычно маркирует белок для разрушения, подавляется, что позволяет ему накапливаться и в конечном итоге проникать в ядро клетки для связывания с транскрипционными факторами LEF/TCF, что приводит как к разрушению любого оставшийся фосфорилированный β-катенин, а также дифференцировка мезенхимальных клеток-предшественников в остеобласты . [6]
Тестирование этого пути показало, что Wnt/β-катенин увеличивает уровни β-катенина до активации транскрипционных факторов Runx2 и Osx, что, по-видимому, позволяет предположить, что ранние уровни β-катенина могут быть признаком того, будет ли ранняя мезенхимальная клетка-предшественник прогрессируют в хондроциты или остеобласты. [7]
Ретиноевая кислота
[ редактировать ]Ретиноевую кислоту, входящую в семейство молекул, называемых ретиноидами , необходимо подавлять, чтобы образовались хондробласты. Исследование 2003 года с использованием трансгенных мышей со слабым, конститутивно активным рецептором ретиноевой кислоты показало, что ретиноиды поддерживают клетки внутри конденсаций в прехондрогенном, мезенхимальном состоянии клеток, которое предотвращает дифференцировку клеток. [8] Также было высказано предположение, что ингибирование рецептор-опосредованной передачи сигналов ретиноидов индуцирует экспрессию Sox9 , которая считается «главным переключателем» для дифференцировки хондробластов. [8]
Факторы окружающей среды
[ редактировать ]Дифференцировке хондробластов благоприятствует среда с высокой сжимающей силой и низким парциальным кислорода давлением , которые в совокупности ингибируют белок 3, белок, который ингибирует дифференцировку хряща. Эти предпочтения важны, поскольку зрелая хрящевая ткань лишена сосудов и, следовательно, плохо приспособлена к среде с высоким содержанием кислорода. [1]
Функция
[ редактировать ]Хондробласты мигрируют в хрящ всякий раз, когда хондроциты разрушаются посредством механической силы. Оставшиеся хондроциты делятся, образуя новые хондробласты. HMGB-1, фактор роста, который способствует делению хондроцитов, в то время как рецепторы продуктов гликирования (RAGE) опосредуют хемотаксис для очистки клеточного мусора, возникшего в результате повреждения. Затем хондробласты выделяют вокруг себя хрящевой матрикс, чтобы восстановить утраченную хрящевую ткань. [ нужна ссылка ]
Однако регенерация все еще происходит слишком медленно, чтобы уход за пациентами мог эффективно полагаться на этот механизм восстановления. Частично эта неспособность быстро восстанавливаться после травм обусловлена относительной аваскулярной природой хряща по сравнению с другими соединительными тканями человеческого тела . [ нужна ссылка ]
Патология
[ редактировать ]Иногда могут образовываться хондробластомы — доброкачественные опухоли , образующиеся в местах эндохондрального окостенения из-за чрезмерной стимуляции хондробластов. Когда они формируются, они обычно обнаруживаются в верхней или нижней части большеберцовой кости , а также в верхней части плечевой кости , где активность хондробластов наиболее очевидна. Редко их можно обнаружить на стопах, руках, плоских костях или позвоночнике. 30–50% этих сарком сопровождаются остеобластомой , которая также доброкачественна. [9]
Хондросаркома — более злокачественный тип опухоли, но большинство из них представляют собой опухоли низкой степени злокачественности и часто появляются в осевой области скелета . На его долю приходится 20% опухолей скелетной системы в США . [10]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с Крюгер, Ян Филипп; Хондке, Сильвия; Эндрес, Микаэла; Прусс, Аксель; Сиклари, Альберто; Капс, Кристиан (2012). «Человеческая плазма, богатая тромбоцитами, стимулирует миграцию и хондрогенную дифференцировку субхондральных клеток-предшественников человека» . Журнал ортопедических исследований . 30 (6): 845–52. дои : 10.1002/jor.22005 . ПМИД 22058056 . S2CID 25710553 .
- ^ Холл, БК (1983). Хрящ . Нью-Йорк: Академическая пресса. ISBN 978-0-12-319501-2 . Проверено 22 октября 2014 г.
- ^ Jump up to: а б Перл, Эндрю Д.; Уоррен, Рассел Ф.; Родео, Скотт А. (2005). «Фундаментальные науки о суставном хряще и остеоартрите». Клиники спортивной медицины . 24 (1): 1–12. дои : 10.1016/j.csm.2004.08.007 . ПМИД 15636773 .
- ^ Кинг, MW (10 февраля 2014 г.). «Гликозаминогликаны» . Проверено 22 октября 2014 г. [ ненадежный медицинский источник? ]
- ^ Ли, Ти Джей; Джанг, Дж; Канг, С; Джин, М; Шин, Х; Ким, Д.В.; Ким, бакалавр наук (2013). «Усиление остеогенной и хондрогенной дифференцировки эмбриональных стволовых клеток человека путем индукции мезодермального клона с помощью обработки BMP-4 и FGF2». Связь с биохимическими и биофизическими исследованиями . 430 (2): 793–7. дои : 10.1016/j.bbrc.2012.11.067 . ПМИД 23206696 .
- ^ Питтенджер М.Ф., Маккей А.М., Бек С.К., Джайсвал Р.К., Дуглас Р., Моска Дж.Д., Мурман М.А., Симонетти Д.В., Крейг С., Маршак Д.Р. (апрель 1999 г.). «Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека». Наука . 284 (5411): 143–7. Бибкод : 1999Sci...284..143P . дои : 10.1126/science.284.5411.143 . ПМИД 10102814 .
- ^ Дэй, Тимоти Ф.; Го, Сижи; Гаррет-Бил, Лиза; Ян, Инцзы (2005). «Передача сигналов Wnt/β-катенина в мезенхимальных предшественниках контролирует дифференцировку остеобластов и хондроцитов во время скелетогенеза позвоночных» . Развивающая клетка . 8 (5): 739–50. дои : 10.1016/j.devcel.2005.03.016 . ПМИД 15866164 .
- ^ Jump up to: а б Хоффман, LM; Уэстон, AD; Андерхилл, ТМ (2003). «Молекулярные механизмы, регулирующие дифференцировку хондробластов» . Журнал костной и суставной хирургии. Американский том . 85-А Приложение 2: 124–32. дои : 10.2106/00004623-200300002-00017 . ПМИД 12721355 . S2CID 44703653 . [ постоянная мертвая ссылка ]
- ^ Ауфдерхайде, AC; Родригес-Мартин, К.; Лангсйен, О. (2011). «Хондросаркома». Кембриджская энциклопедия палеопатологии человека . Кембридж, Соединенное Королевство: Издательство Кембриджского университета.
- ^ «Эпидемиология рака костей: обзор» .