Тандемная масс-спектрометрия

Тандемная масс-спектрометрия , также известная как МС/МС или МС. 2 , - это метод инструментального анализа два или более этапов анализа с использованием одного или нескольких масс-анализаторов , при котором выполняются с дополнительным этапом реакции между этими анализами для повышения их способности анализировать химические образцы. [1] Обычно тандемный МС используется для анализа биомолекул , таких как белки и пептиды .
Молекулы , данного образца ионизируются и первый спектрометр (обозначаемый MS1 ) разделяет эти ионы по отношению их массы к заряду (часто выражаемому как m/z или m/Q). Ионы с определенным соотношением m/z, поступающие из MS1, отбираются, а затем расщепляются на более мелкие фрагментированные ионы , например, путем диссоциации, вызванной столкновением , ионно-молекулярной реакции или фотодиссоциации . Эти фрагменты затем вводятся во второй масс-спектрометр ( MS2 ), который, в свою очередь, разделяет фрагменты по их соотношению m/z и обнаруживает их. Этап фрагментации позволяет идентифицировать и разделять ионы, которые имеют очень схожие отношения m/z в обычных масс-спектрометрах.
Структура
[ редактировать ]Типичные аппаратуры тандемной масс-спектрометрии включают тройной квадрупольный масс-спектрометр (QqQ), многосекторный масс-спектрометр , квадрупольно-времяпролетный (Q-TOF), масс-спектрометры с ионно-циклотронным резонансом с преобразованием Фурье и гибридные масс-спектрометры. [ нужна ссылка ]
Тройной квадрупольный масс-спектрометр
[ редактировать ]В тройных квадрупольных масс-спектрометрах первый и третий квадруполи используются в качестве масс-фильтров. Когда аналиты проходят второй квадруполь, фрагментация происходит за счет столкновения с газом. [ нужна ссылка ]
Квадруполь – время пролета (Q-TOF)
[ редактировать ]Масс-спектрометр Q-TOF сочетает в себе квадрупольный и TOF-инструменты, которые вместе позволяют проводить эксперименты по фрагментации, которые дают высокоточные количественные массовые определения дочерних ионов. Это метод масс-спектрометрии, в котором соотношение фрагментированных ионов ( m / z ) определяется посредством измерения времени полета. [ нужна ссылка ]
Гибридный масс-спектрометр
[ редактировать ]Гибридный масс-спектрометр состоит из более чем двух масс-анализаторов.
Инструментарий
[ редактировать ]
Несколько стадий разделения масс-анализа можно выполнить с помощью отдельных элементов масс-спектрометра, разделенных в пространстве, или с использованием одного масс-спектрометра с этапами МС, разделенными во времени. Для тандемной масс-спектрометрии в космосе различные элементы часто обозначаются сокращенно, указывая тип используемого масс-селектора . [ нужна ссылка ]
Тандем в космосе
[ редактировать ]
В тандемной масс-спектрометрии в космосе разделительные элементы физически разделены и различимы, хотя между элементами существует физическая связь для поддержания высокого вакуума . Этими элементами могут быть сектора , квадруполь передачи или времяпролёт. При использовании нескольких квадруполей они могут действовать как масс-анализаторы , так и камеры столкновений. [ нужна ссылка ]
Общепринятое обозначение масс-анализаторов: Q – квадрупольный масс-анализатор; q – радиочастотного квадруполь столкновения; TOF – времяпролетный масс-анализатор; Б – магнитный сектор и Е – электрический сектор. Обозначения можно комбинировать для обозначения различных гибридных приборов, например QqQ' – тройной квадрупольный масс-спектрометр ; QTOF – квадрупольный времяпролетный масс-спектрометр (также QqTOF ); и БЭБЕ – четырехсекторный (обратной геометрии) масс-спектрометр.
Тандем во времени
[ редактировать ]
При выполнении тандемной масс-спектрометрии во времени разделение осуществляется с захватом ионов в одном и том же месте, при этом с течением времени происходит несколько этапов разделения. ионно - циклотронного резонанса с преобразованием Фурье (FTICR). Для такого анализа можно использовать квадрупольную ионную ловушку или прибор [2] Инструменты улавливания могут выполнять несколько этапов анализа, который иногда называют MS. н (М.С. к н. ). [3] Часто количество шагов n не указывается, но иногда указывается значение; например МС 3 указывает на три стадии разделения.Тандемные во времени инструменты МС не используют описанные ниже режимы, но обычно собирают всю информацию от сканирования ионов-предшественников и сканирования родительских ионов всего спектра. Каждая инструментальная конфигурация использует уникальный режим массовой идентификации. [ нужна ссылка ]
Тандем в космических режимах МС/МС
[ редактировать ]Когда тандемная МС выполняется в космосе, прибор должен работать в одном из множества режимов. Существует ряд различных тандемных экспериментальных установок МС/МС, и каждый режим имеет свои собственные применения и предоставляет различную информацию. Тандемная МС в космосе использует соединение двух компонентов прибора, которые измеряют один и тот же диапазон масс-спектра, но с контролируемым фракционированием между ними в пространстве, тогда как тандемная МС во времени предполагает использование ионной ловушки . [ нужна ссылка ]
С использованием МС/МС возможны четыре основных эксперимента по сканированию: сканирование ионов-предшественников, сканирование дочерних ионов, сканирование нейтральных потерь и мониторинг выбранных реакций.
Для сканирования ионов-предшественников ион-продукт выбирается во втором масс-анализаторе, а массы-предшественники сканируются в первом масс-анализаторе. Обратите внимание, что ион-предшественник [4] является синонимом родительского иона [5] и ион-продукт [6] с дочерним ионом; [7] однако использование этих антропоморфных терминов не рекомендуется. [8] [9]
При сканировании дочерних ионов ион-предшественник выбирается на первом этапе, ему дают возможность фрагментироваться, а затем все полученные массы сканируются во втором масс-анализаторе и обнаруживаются в детекторе, который расположен после второго масс-анализатора. Этот эксперимент обычно проводится для идентификации переходов, используемых для количественной оценки с помощью тандемной МС.
При сканировании нейтральных потерь первый масс-анализатор сканирует все массы. Второй масс-анализатор также сканирует, но с заданным смещением от первого масс-анализатора. [10] Это смещение соответствует нейтральным потерям, которые обычно наблюдаются для этого класса соединений. При сканировании с постоянными потерями нейтрали отслеживаются все предшественники, которые теряют определенную общую нейтраль. Для получения этой информации оба масс-анализатора сканируются одновременно, но со смещением массы, коррелирующим с массой указанной нейтрали. Подобно сканированию ионов-предшественников, этот метод также полезен для выборочной идентификации близкородственных классов соединений в смеси.
При мониторинге выбранной реакции оба масс-анализатора настраиваются на выбранную массу. Этот режим аналогичен мониторингу выбранных ионов для экспериментов МС. Режим выборочного анализа, позволяющий повысить чувствительность. [11]
Фрагментация
[ редактировать ]Фрагментация ионов газовой фазы важна для тандемной масс-спектрометрии и происходит между различными этапами масс-анализа. Существует множество методов фрагментации ионов, которые могут привести к разным типам фрагментации и, следовательно, к различной информации о структуре и составе молекулы. [ нужна ссылка ]
Фрагментация исходного кода
[ редактировать ]Часто процесс ионизации бывает достаточно сильным, чтобы образовавшиеся ионы обладали достаточной внутренней энергией для фрагментации внутри масс-спектрометра. Если образующиеся ионы сохраняются в неравновесном состоянии в течение умеренного времени перед самодиссоциацией, этот процесс называется метастабильной фрагментацией. [12] Фрагментация сопла-скиммера относится к целенаправленной индукции фрагментации в источнике путем увеличения потенциала сопла-скиммера на электрораспылении инструментах, обычно основанных на . Хотя фрагментация в источнике позволяет провести фрагментационный анализ, технически это не тандемная масс-спектрометрия, если только метастабильные ионы не подвергаются массовому анализу или не отбираются перед самодиссоциацией и на полученных фрагментах не выполняется второй этап анализа. Фрагментацию в источнике можно использовать вместо тандемной масс-спектрометрии за счет использования технологии Enhanced In-Source Fragmentation Annotation (EISA), которая генерирует фрагментацию, которая напрямую соответствует данным тандемной масс-спектрометрии. [13] Фрагменты, наблюдаемые с помощью EISA, имеют более высокую интенсивность сигнала, чем традиционные фрагменты, которые терпят потери в ячейках столкновений тандемных масс-спектрометров. [14] EISA позволяет собирать данные о фрагментации на масс-анализаторах MS1, таких как времяпролетные и одноквадрупольные приборы. Фрагментация внутри источника часто используется в дополнение к тандемной масс-спектрометрии (с фрагментацией после источника), чтобы обеспечить два этапа фрагментации в псевдоМС. 3 -вид эксперимента. [15]
Диссоциация, вызванная столкновением
[ редактировать ]Фрагментация после источника чаще всего используется в тандемном масс-спектрометрическом эксперименте. Энергия также может быть добавлена к ионам, которые обычно уже колебательно возбуждены, посредством столкновений после источника с нейтральными атомами или молекулами, поглощения излучения или переноса или захвата электрона многозарядным ионом. Диссоциация, вызванная столкновением (CID), также называемая диссоциацией, активируемой столкновением (CAD), включает столкновение иона с нейтральным атомом или молекулой в газовой фазе и последующую диссоциацию иона. [16] [17] Например, рассмотрим
где ион AB + сталкивается с нейтральной частицей М и впоследствии распадается. Детали этого процесса описывает теория столкновений . Из-за различной аппаратурной конфигурации возможны два основных типа CID: (i) лучевого типа (при котором ионы-предшественники фрагментируются в полете) [18] и (ii) ионная ловушка (в которой ионы-предшественники сначала захватываются, а затем фрагментируются). [19] [20]
Третий и более поздний тип фрагментации CID — это столкновительная диссоциация при более высоких энергиях (HCD). HCD - это метод CID, специфичный для масс-спектрометров с орбитальной ловушкой , в котором фрагментация происходит вне ионной ловушки. [21] [22] это происходит в ячейке HCD (в некоторых приборах это называется «мультиполь маршрутизации ионов»). [23] HCD представляет собой фрагментацию типа ловушки, которая, как было показано, имеет характеристики лучевого типа. [24] [25] Существуют свободно доступные крупномасштабные базы данных тандемной масс-спектрометрии высокого разрешения (например, METLIN с 850 000 молекулярными стандартами каждый с экспериментальными данными CID MS/MS), [26] и обычно используются для облегчения идентификации малых молекул.
Методы захвата и переноса электронов
[ редактировать ]Энергия, выделяющаяся при передаче электрона многозарядному иону или его захвате, может вызвать фрагментацию. [ нужна ссылка ]
Электронозахватывающая диссоциация
[ редактировать ]Если электрон к многозарядному положительному иону присоединяется кулоновская энергия , высвобождается . Добавление свободного электрона называется диссоциацией электронного захвата (ДЗЭ). [27] и представлен
для многократно протонированной молекулы М.
Диссоциация с переносом электрона
[ редактировать ]Добавление электрона посредством ион-ионной реакции называется диссоциацией с переносом электрона (ETD). [28] [29] Подобно диссоциации с электронозахватом, ETD вызывает фрагментацию катионов (например, пептидов или белков ) путем передачи электронов им . Он был изобретен Дональдом Ф. Хантом , Джошуа Куном , Джоном Э.П. Сика и Джарродом Марто в Университете Вирджинии . [30]
ETD не использует свободные электроны, но использует для этой цели анионы-радикалы (например, антрацен или азобензол ):
где А – анион. [31]
ETD расщепляется случайным образом вдоль основной цепи пептида (ионы c и z), в то время как боковые цепи и модификации, такие как фосфорилирование, остаются нетронутыми. Этот метод хорошо работает только для ионов с более высоким зарядом (z>2), однако по сравнению с диссоциацией, индуцированной столкновением (CID), ETD выгоден для фрагментации более длинных пептидов или даже целых белков. Это делает этот метод важным для протеомики сверху вниз . Как и ECD, ETD эффективен для пептидов с такими модификациями , как фосфорилирование. [32]
Диссоциация с переносом электрона и столкновением с более высокими энергиями (EThcD) представляет собой комбинацию ETD и HCD, при которой предшественник пептида первоначально подвергается ионно-ионной реакции с анионами флуорантена в линейной ионной ловушке , которая генерирует c- и z-ионы. [28] [33] На втором этапе ко всем ионам, полученным из ETD, применяется полноионная фрагментация HCD для генерации b- и y-ионов перед окончательным анализом в анализаторе с орбитальной ловушкой. [21] В этом методе используется двойная фрагментация для создания ионных и, следовательно, богатых данными спектров МС/МС для секвенирования пептидов и локализации PTM . [34]
Диссоциация с отрицательным переносом электрона
[ редактировать ]Фрагментация также может происходить с депротонированными частицами, в которых электрон переносится от частиц к катионному реагенту в результате диссоциации с отрицательным переносом электрона (NETD): [35]
После этого события переноса электронодефицитный анион претерпевает внутреннюю перегруппировку и фрагментируется . NETD — это ионно-ионный аналог диссоциации электронного отрыва (EDD).
NETD совместим с фрагментацией пептидов и белков вдоль основной цепи по связи Cα - C. Полученные фрагменты обычно представляют собой • - и ионы-продукты x-типа.
Электронно-отрывная диссоциация
[ редактировать ]Диссоциация с отрывом электронов (EDD) - это метод фрагментации анионных частиц в масс-спектрометрии. [36] Он служит режимом отрицательного противодействия диссоциации электронного захвата. Отрицательно заряженные ионы активируются облучением электронами умеренной кинетической энергии. В результате происходит выброс электронов из родительской ионной молекулы, что вызывает диссоциацию посредством рекомбинации. [ нужна ссылка ]
Диссоциация с переносом заряда
[ редактировать ]Реакция между положительно заряженными пептидами и катионными реагентами. [37] также известный как диссоциация с переносом заряда (CTD), [38] недавно был продемонстрирован как альтернативный путь высокоэнергетической фрагментации пептидов с низким зарядом (1+ или 2+). Предлагаемый механизм CTD с использованием катионов гелия в качестве реагента:
Первоначальные сообщения заключаются в том, что CTD вызывает расщепление связи Cα-C основной цепи пептидов и обеспечивает • - и ионы-продукты x-типа.
Фотодиссоциация
[ редактировать ]Энергия, необходимая для диссоциации, может быть добавлена за счет поглощения фотонов ионов , что приводит к фотодиссоциации и представлено выражением
где представляет собой фотон, поглощенный ионом. Ультрафиолетовые лазеры можно использовать, но они могут привести к чрезмерной фрагментации биомолекул. [39]
Инфракрасная многофотонная диссоциация
[ редактировать ]Инфракрасные фотоны нагревают ионы и вызывают диссоциацию, если их поглощается достаточное количество. Этот процесс называется инфракрасной многофотонной диссоциацией (IRMPD) и часто выполняется с помощью углекислого лазера и масс-спектрометра с улавливанием ионов, такого как FTMS . [40]
Инфракрасно-излучательная диссоциация черного тела
[ редактировать ]Излучение черного тела можно использовать для фотодиссоциации с помощью метода, известного как инфракрасная радиационная диссоциация черного тела (BIRD). [41] В методе BIRD вся вакуумная камера масс-спектрометра нагревается для создания инфракрасного света. BIRD использует это излучение для возбуждения все более энергичных колебаний ионов, пока связь не разрывается, образуя фрагменты. [41] [42] Это похоже на инфракрасную многофотонную диссоциацию , при которой также используется инфракрасный свет, но из другого источника. [17] BIRD чаще всего используется с масс-спектрометрией с ионно-циклотронным резонансом с преобразованием Фурье . [ нужна ссылка ]
Поверхностно-индуцированная диссоциация
[ редактировать ]При поверхностно-индуцированной диссоциации (SID) фрагментация является результатом столкновения иона с поверхностью в условиях высокого вакуума. [43] [44] Сегодня SID используется для фрагментации широкого спектра ионов. Несколько лет назад было принято использовать SID только для однозарядных частиц с меньшей массой, потому что методы ионизации и технологии масс-анализаторов не были достаточно продвинутыми, чтобы правильно формировать, передавать или характеризовать ионы с высокими m/z. Со временем самоорганизующиеся монослойные поверхности (SAM), состоящие из CF 3 (CF 2 ) 10 CH 2 CH 2 S на золоте, стали наиболее широко используемыми поверхностями столкновений для SID в тандемном спектрометре. ЗУР выступали в качестве наиболее желательных целей для столкновений из-за их характерно большой эффективной массы для столкновения летящих ионов. Кроме того, эти поверхности состоят из жестких цепочек фторуглерода , которые существенно не ослабляют энергию ионов-снарядов. Цепи фторуглеродов также полезны из-за их способности противостоять легкому переносу электронов с поверхности металла к поступающим ионам. [45] Способность SID создавать субкомплексы, которые остаются стабильными и предоставляют ценную информацию о связях, не имеет себе равных ни у одного другого метода диссоциации. Поскольку комплексы, полученные из SID, стабильны и сохраняют распределение заряда на фрагменте, это дает уникальные спектры, которые комплекс центрирует вокруг более узкого распределения m/z. Продукты SID и энергия, при которой они образуются, отражают сильные стороны и топологию комплекса. Уникальные закономерности диссоциации помогают обнаружить четвертичную структуру комплекса. Симметричное распределение заряда и зависимость от диссоциации уникальны для SID и отличают получаемые спектры от любого другого метода диссоциации. [45]
Метод SID также применим к масс-спектрометрии ионной подвижности (IM-MS). Три различных метода этой техники включают анализ характеристик топологии, межсубъединичных связей и степени развертывания структуры белка. Анализ разворачивания структуры белка является наиболее часто используемым применением метода SID. Для масс-спектрометрии ионной подвижности (IM-MS) SID используется для диссоциации исходных активированных предшественников трех различных типов белковых комплексов: C-реактивного белка (CRP), транстиретина (TTR) и конканавалина A (Con A). . Этот метод используется для наблюдения за степенью развертывания каждого из этих комплексов. Для этого наблюдения SID показал структуры ионов-предшественников, которые существуют до столкновения с поверхностью. IM-MS использует SID как прямую меру конформации каждой субъединицы белка. [46]
Ионный циклотронный резонанс с преобразованием Фурье (FTICR) способен обеспечить сверхвысокое разрешение и высокую точность определения массы для приборов, выполняющих измерения массы. Эти особенности делают масс-спектрометры FTICR полезным инструментом для самых разных приложений, таких как несколько экспериментов по диссоциации. [47] такие как диссоциация, вызванная столкновением (CID, диссоциация с переносом электрона (ETD), [48] и другие. Кроме того, с помощью этого прибора была реализована поверхностно-индуцированная диссоциация для изучения фундаментальной фрагментации пептидов. В частности, SID применялся для изучения энергетики и кинетики фрагментации газовой фазы в приборе ICR. [49] Этот подход использовался для понимания газофазной фрагментации протонированных пептидов, пептидных ионов с нечетными электронами, нековалентных комплексов лиганд-пептид и лигированных металлических кластеров. [ нужна ссылка ]
Количественная протеомика
[ редактировать ]Количественная протеомика используется для определения относительного или абсолютного количества белков в образце. [50] [51] [52] Несколько методов количественной протеомики основаны на тандемной масс-спектрометрии. МС/МС стал эталонной процедурой для определения структуры сложных биомолекул. [53]
Одним из методов, обычно используемых для количественной протеомики, является мечение изобарными метками. Маркировка изобарными метками позволяет одновременно идентифицировать и количественно определять белки из нескольких образцов в одном анализе. Для количественной оценки белков пептиды метят химическими метками, имеющими одинаковую структуру и номинальную массу, но различающиеся распределением тяжелых изотопов в своей структуре. Эти метки, обычно называемые тандемными масс-метками, сконструированы таким образом, что массовая метка расщепляется в определенной области линкера при высокоэнергетической диссоциации, индуцированной столкновением (HCD) во время тандемной масс-спектрометрии, с получением репортерных ионов различной массы. Количественное определение белка осуществляется путем сравнения интенсивностей репортерных ионов в спектрах МС/МС. Двумя коммерчески доступными изобарическими метками являются реагенты iTRAQ и TMT. [ нужна ссылка ]
Изобарические метки для относительного и абсолютного количественного анализа (iTRAQ)
[ редактировать ]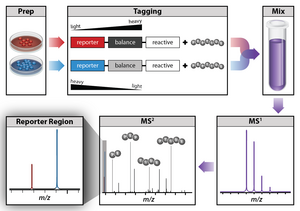
Изобарная метка для относительного и абсолютного количественного определения (iTRAQ) — это реагент для тандемной масс-спектрометрии, который используется для определения количества белков из разных источников в одном эксперименте. [54] [55] [56] стабильными В нем используются молекулы, меченные изотопами , которые могут образовывать ковалентную связь с N-концевыми и боковыми аминами белков. Реагенты iTRAQ используются для мечения пептидов из различных образцов, которые объединяются и анализируются методами жидкостной хроматографии и тандемной масс-спектрометрии. Фрагментация прикрепленной метки генерирует репортерный ион с низкой молекулярной массой, который можно использовать для сравнительного количественного определения пептидов и белков, из которых они произошли. [ нужна ссылка ]
Тандемная массовая метка (ТМТ)
[ редактировать ]Тандемная масс-метка (TMT) представляет собой химическую метку изобарной массы, используемую для количественного определения и идентификации белка. [57] Метки содержат четыре области: масс-репортер, расщепляемый линкер, нормализацию массы и белково-реактивную группу. Реагенты ТМТ можно использовать для одновременного анализа от 2 до 11 различных образцов пептидов, полученных из клеток, тканей или биологических жидкостей. Последние разработки позволяют анализировать до 16 и даже 18 образцов (16 или 18 плекс соответственно). [58] [59] Доступны три типа реагентов ТМТ с различной химической активностью: (1) реактивная сложноэфирная группа NHS для мечения первичных аминов (TMTduplex, TMTsixplex, TMT10plex плюс TMT11-131C), (2) реактивная йодацетильная функциональная группа для мечения свободных сульфгидрилов ( iodoTMT) и (3) реакционноспособная алкоксиаминовая функциональная группа для мечения карбонилов (аминоксиTMT).
Мультиплексированный DIA (plexDIA)
[ редактировать ]Прогресс в области независимого сбора данных (DIA) позволил проводить мультиплексную количественную протеомику с неизобарными массовыми метками и новым методом под названием plexDIA, представленным в 2021 году. [60] Этот новый подход увеличивает количество точек данных за счет распараллеливания как образцов, так и пептидов, тем самым достигая мультипликативного выигрыша. У него есть потенциал для дальнейшего масштабирования протеомной производительности с помощью новых массовых меток и алгоритмов. [61] [62] plexDIA применим как к массовым [63] и одноклеточные образцы и особенно эффективны для одноклеточной протеомики. [64] [65]
Приложения
[ редактировать ]Пептиды
[ редактировать ]
Тандемная масс-спектрометрия может использоваться для секвенирования белков . [66] Когда интактные белки вводятся в масс-анализатор, это называется « протеомикой сверху вниз », а когда белки расщепляются на более мелкие пептиды и затем вводятся в масс-спектрометр, это называется « протеомикой снизу вверх ». Протеомика дробовика - это вариант протеомики снизу вверх, при котором белки в смеси расщепляются перед разделением и тандемной масс-спектрометрией. [ нужна ссылка ]
Тандемная масс-спектрометрия позволяет получить метку пептидной последовательности , которую можно использовать для идентификации пептида в базе данных белков. [67] [68] [69] Разработаны обозначения для обозначения пептидных фрагментов, возникающих из тандемного масс-спектра. [70] Ионы пептидного фрагмента обозначаются буквами a, b или c, если заряд сохраняется на N-конце , и буквами x, y или z, если заряд сохраняется на C-конце . Нижний индекс указывает количество аминокислотных остатков во фрагменте. Верхние индексы иногда используются для обозначения нейтральных потерь в дополнение к фрагментации основной цепи: * для потери аммиака и ° для потери воды. Хотя расщепление основной цепи пептида является наиболее полезным для секвенирования и идентификации пептидов, другие ионы фрагментов можно наблюдать в условиях высокоэнергетической диссоциации. К ним относятся ионы потери боковой цепи d, v, w и ионы аммония. [71] [72] и дополнительные ионы специфичных для последовательности фрагментов, связанные с конкретными аминокислотными остатками. [73]
Олигосахариды
[ редактировать ]Олигосахариды можно секвенировать с использованием тандемной масс-спектрометрии аналогично секвенированию пептидов. [74] Фрагментация обычно происходит по обе стороны от гликозидной связи (ионы b, c, y и z), но также и в более энергетических условиях через структуру сахарного кольца при поперечном расщеплении кольца (ионы x). И снова конечные индексы используются для обозначения положения расщепления вдоль цепи. Для ионов поперечного расщепления кольца природа поперечного расщепления цикла указывается предшествующими верхними индексами. [75] [76]
Олигонуклеотиды
[ редактировать ]Тандемная масс-спектрометрия применяется для секвенирования ДНК и РНК . [77] [78] обозначения газофазной фрагментации олигонуклеотид- ионов. Предложены [79]
Скрининг новорожденных
[ редактировать ]Скрининг новорожденных — это процесс тестирования новорожденных на наличие излечимых генетических , эндокринологических , метаболических и гематологических заболеваний. [80] [81] Развитие тандемного масс-спектрометрического скрининга в начале 1990-х годов привело к значительному увеличению потенциально выявляемых врожденных метаболических заболеваний , влияющих на уровень органических кислот в крови. [82]
Анализ малых молекул
Было показано, что данные тандемной масс-спектрометрии очень согласованы между приборами и платформами производителей, включая квадрупольные времяпролетные приборы (QTOF) и Q Exactive, особенно при 20 эВ. [83]
Ограничение
[ редактировать ]Тандемная масс-спектрометрия не может применяться для анализа отдельных клеток, поскольку она нечувствительна для анализа таких небольших количеств клеток. Эти ограничения в первую очередь связаны с сочетанием неэффективного производства ионов и потерь ионов внутри приборов из-за источников химического шума растворителей. [84]
Перспективы на будущее
[ редактировать ]Тандемная масс-спектрометрия станет полезным инструментом для характеристики белков, нуклеопротеиновых комплексов и других биологических структур. Однако остались некоторые проблемы, такие как количественный и качественный анализ характеристик протеома. [85]
См. также
[ редактировать ]- Ускорительная масс-спектрометрия
- Сечение (физика)
- Масс-анализ ионно-кинетической спектрометрии
- Разложение мономолекулярных ионов
Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « тандемный масс-спектрометр ». дои : 10.1351/goldbook.T06250
- ^ Коди Р.Б., Фрейзер Б.С. (1982). «Диссоциация, вызванная столкновениями, в масс-спектрометре с преобразованием Фурье». Международный журнал масс-спектрометрии и ионной физики . 41 (3): 199–204. Бибкод : 1982IJMSI..41..199C . дои : 10.1016/0020-7381(82)85035-3 .
- ^ Коди Р.Б., Бернье Р.К., Кэссиди С.Дж., Фрейзер Б.С. (1 ноября 1982 г.). «Последовательная диссоциация, вызванная столкновениями, в масс-спектрометрии с преобразованием Фурье». Аналитическая химия . 54 (13): 2225–2228. дои : 10.1021/ac00250a021 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Ион-предшественник ». doi : 10.1351/goldbook.P04807
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Родительский ион ». doi : 10.1351/goldbook.P04406
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Ион продукта ». doi : 10.1351/goldbook.P04864
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Дочь Иона ». дои : 10.1351/goldbook.D01524
- ^ Берси, Морис М. (1991). «Комментарий читателям: Стиль и его отсутствие». Обзоры масс-спектрометрии . 10 (1): 1–2. Бибкод : 1991MSRv...10....1B . дои : 10.1002/mas.1280100102 .
- ^ Адамс, Дж. (1992). «В редакцию» . Журнал Американского общества масс-спектрометрии . 3 (4): 473. Бибкод : 1992JASMS...3..473A . дои : 10.1016/1044-0305(92)87078-D . ПМИД 24243061 .
- ^ Лоурис Дж.Н., Райт Л.Г., Кукс Р.Г., Шон А.Е. (1985). «Новые режимы сканирования, доступные с помощью гибридного масс-спектрометра». Аналитическая химия . 57 (14): 2918–2924. дои : 10.1021/ac00291a039 .
- ^ деХоффман Э., Строобант В. (2003). Масс-спектрометрия: принципы и приложения . Торонто: Уайли. п. 133. ИСБН 978-0-471-48566-7 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Переходные (химические) виды ». дои : 10.1351/goldbook.T06451
- ^ Доминго-Альменара, Ксавьер; Монтенегро-Берк, Дж. Рафаэль; Гихас, Карлос; Маджумдер, Эрика Л.-В.; Бентон, Х. Пол; Сюздак, Гэри (5 марта 2019 г.). «Автономная аннотация исходного фрагмента для нецелевой метаболомики под управлением METLIN» . Аналитическая химия . 91 (5): 3246–3253. дои : 10.1021/acs.analchem.8b03126 . ПМК 6637741 . ПМИД 30681830 .
- ^ Сюэ, Цзинчуань; Доминго-Альменара, Ксавьер; Гихас, Карлос; Палермо, Амелия; Риншен, Маркус М.; Исбелл, Джон; Бентон, Х. Пол; Сюздак, Гэри (21 апреля 2020 г.). «Усовершенствованная аннотация фрагментации источника обеспечивает независимый сбор новых данных и автономную молекулярную идентификацию METLIN» . Аналитическая химия . 92 (8): 6051–6059. дои : 10.1021/acs.analchem.0c00409 . ПМЦ 8966047 . ПМИД 32242660 . S2CID 214768212 .
- ^ Кернер Р., Вильм М., Моран К., Шуберт М., Манн М. (февраль 1996 г.). «Наноэлектроспрей в сочетании с квадрупольной ионной ловушкой для анализа пептидов и белковых гидролизатов». Журнал Американского общества масс-спектрометрии . 7 (2): 150–6. Бибкод : 1996JASMS...7..150K . дои : 10.1016/1044-0305(95)00626-5 . ПМИД 24203235 . S2CID 1030006 .
- ^ Уэллс Дж. М., Маклаки С.А. (2005). «Вызванная столкновениями диссоциация (CID) пептидов и белков». Биологическая масс-спектрометрия . Методы энзимологии. Том. 402. стр. 148–85. дои : 10.1016/S0076-6879(05)02005-7 . ISBN 9780121828073 . ПМИД 16401509 .
- ^ Перейти обратно: а б Слено Л., Волмер Д.А. (октябрь 2004 г.). «Методы ионной активации для тандемной масс-спектрометрии». Журнал масс-спектрометрии . 39 (10): 1091–112. Бибкод : 2004JMSp...39.1091S . дои : 10.1002/jms.703 . ПМИД 15481084 .
- ^ Ся Ю, Лян Икс, Маклаки С.А. (февраль 2006 г.). «Ионная ловушка и диссоциация протонированных ионов убиквитина, вызванная столкновением низкоэнергетического пучка». Аналитическая химия . 78 (4): 1218–27. дои : 10.1021/ac051622b . ПМИД 16478115 .
- ^ Мартовский РЭ (1 апреля 1997 г.). «Введение в масс-спектрометрию с квадрупольной ионной ловушкой» . Журнал масс-спектрометрии . 32 (4): 351–369. Бибкод : 1997JMSp...32..351M . doi : 10.1002/(sici)1096-9888(199704)32:4<351::aid-jms512>3.0.co;2-y . S2CID 16506573 .
- ^ Банщефф М., Боше М., Эберхард Д., Маттисон Т., Свитман Г., Кастер Б. (сентябрь 2008 г.). «Надежный и чувствительный количественный анализ iTRAQ на масс-спектрометре LTQ Orbitrap» . Молекулярная и клеточная протеомика . 7 (9): 1702–13. дои : 10.1074/mcp.M800029-MCP200 . ПМК 2556025 . ПМИД 18511480 .
- ^ Перейти обратно: а б Олсен Дж.В., Мачек Б., Ланге О., Макаров А., Хорнинг С., Манн М. (сентябрь 2007 г.). «Высокоэнергетическая диссоциация C-ловушки для анализа модификации пептидов». Природные методы . 4 (9): 709–12. дои : 10.1038/nmeth1060 . ПМИД 17721543 . S2CID 2538231 .
- ^ Сенко М.В., Ремес П.М., Кентербери Дж.Д., Матур Р., Сонг К., Элиук С.М., Маллен С., Эрли Л., Хардман М., Блетроу Дж.Д., Буй Х., Шпехт А., Ланге О., Денисов Е., Макаров А., Хорнинг С., Забрусков В. (декабрь 2013 г.). «Новый параллельный квадрупольный/линейная ионная ловушка/трибридный масс-спектрометр Orbitrap, улучшающий покрытие протеома и скорость идентификации пептидов». Аналитическая химия . 85 (24): 11710–4. дои : 10.1021/ac403115c . ПМИД 24251866 .
- ^ Райли Н.М., Вестфалл М.С., Кун Дж.Дж. (июль 2017 г.). «Активированная диссоциация с переносом ионов и электронов обеспечивает комплексную фрагментацию белков сверху вниз» . Журнал исследований протеома . 16 (7): 2653–2659. doi : 10.1021/acs.jproteome.7b00249 . ПМЦ 5555583 . ПМИД 28608681 .
- ^ Нагарадж Н., Д'Суза Р.К., Кокс Дж., Олсен Дж.В., Манн М. (декабрь 2010 г.). «Возможность крупномасштабной фосфопротеомики с более высокой энергией столкновительной диссоциационной фрагментации». Журнал исследований протеома . 9 (12): 6786–94. дои : 10.1021/pr100637q . ПМИД 20873877 .
- ^ Джора М., Бернс А.П., Росс Р.Л., Лобуэ П.А., Чжао Р., Палумбо С.М., Бил П.А., Аддепалли Б., Лимбах П.А. (август 2018 г.). «Дифференциация позиционных изомеров модификаций нуклеозидов с помощью масс-спектрометрии столкновительной диссоциации при высоких энергиях (HCD MS)» . Журнал Американского общества масс-спектрометрии . 29 (8): 1745–1756. Бибкод : 2018JASMS..29.1745J . дои : 10.1007/s13361-018-1999-6 . ПМК 6062210 . ПМИД 29949056 .
- ^ «Метрики статей — база данных молекулярных стандартов METLIN MS 2: обширный химический и биологический ресурс | Nature Methods» . ISSN 1548-7105 .
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Купер Х.Дж., Хоканссон К., Маршалл А.Г. (2005). «Роль диссоциации электронного захвата в биомолекулярном анализе». Обзоры масс-спектрометрии . 24 (2): 201–22. Бибкод : 2005MSRv...24..201C . дои : 10.1002/мас.20014 . ПМИД 15389856 .
- ^ Перейти обратно: а б Сика Дж.Э., Кун Дж.Дж., Шредер М.Дж., Шабановиц Дж., Хант Д.Ф. (июнь 2004 г.). «Анализ последовательностей пептидов и белков методом масс-спектрометрии диссоциации с переносом электронов» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (26): 9528–33. Бибкод : 2004PNAS..101.9528S . дои : 10.1073/pnas.0402700101 . ПМК 470779 . ПМИД 15210983 .
- ^ Микеш Л.М., Юберхайде Б., Чи А., Кун Дж.Дж., Сика Дж.Э., Шабановиц Дж., Хант Д.Ф. (декабрь 2006 г.). «Полезность масс-спектрометрии ETD в протеомном анализе» . Biochimica et Biophysical Acta (BBA) - Белки и протеомика . 1764 (12): 1811–22. дои : 10.1016/j.bbapap.2006.10.003 . ПМЦ 1853258 . ПМИД 17118725 .
- ^ Патент США 7534622 , Дональд Ф. Хант, Джошуа Дж. Кун, Джон Э. П. Сика, Джаррод А. Марто, «Диссоциация с переносом электрона для масс-спектрометрического анализа последовательностей биополимеров», выдан 19 мая 2009 г.
- ^ Маклаки С.А., Стивенсон Дж.Л. (1998). «Ион/ионная химия многозарядных ионов большой массы» . Обзоры масс-спектрометрии . 17 (6): 369–407. Бибкод : 1998MSRv...17..369M . doi : 10.1002/(SICI)1098-2787(1998)17:6<369::AID-MAS1>3.0.CO;2-J . ПМИД 10360331 .
- ^ Чи А., Хаттенхауэр С., Гир Л.И., Кун Дж.Дж., Сика Дж.Е., Бай Д.Л., Шабановиц Дж., Берк Д.Д., Троянская О.Г., Хант Д.Ф. (февраль 2007 г.). «Анализ сайтов фосфорилирования белков Saccharomyces cerevisiae методом масс-спектрометрии диссоциации с переносом электрона (ETD)» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (7): 2193–8. Бибкод : 2007PNAS..104.2193C . дои : 10.1073/pnas.0607084104 . ПМК 1892997 . ПМИД 17287358 .
- ^ Фрезе К.К., Алтелаар А.Ф., ван ден Тоорн Х., Нолтинг Д., Грип-Рамин Дж., Хек А.Дж., Мохаммед С. (ноябрь 2012 г.). «На пути к полному охвату пептидной последовательности путем двойной фрагментации, сочетающей тандемную масс-спектрометрию с переносом электронов и диссоциацией при столкновении с более высокими энергиями». Аналитическая химия . 84 (22): 9668–73. дои : 10.1021/ac3025366 . ПМИД 23106539 .
- ^ Фрезе К.К., Чжоу Х., Таус Т., Алтелаар А.Ф., Мехтлер К., Хек А.Дж., Мохаммед С. (март 2013 г.). «Однозначная локализация фосфозита с использованием диссоциации с переносом электрона и столкновением при более высоких энергиях (EThcD)» . Журнал исследований протеома . 12 (3): 1520–5. дои : 10.1021/pr301130k . ПМЦ 3588588 . ПМИД 23347405 .
- ^ Кун Джей-Джей, Шабановиц Дж., Хант Д.Ф., Сика Дж.Э. (июнь 2005 г.). «Электронно-переносная диссоциация пептидных анионов». Журнал Американского общества масс-спектрометрии . 16 (6): 880–2. Бибкод : 2005JASMS..16..880C . дои : 10.1016/j.jasms.2005.01.015 . ПМИД 15907703 .
- ^ Будник Б.А., Хазельманн К.Ф., Зубарев Р.А. (2001). «Диссоциация пептидных дианионов с отрывом электрона: явление электрон-дырочной рекомбинации». Письма по химической физике . 342 (3–4): 299–302. Бибкод : 2001CPL...342..299B . дои : 10.1016/S0009-2614(01)00501-2 .
- ^ Чингин К., Макаров А., Денисов Е., Ребров О., Зубарев Р.А. (январь 2014 г.). «Фрагментация положительно заряженных биологических ионов, активированных пучком высокоэнергетических катионов». Аналитическая химия . 86 (1): 372–9. дои : 10.1021/ac403193k . ПМИД 24236851 .
- ^ Хоффманн В.Д., Джексон GP (ноябрь 2014 г.). «Масс-спектрометрия пептидных катионов с помощью диссоциации с переносом заряда (CTD) с использованием килоэлектронвольтных катионов гелия». Журнал Американского общества масс-спектрометрии . 25 (11): 1939–43. Бибкод : 2014JASMS..25.1939H . дои : 10.1007/s13361-014-0989-6 . ПМИД 25231159 . S2CID 1400057 .
- ^ Морган Дж.В., Хеттик Дж.М., Рассел Д.Х. (2005). «Секвенирование пептидов с помощью MALDI 193-нм фотодиссоциация TOF MS». Биологическая масс-спектрометрия . Методы энзимологии. Том. 402. стр. 186–209. дои : 10.1016/S0076-6879(05)02006-9 . ISBN 9780121828073 . ПМИД 16401510 .
- ^ Литтл Д. П., Спейр Дж. П., Сенко М. В., О'Коннор П. Б., Маклафферти Ф. В. (сентябрь 1994 г.). «Инфракрасная многофотонная диссоциация крупных многозарядных ионов для секвенирования биомолекул». Аналитическая химия . 66 (18): 2809–15. дои : 10.1021/ac00090a004 . ПМИД 7526742 .
- ^ Перейти обратно: а б Шниер П.Д., Прайс В.Д., Йокуш Р.А., Уильямс Э.Р. (июль 1996 г.). «Чернотельное инфракрасное излучение диссоциации брадикинина и его аналогов: энергетика, динамика и доказательства существования структур солевых мостиков в газовой фазе» . Журнал Американского химического общества . 118 (30): 7178–89. дои : 10.1021/ja9609157 . ПМЦ 1393282 . ПМИД 16525512 .
- ^ Данбар RC (2004). «BIRD (инфракрасная радиационная диссоциация черного тела): эволюция, принципы и применение» . Обзоры масс-спектрометрии . 23 (2): 127–58. Бибкод : 2004MSRv...23..127D . дои : 10.1002/mas.10074 . ПМИД 14732935 .
- ^ Гриль В., Шен Дж., Эванс С., Кукс Р.Г. (2001). «Столкновения ионов с поверхностями при химически значимых энергиях: приборы и явления». Обзор научных инструментов . 72 (8): 3149. Бибкод : 2001RScI...72.3149G . дои : 10.1063/1.1382641 .
- ^ Мабуд, М. (1985). «Поверхностно-индуцированная диссоциация молекулярных ионов». Международный журнал масс-спектрометрии и ионных процессов . 67 (3): 285–294. Бибкод : 1985IJMSI..67..285M . дои : 10.1016/0168-1176(85)83024-X .
- ^ Перейти обратно: а б Стивинг, Алисса; ВанАернум, Закари; Буш, Флориан; Харви, Софи; Сарни, Саманта; Высоцкий, Вики (9 ноября 2018 г.). «Поверхностно-индуцированная диссоциация: эффективный метод характеристики четвертичной структуры белка» . Аналитическая химия . 91 (1): 190–191. дои : 10.1021/acs.analchem.8b05071 . ПМК 6571034 . ПМИД 30412666 .
- ^ Квинтин, Ройстон С.; Чжоу, Мовэй; Ян, Цзин; Высоцкий, Вики Х. (1 декабря 2015 г.). «Масс-спектры поверхностно-индуцированной диссоциации как инструмент различения различных структурных форм газофазных мультимерных белковых комплексов». Аналитическая химия . 87 (23): 11879–11886. дои : 10.1021/acs.analchem.5b03441 . ISSN 0003-2700 . ПМИД 26499904 .
- ^ Ласкин, Юлия ; Фатрелл, Джин Х. (2005). «Активация крупных ионов в масс-спектрометрии FT-ICR» . Обзоры масс-спектрометрии . 24 (2): 135–167. Бибкод : 2005MSRv...24..135L . дои : 10.1002/мас.20012 . ISSN 0277-7037 . ПМИД 15389858 .
- ^ Каплан, Десмонд А.; Хартмер, Ральф; Спейр, Дж. Пол; Стермер, Карстен; Гумеров Дмитрий; Истерлинг, Майкл Л.; Брекенфельд, Андреас; Ким, Тэман; Лаукин, Фрэнк; Парк, Мелвин А. (2008). «Диссоциация с переносом электрона в гексапольной ячейке столкновений гибридного квадруполь-гексапольного масс-спектрометра с преобразованием Фурье ионно-циклотронного резонанса». Быстрая связь в масс-спектрометрии . 22 (3): 271–278. Бибкод : 2008RCMS...22..271K . дои : 10.1002/rcm.3356 . ISSN 0951-4198 . ПМИД 18181247 .
- ^ Ласкин, Юлия (июнь 2015 г.). «Поверхностно-индуцированная диссоциация: уникальный инструмент для изучения энергетики и кинетики газофазной фрагментации крупных ионов». Европейский журнал масс-спектрометрии . 21 (3): 377–389. дои : 10.1255/ejms.1358 . ISSN 1469-0667 . ПМИД 26307719 . S2CID 19837927 .
- ^ Онг С.Е., Манн М. (октябрь 2005 г.). «Протеомика, основанная на масс-спектрометрии, становится количественной». Химическая биология природы . 1 (5): 252–62. дои : 10.1038/nchembio736 . ПМИД 16408053 . S2CID 32054251 .
- ^ Банщефф М., Ширле М., Свитман Г., Рик Дж., Кастер Б. (октябрь 2007 г.). «Количественная масс-спектрометрия в протеомике: критический обзор» . Аналитическая и биоаналитическая химия . 389 (4): 1017–31. дои : 10.1007/s00216-007-1486-6 . ПМИД 17668192 .
- ^ Николов М., Шмидт С., Урлауб Х. (2012). «Количественная протеомика на основе масс-спектрометрии: обзор». Количественные методы в протеомике . Методы молекулярной биологии. Том. 893. стр. 85–100. дои : 10.1007/978-1-61779-885-6_7 . hdl : 11858/00-001M-0000-0029-1A75-8 . ISBN 978-1-61779-884-9 . ПМИД 22665296 . S2CID 33009117 .
- ^ Махер С., Джунджу Ф.П., Тейлор С. (2015). «100 лет масс-спектрометрии: перспективы и будущие тенденции». Преподобный Мод. Физ . 87 (1): 113–135. Бибкод : 2015РвМП...87..113М . дои : 10.1103/RevModPhys.87.113 .
- ^ Росс П.Л., Хуанг Ю.Н., Марчезе Дж.Н., Уильямсон Б., Паркер К., Хаттан С., Хаиновски Н., Пиллаи С., Дей С., Дэниелс С., Пуркайаста С., Юхас П., Мартин С., Бартлет-Джонс М., Хе Ф, Джейкобсон А, Паппин DJ (декабрь 2004 г.). «Мультиплексное количественное определение белка в Saccharomyces cerevisiae с использованием аминореактивных изобарных меченых реагентов» . Молекулярная и клеточная протеомика . 3 (12): 1154–69. дои : 10.1074/mcp.M400129-MCP200 . PMID 15385600 . S2CID 1979097 .
- ^ Зиеске Л.Р. (2006). «Перспектива использования технологии реагентов iTRAQ для исследования белковых комплексов и профилирования» . Журнал экспериментальной ботаники . 57 (7): 1501–8. дои : 10.1093/jxb/erj168 . ПМИД 16574745 .
- ^ Гафкен П.Р., Лампе П.Д. (2006). «Методика характеристики фосфопротеинов методом масс-спектрометрии» . Клеточная связь и адгезия . 13 (5–6): 249–62. дои : 10.1080/15419060601077917 . ПМК 2185548 . ПМИД 17162667 .
- ^ Томпсон А., Шефер Дж., Кун К., Кинле С., Шварц Дж., Шмидт Г., Нойманн Т., Джонстон Р., Мохаммед А.К., Хамон С. (апрель 2003 г.). «Тандемные массовые метки: новая стратегия количественного определения для сравнительного анализа сложных белковых смесей методом МС/МС». Аналитическая химия . 75 (8): 1895–904. дои : 10.1021/ac0262560 . ПМИД 12713048 .
- ^ Ли, Цзямин; Ван Вранкен, Джонатан Г.; Понтано Ваитес, Лаура; Швеппе, Девин К.; Хаттлин, Эдвард Л.; Этьен, Крис; Нандиконда, Премчендар; Винер, Роза; Робитайл, Аарон М.; Томпсон, Эндрю Х.; Кун, Карстен; Пайк, Ян; Бомгарден, Райан Д.; Роджерс, Джон К.; Гиги, Стивен П. (апрель 2020 г.). «Реагенты TMTpro: набор массовых меток для изобарной маркировки позволяет проводить одновременные измерения всего протеома в 16 образцах» . Природные методы . 17 (4): 399–404. дои : 10.1038/s41592-020-0781-4 . ISSN 1548-7105 . ПМК 7302421 . ПМИД 32203386 .
- ^ Ли, Цзямин; Цай, Чжэньин; Бомгарден, Райан Д.; Пайк, Ян; Кун, Карстен; Роджерс, Джон К.; Робертс, Томас М.; Гиги, Стивен П.; Пауло, Жоао А. (7 мая 2021 г.). «TMTpro-18plex: расширенный и полный набор реагентов TMTpro для мультиплексирования образцов» . Журнал исследований протеома . 20 (5): 2964–2972. doi : 10.1021/acs.jproteome.1c00168 . ISSN 1535-3893 . ПМК 8210943 . ПМИД 33900084 .
- ^ Деркс, Джейсон; Ледюк, Эндрю; Вальманн, Георг; Хаффман, Р. Грей; Уиллетс, Мэтью; Хан, Саад; Шпехт, Харрисон; Ральсер, Маркус; Демичев Вадим; Славов, Николай (2023). «Увеличение производительности чувствительной протеомики с помощью plexDIA» . Природная биотехнология . 41 (1): 50–59. bioRxiv 10.1101/2021.11.03.467007 . дои : 10.1038/s41587-022-01389-w . ПМЦ 9839897 . ПМИД 35835881 .
- ^ Деркс, Джейсон; Славов, Николай (3 марта 2023 г.). «Стратегии увеличения глубины и производительности анализа белков с помощью plexDIA» . Журнал исследований протеома . 22 (3): 697–705. doi : 10.1021/acs.jproteome.2c00721 . ISSN 1535-3893 . ПМЦ 9992289 . ПМИД 36735898 .
- ^ Славов, Николай (январь 2022 г.). «Расширение масштабов протеомики отдельных клеток» . Молекулярная и клеточная протеомика . 21 (1): 100179. doi : 10.1016/j.mcpro.2021.100179 . ISSN 1535-9476 . ПМЦ 8683604 . ПМИД 34808355 .
- ^ Вальманн, Георг; Ледюк, Эндрю; Славов, Николай (6 октября 2023 г.). «Оптимизация масс-спектрометрии DIA на основе данных с помощью DO-MS» . Журнал исследований протеома . 22 (10): 3149–3158. doi : 10.1021/acs.jproteome.3c00177 . ISSN 1535-3893 . ПМК 10591957 . ПМИД 37695820 .
- ^ Славов, Николай (5 ноября 2021 г.). «Продвижение одноклеточной протеомики вперед с помощью инноваций» . Журнал исследований протеома . 20 (11): 4915–4918. doi : 10.1021/acs.jproteome.1c00639 . ISSN 1535-3893 . ПМК 8571067 . ПМИД 34597050 .
- ^ Гатто, Лоран; Эберсольд, Руди; Кокс, Юрген; Демичев Вадим; Деркс, Джейсон; Эммотт, Эдвард; Фрэнкс, Александр М.; Иванов Александр Р.; Келли, Райан Т.; Хури, Люк; Ледюк, Эндрю; Маккосс, Майкл Дж.; Немес, Питер; Перлман, Дэвид Х.; Петельский, Александра А. (март 2023 г.). «Первоначальные рекомендации по проведению, сравнительному анализу и составлению отчетов об экспериментах по протеомике отдельных клеток» . Природные методы . 20 (3): 375–386. дои : 10.1038/s41592-023-01785-3 . ISSN 1548-7105 . ПМЦ 10130941 . ПМИД 36864200 .
- ^ Ангел Т.Э., Арьял Великобритания, Хенгель С.М., Бейкер Э.С., Келли Р.Т., Робинсон Э.В., Смит Р.Д. (май 2012 г.). «Протеомика на основе масс-спектрометрии: существующие возможности и будущие направления» . Обзоры химического общества . 41 (10): 3912–28. дои : 10.1039/c2cs15331a . ПМК 3375054 . ПМИД 22498958 .
- ^ Хардуэн Дж (2007). «Информация о последовательности белка с помощью матричной лазерной десорбции / ионизации масс-спектрометрии распада в источнике». Обзоры масс-спектрометрии . 26 (5): 672–82. Бибкод : 2007MSRv...26..672H . дои : 10.1002/mas.20142 . ПМИД 17492750 .
- ^ Шадфорт И., Кроутер Д., Бессант К. (ноябрь 2005 г.). «Алгоритмы идентификации белков и пептидов с использованием МС для использования в высокопроизводительных автоматизированных конвейерах». Протеомика . 5 (16): 4082–95. дои : 10.1002/pmic.200402091 . ПМИД 16196103 . S2CID 38068737 .
- ^ Мёрц Э., О'Коннор П.Б., Ропсторфф П., Келлехер Н.Л., Вуд Т.Д., Маклафферти Ф.В., Манн М. (август 1996 г.). «Идентификация меток последовательностей интактных белков путем сопоставления данных масс-спектра Тандена с базами данных последовательностей» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (16): 8264–7. Бибкод : 1996PNAS...93.8264M . дои : 10.1073/pnas.93.16.8264 . ПМК 38658 . ПМИД 8710858 .
- ^ Ропсторфф П., Фолман Дж. (ноябрь 1984 г.). «Предложение по общей номенклатуре ионов последовательности в масс-спектрах пептидов». Биомедицинская масс-спектрометрия . 11 (11): 601. doi : 10.1002/bms.1200111109 . ПМИД 6525415 .
- ^ Джонсон Р.С., Мартин С.А., Клаус Биманн (декабрь 1988 г.). «Индуцированная столкновениями фрагментация ионов (M + H)+ пептидов. Ионы последовательности, специфичные для боковой цепи». Международный журнал масс-спектрометрии и ионных процессов . 86 : 137–154. Бибкод : 1988IJMSI..86..137J . дои : 10.1016/0168-1176(88)80060-0 .
- ^ Фалик А.М., Хайнс В.М., Медзиградский К.Ф., Болдуин М.А., Гибсон Б.В. (ноябрь 1993 г.). «Ионы малой массы, полученные из пептидов путем высокоэнергетической диссоциации, вызванной столкновением, в тандемной масс-спектрометрии». Журнал Американского общества масс-спектрометрии . 4 (11): 882–93. Бибкод : 1993JASMS...4..882F . дои : 10.1016/1044-0305(93)87006-X . ПМИД 24227532 . S2CID 38931760 .
- ^ Даунард К.М., Биманн К. (январь 1995 г.). «Ионы специфической последовательности метионина, образующиеся в результате диссоциации протонированных пептидов при высоких энергиях столкновения». Журнал масс-спектрометрии . 30 (1): 25–32. Бибкод : 1995JMSp...30...25D . дои : 10.1002/jms.1190300106 .
- ^ Зая Дж (2004). «Масс-спектрометрия олигосахаридов». Обзоры масс-спектрометрии . 23 (3): 161–227. Бибкод : 2004MSRv...23..161Z . дои : 10.1002/mas.10073 . ПМИД 14966796 .
- ^ Бруно Домон; Кэтрин Э. Костелло (1988). «Систематическая номенклатура фрагментации углеводов в спектрах FAB-MS/MS гликоконъюгатов». Гликокондж. Дж . 5 (4): 397–409. дои : 10.1007/BF01049915 . S2CID 206787925 .
- ^ Спина Э., Коццолино Р., Райан Э., Гароццо Д. (август 2000 г.). «Секвенирование олигосахаридов с помощью масс-спектрометрии лазерной десорбции / ионизации с матрицей диссоциации, индуцированной столкновениями». Журнал масс-спектрометрии . 35 (8): 1042–8. Бибкод : 2000JMSp...35.1042S . doi : 10.1002/1096-9888(200008)35:8<1042::AID-JMS33>3.0.CO;2-Y . ПМИД 10973004 .
- ^ Бануб Дж.Х., Ньютон Р.П., Эсманс Э., Юинг Д.Ф., Маккензи Дж. (май 2005 г.). «Последние разработки в области масс-спектрометрии для характеристики нуклеозидов, нуклеотидов, олигонуклеотидов и нуклеиновых кислот». Химические обзоры . 105 (5): 1869–915. дои : 10.1021/cr030040w . ПМИД 15884792 .
- ^ Томас Б., Акуличев А.В. (март 2006 г.). «Масс-спектрометрия РНК». Тенденции биохимических наук . 31 (3): 173–81. дои : 10.1016/j.tibs.2006.01.004 . ПМИД 16483781 .
- ^ Ву Дж, Маклаки С.А. (2004). «Газофазная фрагментация олигонуклеотидных ионов». Международный журнал масс-спектрометрии . 237 (2–3): 197–241. Бибкод : 2004IJMSp.237..197W . дои : 10.1016/j.ijms.2004.06.014 .
- ^ Тарини Б.А. (август 2007 г.). «Нынешняя революция в скрининге новорожденных: новые технологии, старые противоречия». Архив педиатрии и подростковой медицины . 161 (8): 767–72. дои : 10.1001/archpedi.161.8.767 . ПМИД 17679658 .
- ^ Кайтон А. (2007). «Скрининг новорожденных: обзор литературы». Неонатальная сеть . 26 (2): 85–95. дои : 10.1891/0730-0832.26.2.85 . ПМИД 17402600 . S2CID 28372085 .
- ^ Чейс Д.Х., Калас Т.А., Нейлор Э.В. (ноябрь 2003 г.). «Применение тандемной масс-спектрометрии для мультианалитного скрининга образцов сухой крови новорожденных» . Клиническая химия . 49 (11): 1797–817. дои : 10.1373/clinchem.2003.022178 . ПМИД 14578311 .
- ^ Хоанг, Кори; Уритбунтхай, Винни; Хоанг, Линь; Биллингс, Элизабет М.; Айспорна, Овен; Ниа, Фаршад А.; Деркс, Рико Дж. Э.; Уильямсон, Джеймс Р.; Гиера, Мартин; Сюздак, Гэри (26 марта 2024 г.). «Тандемная масс-спектрометрия на разных платформах» . Аналитическая химия . 96 (14): 5478–5488. дои : 10.1021/acs.analchem.3c05576 . ISSN 0003-2700 . ПМЦ 11007677 . ПМИД 38529642 .
- ^ Ангел, Томас Э.; Арьял, Ума К.; Хенгель, Шона М.; Бейкер, Эрин С.; Келли, Райан Т.; Робинсон, Эррол В.; Смит, Ричард Д. (21 мая 2012 г.). «Протеомика на основе масс-спектрометрии: существующие возможности и будущие направления» . Обзоры химического общества . 41 (10): 3912–3928. дои : 10.1039/c2cs15331a . ISSN 0306-0012 . ПМК 3375054 . ПМИД 22498958 .
- ^ Хан, Сюэмэй; Асланян, Аарон; Йейтс, Джон Р. (октябрь 2008 г.). «Масс-спектрометрия для протеомики» . Современное мнение в области химической биологии . 12 (5): 483–490. дои : 10.1016/j.cbpa.2008.07.024 . ISSN 1367-5931 . ПМЦ 2642903 . ПМИД 18718552 .
Библиография
[ редактировать ]- Маклаки С.А. , Буш К.Л., Глиш Г.Л. (1988). Масс-спектрометрия/масс-спектрометрия: методы и применения тандемной масс-спектрометрии . Нью-Йорк, штат Нью-Йорк: Издательство VCH. ISBN 978-0-89573-275-0 .
- Маклаки С.А. , Глиш Г.Л. (18 января 1989 г.). Масс-спектрометрия/Масс-спектрометрия: методы и приложения тандема . Чичестер: Джон Уайли и сыновья. ISBN 978-0-471-18699-1 .
- Маклафферти ФВ (1983). Тандемная масс-спектрометрия . Нью-Йорк: Уайли. ISBN 978-0-471-86597-1 .
- Шерман Н.Е., Кинтер М. (2000). Секвенирование и идентификация белков с использованием тандемной масс-спектрометрии . Нью-Йорк: Джон Уайли. ISBN 978-0-471-32249-8 .
Внешние ссылки
[ редактировать ]- Введение в масс-спектрометрию доктора Элисон Э. Эшкрофт. Архивировано 8 августа 2020 года в Wayback Machine.

![{\displaystyle [{\ce {M}}+n{\ce {H}}]^{n+}+{\ce {e^{-}->}}\left[[{\ce {M}} +(n-1){\ce {H}}]^{(n-1)+}\right]^{*}{\ce {->фрагменты}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80535d501352b7854827d81bd70a7811d203d639)
![{\displaystyle [{\ce {M}}+n{\ce {H}}]^{n+}+{\ce {A^{-}->}}\left[[{\ce {M}} +(n-1){\ce {H}}]^{(n-1)+}\right]^{*}+{\ce {A->фрагменты}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0f39c0e76fd3f9d3862b8b49cb144a43c1cd907)
![{\displaystyle [{\ce {M}}-n{\ce {H}}]^{n-}+{\ce {A+->}}\left[[{\ce {M}}-n{ \ce {H}}]^{(n+1)-}\right]^{*}+{\ce {A->фрагменты}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/383244602d9ce4607f68c0696b8c55fb10951a3f)
![{\displaystyle {\ce {{[{M}+H]^{1}+}+He+->}}\left[{\ce {[{M}+H]^{2}+}}\right ]^{*}+{\ce {He^{0}->фрагменты}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a8ccd097f31299c546cd6e591efb6ed4f8556e2e)

