Реакция Джонсона-Кори-Чайковского
| Реакция Джонсона-Кори-Чайковского | |
|---|---|
| Назван в честь | А. Уильям Джонсон Элиас Джеймс Кори Михаил Чайковский |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Портал органической химии | Реакция Кори-Чайковского |
Реакция Джонсона -Кори-Чайковского (иногда называемая реакцией Кори-Чайковского или CCR ) — химическая реакция , используемая в органической химии для синтеза эпоксидов , азиридинов и циклопропанов . Он был открыт в 1961 году А. Уильямом Джонсоном и значительно развит Э. Дж. Кори и Майклом Чайковским. Реакция включает присоединение илида серы к кетону , альдегиду , имину или енону с образованием соответствующего трехчленного кольца. Реакция является диастереоселективной, благоприятствуя транс -замещению в продукте независимо от исходной стереохимии . Синтез эпоксидов этим методом служит важной ретросинтетической альтернативой традиционным эпоксидирования реакциям олефинов .

Реакция чаще всего используется для эпоксидирования посредством переноса метилена , и с этой целью она использовалась в нескольких известных процессах полного синтеза (см. Синтез эпоксидов ниже). Ниже дополнительно подробно описаны история, механизм, объем и энантиоселективные варианты реакции. Опубликовано несколько обзоров. [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ]
История
[ редактировать ]Оригинальная публикация Джонсона касалась реакции 9-диметилсульфонийфторенилида с замещенными производными бензальдегида . Попытка реакции, подобной Виттигу , не удалась, и вместо нее был получен оксид бензалфлуорена, отметив, что «реакция между илидом серы и бензальдегидами не привела к образованию бензалфлуоренов, как это произошло с илидами фосфора и мышьяка». [ 7 ]

Последующая разработка (диметилоксосульфаниумил)метанида (CH 3 ) 2 SOCH 2 и (диметилсульфаниумил)метанида (CH 3 ) 2 SCH 2 (известных как реагенты Кори-Чайковского ) Кори и Чайковским в качестве эффективных реагентов для переноса метилена установила реакцию как часть органического канона. [ 8 ]

Механизм
[ редактировать ]Механизм реакции Джонсона-Кори-Чайковского заключается в присоединении илида нуклеофильном к карбонильной или иминной группе. Отрицательный заряд переносится на гетероатом , и, поскольку сульфония катион является хорошей уходящей группой, он вытесняется, образуя кольцо. В родственной реакции Виттига образование гораздо более прочной фосфор - кислород двойной связи предотвращает образование оксирана , и вместо этого олефинирование происходит через 4-членное циклическое промежуточное соединение. [ 4 ] [ 9 ]

является Наблюдаемая транс- диастереоселективность результатом обратимости первоначального добавления, что позволяет достичь равновесия с предпочтительным по антибетаином сравнению с синбетаином . Первоначальное добавление илида приводит к образованию бетаина с соседними зарядами; Расчеты по теории функционала плотности показали, что лимитирующей скоростью является поворот центральной связи в конформер, необходимый для обратной атаки на сульфоний. [ 1 ]

Степень обратимости на начальном этапе (и, следовательно, диастереоселективность) зависит от четырех факторов, причем большая обратимость соответствует более высокой селективности: [ 1 ]
- Стабильность субстрата с более высокой стабильностью приводит к большей обратимости за счет предпочтения исходного материала перед бетаином.
- Стабильность илида с более высокой стабильностью также приводит к большей обратимости.
- Стерические препятствия в бетаине с большими препятствиями приводят к большей обратимости, препятствуя образованию промежуточного соединения и замедляя ограничивающее скорость вращение центральной связи.
- Сольватация зарядов в бетаине противоионами, такими как литий, с большей сольватацией, обеспечивающей более легкое вращение в промежуточном бетаине, снижая степень обратимости.
Объем
[ редактировать ]Применение реакции Джонсона–Кори–Чайковского в органическом синтезе разнообразно. Реакция стала охватывать реакции многих типов илидов серы с электрофилами, выходящими далеко за рамки первоначальных публикаций. Он использовался в ряде громких тотальных синтезов, как подробно описано ниже, и обычно считается мощным преобразующим инструментом в органическом репертуаре.
Виды илидов
[ редактировать ]
Многие типы илидов могут быть получены с различными функциональными группами как на анионном углеродном центре, так и на сере. влиять на простоту приготовления реагентов (обычно из галогенида сульфония, например иодида триметилсульфония Схема замещения может различными способами ) и общую скорость реакции. Общий формат реагента показан справа. [ 1 ]
Использование сульфоксония позволяет более легко приготовить реагент с использованием более слабых оснований по сравнению с илидами сульфония. (Разница в том, что сульфоксоний содержит кислород с двойной связью, а сульфоний - нет.) Первые реагируют медленнее из-за своей повышенной стабильности. Кроме того, диалкилсульфоксидные побочные продукты сульфоксониевых реагентов значительно предпочтительнее значительно более токсичных, летучих и пахучих диалкилсульфидных побочных продуктов сульфониевых реагентов. [ 1 ]
Подавляющее большинство реагентов монозамещены по илидному углероду (либо R 1 , либо R 2 в виде водорода). Дизамещенные реагенты встречаются гораздо реже, но были описаны: [ 1 ]
- Если илидный углерод замещен электроноакцепторной группой (EWG), реагент называется стабилизированным илидом . Они, как и реагенты сульфоксония, реагируют гораздо медленнее, и их обычно легче приготовить. Их полезность ограничена, поскольку реакция может стать чрезмерно медленной: примеры с участием амидов широко распространены, гораздо меньше с участием сложных эфиров и практически нет примеров с участием других EWG. Для них соответствующая реакция Дарценса . обычно более подходит
- Если илидный углерод замещен арильной или аллильной группой, реагент называется полустабилизированным илидом . Они получили широкое развитие и уступают только классическим метиленовым реагентам (R 1 =R 2 =H). Характер замещения арильных реагентов может сильно влиять на селективность реакции в соответствии с вышеуказанными критериями.
- Если углерод илида замещен алкильной группой, реагент называется нестабилизированным илидом . Размер алкильных групп является основным фактором селективности этих реагентов.
R-группы серы, хотя обычно это метильные группы , использовались для синтеза реагентов, которые могут выполнять энантиоселективные варианты реакции (см. Варианты ниже). Размер групп также может влиять на диастереоселективность в алициклических субстратах. [ 1 ]
Синтез эпоксидов
[ редактировать ]Реакции илидов серы с кетонами и альдегидами с образованием эпоксидов на сегодняшний день являются наиболее распространенным применением реакции Джонсона-Кори-Чайковского. Сообщалось о примерах, включающих сложные субстраты и «экзотические» илиды, как показано ниже. [ 10 ] [ 11 ]

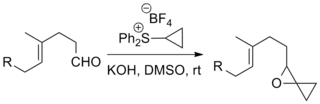
Реакция использовалась в ряде известных проектов полного синтеза, включая полный синтез таксола Данишефского , который производит химиотерапевтический препарат таксол , и полный синтез стрихнина Кюне , который производит пестицид стрихнин . [ 12 ] [ 13 ]


Синтез азиридинов
[ редактировать ]Синтез азиридинов из иминов является еще одним важным применением реакции Джонсона-Кори-Чайковского и обеспечивает альтернативу переносу амина из оксазиридинов . Хотя реакция применяется менее широко, она имеет аналогичный объем субстратов и толерантность к функциональным группам по отношению к карбонильному эквиваленту. Примеры, показанные ниже, являются репрезентативными; в последнем азиридин образуется in situ и открывается посредством нуклеофильной атаки с образованием соответствующего амина . [ 3 ] [ 10 ]
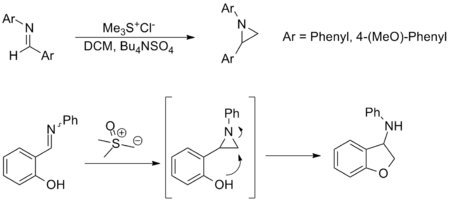
Синтез циклопропанов
[ редактировать ]При присоединении илидов серы к енонам более высокая 1,4-селективность обычно достигается с помощью сульфоксониевых реагентов, чем с сульфониевыми реагентами. Одно из объяснений, основанное на теории HSAB, утверждает, что это происходит потому, что сульфоксониевые реагенты имеют менее концентрированный отрицательный заряд на атоме углерода (более мягкий), поэтому он предпочитает 1,4-атаку на более мягком нуклеофильном сайте. Другое объяснение, подкрепленное исследованиями теории функционала плотности (DFT), предполагает, что необратимая атака 1,4, приводящая к образованию циклопропана, энергетически предпочтительнее обратимой атаки 1,2, которая приведет к образованию эпоксида. [ 14 ] В расширенных сопряженных системах 1,6-присоединение имеет тенденцию преобладать над 1,4-присоединением. [ 3 ] [ 10 ] Было показано, что многие электроноакцепторные группы способствуют циклопропанированию, включая кетоны , сложные эфиры , амиды (пример ниже включает амид Вайнреба ), сульфоны , нитрогруппы , фосфонаты , изоцианиды и даже некоторые электронодефицитные гетероциклы. [ 15 ]

Другие реакции
[ редактировать ]В дополнение к реакциям, о которых первоначально сообщили Джонсон, Кори и Чайковский, илиды серы использовались для ряда связанных реакций омологации , которые обычно группируются под одним и тем же названием.
- В случае эпоксидов и азиридинов реакция служит расширением кольца с образованием соответствующего оксетана или азетидина . Длительное время реакции, необходимое для этих реакций, не позволяет им протекать в качестве значительных побочных реакций при синтезе эпоксидов и азиридинов. [ 10 ]

- о нескольких циклоприсоединениях , в которых илид служит « нуклеофильным карбеноидным эквивалентом». Сообщалось [ 10 ]
![[4+1] циклоприсоединение с реагентом Кори – Чайковского](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cc/CCR41.png/320px-CCR41.png)
- живой полимеризации с использованием триалкилборанов в качестве катализатора и (диметилоксосульфаниумил)метанида в качестве мономера для синтеза различных сложных полимеров. Сообщалось о [ 16 ]

Энантиоселективные вариации
[ редактировать ]Разработка энантиоселективного ( т.е. дающего энантиомерный избыток , обозначаемый как «ее») варианта реакции Джонсона-Кори-Чайковского остается активной областью академических исследований. Использование хиральных сульфидов стехиометрическим способом оказалось более успешным, чем соответствующие каталитические варианты, но область применения субстратов во всех случаях по-прежнему ограничена. Каталитические варианты были разработаны почти исключительно для энантиоселективных целей; типичные сульфидорганические реагенты не являются чрезмерно дорогими, и рацемические реакции можно проводить с эквимолярными количествами илида без значительного увеличения затрат. С другой стороны, хиральные сульфиды более дороги в получении, что стимулирует развитие каталитических энантиоселективных методов. [ 2 ]
Стехиометрические реагенты
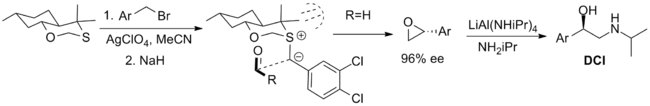
[ редактировать ]Ниже показаны наиболее успешные реагенты, используемые стехиометрическим способом. Первый представляет собой бициклический оксатиан, который использовался в синтезе β-адренергического соединения дихлоризопротеренола (DCI), но его возможности ограничены наличием только одного энантиомера реагента. Синтез аксиального диастереомера рационализируется 1,3- аномерным эффектом , который снижает нуклеофильность экваториальной неподеленной пары . Конформация . илида ограничена трансаннулярным напряжением , а приближение альдегида ограничено одной стороной илида стерическими взаимодействиями с метильными заместителями [ 5 ] [ 2 ]
Другим важным реагентом является реагент на основе камфоры , разработанный Вариндером Аггарвалом из Бристольского университета . Оба энантиомера легко синтезируются, хотя выходы ниже, чем у оксатианового реагента. Конформация илида определяется взаимодействием с мостиковыми водородами, а приближение альдегида блокируется камфорным фрагментом . В реакции используется фосфазеновое основание, способствующее образованию илида. [ 5 ] [ 2 ]
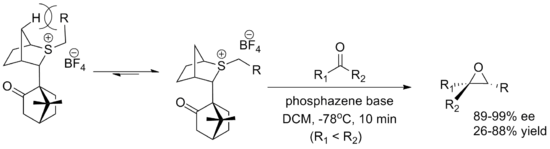
Каталитические реагенты
[ редактировать ]Каталитические реагенты оказались менее успешными, причем большинство вариантов страдали от низкого выхода, плохой энантиоселективности или того и другого. Существуют также проблемы с объемом субстратов, большинство из которых связаны с переносом метилена и алифатическими альдегидами . Проблема связана с необходимостью нуклеофильного сульфида, который эффективно генерирует илид, который также может действовать как хорошая уходящая группа для образования эпоксида. Поскольку факторы, лежащие в основе этих требований, противоречивы, настройка свойств катализатора оказалась трудной. Ниже показаны несколько наиболее успешных катализаторов, а также их выходы и энантиомерный избыток для их использования в синтезе (E)-стилбеноксида . [ 5 ] [ 2 ]
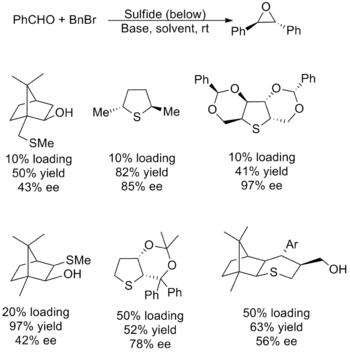
Аггарвал разработал альтернативный метод, в котором используется тот же сульфид, что и выше, и новый метод алкилирования с использованием родия карбеноида , образующегося in situ . Этот метод также имеет ограниченный объем субстратов и не подходит для любых электрофилов, имеющих основные заместители, из-за конкурентного потребления карбеноида. [ 2 ]

См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г Аггарвал, ВК ; Ричардсон, Дж. (2003). «Сложность катализа: причины энантио- и диастереоконтроля в реакциях эпоксидирования, опосредованных илидом серы». Химические коммуникации (21): 2644–2651. дои : 10.1039/b304625g . ПМИД 14649793 .
- ^ Jump up to: а б с д и ж Аггарвал, ВК ; Винн, CL (2004). «Каталитическое асимметричное эпоксидирование карбонильных соединений, опосредованное илидом серы: область применения, селективность и применение в синтезе». Отчеты о химических исследованиях . 37 (8): 611–620. дои : 10.1021/ar030045f . ПМИД 15311960 .
- ^ Jump up to: а б с Гололобов Ю.Г.; Несмеянов А.Н.; Лысенко, В.П.; Болдескул, И.Э. (1987). «Двадцать пять лет этилида диметилсульфоксония (реактив Кори)». Тетраэдр . 43 (12): 2609–2651. дои : 10.1016/s0040-4020(01)86869-1 .
- ^ Jump up to: а б Ли, А.-Х.; Дай, Л.-Х.; Аггарвал, В.К. (1997). «Асимметричные илидные реакции: эпоксидирование, циклопропанирование, азиридинирование, олефинирование и перегруппировка». Химические обзоры . 97 (6): 2341–2372. дои : 10.1021/cr960411r . ПМИД 11848902 .
- ^ Jump up to: а б с д Аггарвал, Вариндер К .; Форд, Дж. Гейр; Фонгерна, Сильвия; Адамс, Гарри; Джонс, Рэй В.Х.; Филдхаус, Робин (8 августа 1998 г.). «Каталитическое асимметричное эпоксидирование альдегидов. Оптимизация, механизм и открытие стереоэлектронного контроля, включающего комбинацию аномерного и Cieplak-эффектов в эпоксидировании сера-илида с хиральными 1,3-оксатианами». Журнал Американского химического общества . 120 (33): 8328–8339. дои : 10.1021/ja9812150 .
- ^ МакГарригл, EM; Майерс, Эл.; Илла, О.; Шоу, Массачусетс; Ричес, СЛ; Аггарвал, ВК (2007). «Халькогениды как органокатализаторы». Химические обзоры . 107 (12): 5841–5883. дои : 10.1021/cr068402y . ПМИД 18072810 .
- ^ Джонсон, AW; ЛаКаунт, РБ (1961). «Химия илидов. VI. Фторенилид диметилсульфония - синтез эпоксидов». Дж. Ам. хим. Соц. 83 (2): 417–423. дои : 10.1021/ja01463a040 .
- ^ Кори, Э.Дж .; Чайковский, М. (1965). «Метилид диметилоксосульфония ((CH 3 ) 2 SOCH 2 ) и метилид диметилсульфония ((CH 3 ) 2 SCH 2 ). Образование и применение в органическом синтезе». Дж. Ам. хим. Соц . 87 (6): 1353–1364. дои : 10.1021/ja01084a034 .
- ^ Кавасима, Т.; Окадзаки, Р. (1996). «Синтез и реакции промежуточных продуктов Виттига, Петерсона и родственные им реакции». Синлетт (7): 600–608. дои : 10.1055/s-1996-5540 .
- ^ Jump up to: а б с д и Ли, Джек Цзе (2005). Названные реакции в гетероциклической химии . Хобокен, Нью-Джерси: John Wiley & Sons, Inc., стр. 2–14. ISBN 9780471704140 .
- ^ Манди, Брэдфорд, П.; Эллерд, Майкл Д.; Фавалоро, Фрэнк Дж. младший (2005). Назовите реакции и реагенты в органической химии (2-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons, Inc., стр. 174–175, 743. ISBN. 9780471739869 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Данишевский, С.Дж.; Мастерс, Джей-Джей; Янг, ВБ; Линк, Джей Ти; Снайдер, Л.Б.; Маги, ТВ; Юнг, ДК; Айзекс, RCA; Борнманн, WG; Алаймо, Калифорния; Коберн, Калифорния; Ди Гранди, MJ (1996). «Тотальный синтез баккатина III и таксола». Журнал Американского химического общества . 118 (12): 2843–2859. дои : 10.1021/ja952692a .
- ^ Кюне, Мэн; Сюй, Ф. (1993). «Полный синтез алкалоидов стрихнана и аспидосперматана. 3. Полный синтез (.+-.)-стрихнина». Журнал органической химии . 58 (26): 7490–7497. дои : 10.1021/jo00078a030 .
- ^ Сян, Ю; Фань, Син; Цай, Пей-Цзюнь; Ю, Чжи-Сян (23 января 2019 г.). «Понимание региоселективности реакций Кори-Чайковского метилида диметилсульфоксония (DMSOM) и метилида диметилсульфония (DMSM) по отношению к енонам: исследование DFT» . Европейский журнал органической химии . 2019 (2–3): 582–590. дои : 10.1002/ejoc.201801216 . ISSN 1434-193Х .
- ^ Бютнер, Грегори Л.; Джордж, Дэвид Т. (20 января 2023 г.). «Возможности применения и развития циклопропанации Кори-Чайковского» . Исследования и разработки органических процессов . 27 (1): 10–41. дои : 10.1021/acs.oprd.2c00315 . ISSN 1083-6160 .
- ^ Луо, Дж.; Ши, К.Дж. (2010). «Полиомологация. Живая полимеризация C1». Отчеты о химических исследованиях . 43 (11): 1420–1433. дои : 10.1021/ar100062a . ПМИД 20825177 .