( E )-Стилбонс

| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
( E )-Стилбонс [ 1 ]
| |
| Предпочтительное название ИЮПАК
1,1 ′ -[( E )-Этен-1,2-диил]дибензол [ 1 ] | |
| Другие имена
Бибензилиден
транс -α,β-Дифенилэтилен ( E )-1,2-Дифенилэтилен ((1 E )-2-фенилвинил)бензол транс -Стильбен [( E )-2-Фенилэтенил]бензол | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 1616740 | |
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.002.817 |
| Номер ЕС |
|
| 4381 | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Число | 3077 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 14 Ч 12 | |
| Молярная масса | 180.250 g·mol −1 |
| Появление | Твердый |
| Плотность | 0,9707 г/см 3 |
| Температура плавления | От 122 до 125 ° C (от 252 до 257 ° F; от 395 до 398 К) |
| Точка кипения | От 305 до 307 ° C (от 581 до 585 ° F; от 578 до 580 К) |
| Практически нерастворим | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | > 112 ° C (234 ° F; 385 К) |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
( E )-Стильбен , широко известный как транс -стильбен , представляет собой органическое соединение , представленное сокращенной структурной формулой C 6 H 5 CH=CHC 6 H 5 . Классифицированный как диарилэтен , он имеет центральную этиленовую часть с одним фенильной группы заместителем на каждом конце двойной связи углерод-углерод . Он имеет ( E ) стереохимию, что означает, что фенильные группы расположены на противоположных сторонах двойной связи, что противоположно его геометрическому изомеру , цис -стильбену . Транс -стильбен представляет собой белое кристаллическое твердое вещество при комнатной температуре и хорошо растворяется в органических растворителях. превратить в цис- стильбен Его можно фотохимически и в дальнейшем подвергнуть реакции с образованием фенантрена .
Стильбен был открыт в 1843 году французским химиком Огюстом Лораном . [ 2 ] Название «стильбен» происходит от греческого слова στίλβω ( стильбо ), что означает «сияю», из-за блестящего внешнего вида соединения. [ 3 ]
Изомеры
[ редактировать ]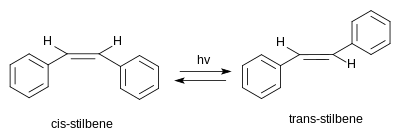
Стильбен существует в виде двух возможных стереоизомеров . Одним из них является транс -1,2-дифенилэтилен, называемый ( E )-стильбеном или транс -стильбеном. Второй - цис -1,2-дифенилэтилен, называемый ( Z )-стильбеном или цис -стильбеном, он стерически затруднен и менее стабилен, поскольку стерические взаимодействия выталкивают ароматические кольца из плоскости и предотвращают сопряжение . [ 4 ] Цис -стильбен представляет собой жидкость при комнатной температуре (точка плавления: 5–6 ° C (41–43 ° F)), а транс -стильбен представляет собой кристаллическое твердое вещество, которое не плавится примерно до 125 ° C (257 ° F). иллюстрируя, что два изомера имеют существенно разные физические свойства. [ 5 ] [ 6 ]
Препарат и реакции
[ редактировать ]Было разработано множество синтезов. Один из популярных способов предполагает снижение содержания бензоина с помощью амальгамы цинка. [ 6 ]
- C 6 H 5 –CH(OH)–C(=O)–C 6 H 5 транс -C 6 H 5 –CH=CH–C 6 H 5
Оба изомера стильбена могут быть получены декарбоксилированием α-фенилкоричной кислоты , причем транс -стильбен получается из ( Z )-изомера кислоты. [ 5 ]
Ричард Ф. Хек [ 7 ] и Цутому Мизороки [ 8 ] независимо сообщили о синтезе транс -стильбена путем сочетания йодбензола и стирола с использованием палладиевого катализатора (II) в ходе реакции, известной теперь как реакция Мизороки-Хека . [ 9 ] [ 10 ] Подход Мизороки дал более высокий урожай.
Стильбен вступает в реакции, типичные для алкенов. Транс -стильбен подвергается эпоксидированию пероксимонофосфорной кислотой H 3 PO 5 с выходом 74% оксида транс -стильбена в диоксане . [ 11 ] рацемическую . Образовавшийся эпоксидный продукт представляет собой смесь двух энантиомеров 1,2 дифенилоксирана - Ахиральное -1,2 - мезосоединение -стильбена, хотя (1R , 2S ) дифенилоксиран возникает из цис пероксидное эпоксидирование цис - изомера приводит к образованию как цис- , так и транс -эпоксидных продуктов. Например, при использовании трет гидропероксида -бутила при окислении цис -стильбена образуется 0,8% оксида цис -стильбена, 13,5% оксида транс -стильбена и 6,1% бензальдегида . [ 12 ] [ 13 ] Энантиочистый оксид стильбена был получен нобелевским лауреатом Карлом Барри Шарплессом . [ 14 ]
Стильбен можно чисто окислить до бензальдегида путем озонолиза. [ 15 ] или окисление Лемье-Джонсона , а более сильные окислители, такие как подкисленный перманганат калия, образуют бензойную кислоту . Вицинальные диолы могут быть получены дигидроксилированием Апджона или энантиоселективно с использованием асимметричного дигидроксилирования Шарплесса. [ 16 ] [ 17 ] с энантиомерным избытком до 100%. [ 18 ] [ 19 ] [ 20 ]
Бромирование транс -стильбена дает преимущественно мезо -1,2-дибром-1,2-дифенилэтан (иногда называемый мезо -стильбендибромидом ) в соответствии с механизмом, включающим промежуточный циклический ион бромония в типичной реакции электрофильного присоединения брома ; [ 21 ] цис -стильбен дает рацемическую смесь двух энантиомеров 1,2-дибром-1,2-дифенилэтана в неполярном растворителе, таком как четыреххлористый углерод но степень образования мезосоединения увеличивается , с увеличением полярности растворителя, с увеличением Выход 90% по нитрометану . [ 22 ] Образование небольших количеств двух энантиомеров стильбендибромида из транс -изомера позволяет предположить, что промежуточный ион бромония существует в химическом равновесии с промежуточным карбокатионом PhCHBr – C. + (H)Ph с вакантной p-орбиталью, уязвимой для нуклеофильной атаки с любой стороны. [ 21 ] Добавление солей бромидов или трибромидов восстанавливает большую часть стереоспецифичности даже в растворителях с диэлектрической проницаемостью выше 35. [ 23 ]
При УФ-облучении он превращается в цис -стильбен, классический пример фотохимической реакции, включающей транс - цис -изомеризацию , и может подвергаться дальнейшей реакции с образованием фенантрена . [ 24 ]
Производные и использование
[ редактировать ]Синтетический
[ редактировать ]( E )-Стильбен сам по себе представляет небольшую ценность, но он является предшественником других производных, используемых в качестве красителей , оптических отбеливателей , люминофоров и сцинтилляторов . [ 25 ] Стильбен — одна из усиливающих сред, используемых в лазерах на красителях . [ 26 ]


Динатриевый 4,4'-динитростильбен-2,2'-дисульфонат получают сульфированием 4 с -нитротолуола образованием 4-нитротолуол-2-сульфоновой кислоты, которую затем можно окислительно связать с использованием гипохлорита натрия с образованием ( E )- стильбена производное [ 27 ] в процессе, первоначально разработанном Артуром Джорджем Грином и Андре Валем в конце девятнадцатого века. [ 28 ] [ 29 ] Были разработаны усовершенствования процесса с более высокими выходами с использованием окисления воздухом в жидком аммиаке. [ 30 ] Продукт полезен тем, что его реакция с производными анилина приводит к образованию азокрасителей . Коммерчески важные красители, полученные из этого соединения, включают Direct Red 76, Direct Brown 78 и Direct Orange 40. [ 26 ]
Натуральные стильбоны
[ редактировать ]Стильбеноиды представляют собой природные производные стильбена. Примеры включают ресвератрол и его двоюродный брат птеростильбен . Стилбестролы ) -стильбену , которые структурно, но не синтетически родственны ( Е , проявляют эстрогенную активность. Члены этой группы включают диэтилстильбэстрол , фосфестрол и диэнэстрол . Некоторые такие производные получают путем конденсации производных кофермента А коричной кислоты или 4-гидроксикоричной кислоты и малоновой кислоты.
Приложение
[ редактировать ]Таблица 1. Давление пара [ 31 ]
| изомер | Температура, °С | Давление пара, кПа |
|---|---|---|
| цис -стильбены | 100 | 0.199 |
| цис -стильбены | 125 | 0.765 |
| цис -стильбены | 150 | 2.51 |
| транс -стильбен | 150 | 0.784 |
Ссылки
[ редактировать ]- ^ Jump up to: а б Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество . п. 379. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Лоран, Огюст (1843). «Мемуары о стильбене из серии» . Отчеты (на французском языке). 16 : 856–860. Из стр. 857: «Подвергая этот сульфид перегонке, он дает несколько продуктов, в том числе очень замечательное соединение, которое я называю стильбеном ». (При подвергании этого сульфида [т.е. фенилтиоальдегида, C 6 H 5 (CS)H] [сухой] перегонке он дает несколько продуктов, и среди других, очень замечательное соединение, которое я называю «стильбеном».)
- ^ Миллер, Уильям Аллен (1880). Элементы химии: теоретические и практические . Том. 3 (5-е изд.). Лондон, Англия: Longmans, Green and Co. p. 366.
- ^ Элиэль, Эрнест Л.; Вилен, Сэмюэл Х. (1994). Стереохимия органических соединений . Джон Уайли и сыновья. стр. 566-567 . ISBN 0-471-01670-5 .
- ^ Jump up to: а б Баклз, Роберт Э.; Уиллер, Норрис Г. (1953). « цис -Стильбен» . Органические синтезы . 33 : 88. дои : 10.15227/orgsyn.033.0088 ; Сборник томов , т. 4, с. 857 .
- ^ Jump up to: а б Шрайнер, РЛ; Бергер, Альфред (1943). « Транс -Стильбене» . Органические синтезы . 23 : 86. дои : 10.15227/orgsyn.023.0086 ; Сборник томов , т. 3, с. 786 .
- ^ Хек, РФ ; Нолли, JP (1972). «Катализируемые палладием реакции замещения винилового водорода арил-, бензил- и стирилгалогенидами». Дж. Орг. хим. 37 (14): 2320–2322. дои : 10.1021/jo00979a024 .
- ^ Мизороки, Цутому; Мори, Кунио; Одзаки, Ацуму (1971). «Арилирование олефина арилйодидом, катализируемое палладием». Бык. хим. Соц. Япония. 44 (2): 581. doi : 10.1246/bcsj.44.581 .
- ^ Черт возьми, Ричард Ф. (1982). «Катализируемое палладием винилирование органических галогенидов». Органические реакции . Том. 27. С. 345–390. дои : 10.1002/0471264180.или 027.02 . ISBN 0471264180 .
- ^ Белецкая Ирина П. ; Чепраков, Андрей В. (2000). «Чертова реакция как точильный камень палладиевого катализа». хим. Откр. 100 (8): 3009–3066. дои : 10.1021/cr9903048 . ПМИД 11749313 .
- ^ Огата, Ёсиро; Томизава, Котаро; Икеда, Тосиюки (1979). «Окисление транс -стильбена пероксимонофосфорной кислотой». J.Орг. хим. 44 (14): 2362–2364. дои : 10.1021/jo01328a006 .
- ^ Инь, Гочуань; Дэнби, Эндрю М.; Китко, Дэвид; Картер, Джон Д.; Шепер, Уильям М.; Буш, Дэрил Х. (2007). «Эпоксидирование олефинов алкилгидропероксидом с новым комплексом циклама и марганца с поперечными мостиками: демонстрация оксигенации двумя различными реакционноспособными промежуточными соединениями». Неорг. хим. 46 (6): 2173–2180. дои : 10.1021/ic061957r . ПМИД 17295471 .
- ^ Буш, Дэрил Х .; Инь, Гочуань; Меньше, Хён Джин (2011). «Эпоксидирование олефинов, катализируемое кислотой Льюиса, с использованием перекиси водорода: растущая известность и расширение диапазона» . В Ояме, С. Тед (ред.). Механизмы катализа гомогенного и гетерогенного эпоксидирования . Эльзевир . стр. 119–153. ISBN 9780080558011 .
- ^ Чанг, Хан-Тин; Шарплесс, К. Барри (1996). «Молярный синтез энантиочистого оксида стильбена». Дж. Орг. хим. 61 (18): 6456–6457. дои : 10.1021/jo960718q . ПМИД 11667495 .
- ^ Бишоп, Клайд Э.; Денсон, Дональд Д.; История, Пол Р. (1968). «Механизмы озонолиза. Цис , транс -стильбеновая система». Тетраэдр Летт. 9 (55): 5739–5742. дои : 10.1016/S0040-4039(00)76338-6 .
- ^ Якобсен, Эрик Н.; Марко, Иштван; Мангалл, Уильям С.; Шредер, Георг; Шарплесс, К. Барри (1988). «Асимметричное дигидроксилирование посредством катализа, ускоренного лигандами». Дж. Ам. хим. Соц. 110 (6): 1968–1970. дои : 10.1021/ja00214a053 .
- ^ Колб, Хартмут К.; ВанНьевенце, Майкл С.; Шарплесс, К. Барри (1994). «Каталитическое асимметрическое дигидроксилирование». хим. Откр. 94 (8): 2483–2547. дои : 10.1021/cr00032a009 .
- ^ Ван, Чжи-Мин; Шарплесс, К. Барри (1994). «Процедура асимметричного дигидроксилирования от твердого к твердому для получения энантиочистого гидробензоина в килограммовом масштабе». Дж. Орг. хим. 59 (26): 8302–8303. дои : 10.1021/jo00105a065 .
- ^ Макки, Блейн Х.; Гилхини, Деклан Г.; Шарплесс, К. Барри (1992). «( R , R )-1,2-Дифенил-1,2-этандиол (Стильбендиол)» . Органические синтезы . 70 : 47. дои : 10.15227/orgsyn.070.0047 ; Сборник томов , т. 9, с. 383 .
- ^ Атта-ур-Рахман ; Шах, Захир (1993). «Асимметрическое гидроксилирование» . Стереоселективный синтез в органической химии . Спрингер-Верлаг . стр. 406–410. ISBN 9781461383277 .
- ^ Jump up to: а б Гилберт, Джон К.; Мартин, Стивен Ф. (2010). «10.6 – Бромирование алкенов» . Экспериментальная органическая химия: мини- и микромасштабный подход (5-е изд.). Cengage Обучение . стр. 376–383. ISBN 9781439049143 .
- ^ Баклз, Роберт Э.; Бадер, Джейн М.; Тюрмайер, Роланд Дж. (1962). «Стереоспецифичность добавления брома к цис- и транс -стильбену». Дж. Орг. хим. 27 (12): 4523–4527. дои : 10.1021/jo01059a097 .
- ^ Бьянкини, Роберто; Кьяппе, Чинция (1992). «Стереоселективность и обратимость электрофильного присоединения брома к стильбенам в хлороформе: влияние равновесия бромид-трибромид-пентабромид в противоанионе ионных промежуточных продуктов». Дж. Орг. хим. 57 (24): 6474–6478. дои : 10.1021/jo00050a021 .
- ^ Квасьневский, СП; Клаас, Л.; Франсуа, Ж.-П.; Делез, М.С. (2003). «Высокоуровневое теоретическое исследование структуры и вращательных барьеров транс -стильбена». Дж. Хим. Физ. 118 (17): 7823–7836. Бибкод : 2003JChPh.118.7823K . дои : 10.1063/1.1563617 .
- ^ Фогт, Питер Ф.; Герулис, Джон Дж. (2000). «Амины ароматические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH . дои : 10.1002/14356007.a02_037 . ISBN 3527306730 .
- ^ Jump up to: а б Голод, Клаус; Мишке, Питер; Рипер, Вольфганг; Рауэ, Родерих; Клиент, Клаус; Энгель, Алоис (2000). «Азокрасители». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH . дои : 10.1002/14356007.a03_245 . ISBN 3527306730 .
- ^ Камминг, Уильям М.; Хоппер, И. Вэнс; Уиллер, Т. Шерлок (1926). «Препарат 294. Динитро-стильбен-дисульфоновая кислота (натриевая соль)» . Систематическая органическая химия: современные методы получения и оценки . Нью-Йорк: Компания Д. Ван Ностранда . п. 314.
- ^ Грин, Артур Г .; Валь, Андре Р. (1897). «Об окислении пара- нитротолуолсульфокислоты » . Бер. Немецкий. Хим. Гес . 30 (3): 3097–3101. дои : 10.1002/cber.189703003128 .
- ^ Грин, Артур Г .; Валь, Андре Р. (1898). «Об окислении пара- нитротолуолсульфокислоты » . Бер. Немецкий. Хим. Гес . 31 (1): 1078–1080. дои : 10.1002/cber.189803101195 .
- ^ Патент США 5041632 , Гульельметти, Леонардо, «Способ получения 4,4'-динитростильбен-2,2-дисульфоновой кислоты», опубликован 20 августа 1991 г., выдан 20 августа 1991 г., передан Ciba-Geigy Corporation.
- ^ Лиде, Дэвид (1995). Справочник CRC по химии и физике (76-е изд.). США: CRC Press, Inc., стр. 6–107. ISBN 0-8493-0476-8 .

![{\displaystyle {\ce {->[{\ce {Zn(Hg)}}][{\ce {HCl}}{\text{, }}{\ce {CH3CH2OH}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e1406e12754001b43f053ffef11d727e4d7de0e9)


