Соединения алюминия(I)
В химии алюминий(I) относится к одновалентному алюминию (степень окисления +1) как в ионных , так и в ковалентных связях. Наряду с алюминием (II) это крайне нестабильная форма алюминия.
В то время как поздние элементы 13-й группы, такие как таллий и индий, предпочитают степень окисления +1, алюминий (I) встречается редко. Алюминий не испытывает эффекта инертной пары — явления, при котором валентные электроны плохо защищаются от заряда ядра из-за наличия заполненных d- и f-орбиталей. [1] Таким образом, алюминий (III) ( ) — гораздо более распространенная степень окисления алюминия.
Соединения алюминия(I) склонны к диспропорционированию и их трудно получить. [2] В стандартных условиях они легко окисляются до формы алюминия(III).
Характеристики
[ редактировать ]
Al(I) кажется красным, поскольку растворы AlBr и AlCl в органических растворителях имеют красный цвет. [4] Наличие этого цвета подразумевает относительно небольшой разрыв HOMO/LUMO, доступный для зеленого света. [5]
Геометрию соединений можно определить путем анализа тонкой структуры электронных спектров. [2] Спектроскопия матричной изоляции предотвращает диспропорционирование моногалогенидов алюминия и, таким образом, позволяет измерять переходные колебания, а также реакционную способность с такими молекулами, как O 2 . [2] [6]
Анализ 27 Al ЯМР-спектроскопия AlCl, AlBr и AlI в толуоле/диэтиловом эфире при комнатной температуре обнаруживает два сигнала: один очень широкий сигнал при δ = 100–130 м.д. (независимо от галогена) и один при более высокой напряженности поля (AlCl: δ = + 30, AlBr: δ = + 50, AlI: δ = + 80). [2] Первый сигнал соответствует стабилизированным донором четырехкоординационным частицам алюминия, в то время как идентичность последнего неизвестна. [2]
Моногалогениды
[ редактировать ]Катион алюминия(I) реагирует с галогеноводородами с образованием следующих моногалогенидов алюминия: [1]
- монофторид алюминия (AlF)
- монохлорид алюминия (AlCl)
- монобромид алюминия (AlBr)
- монойодид алюминия (AlI)
Эти соединения термодинамически стабильны только при высоких температурах и низких давлениях в синглетном основном состоянии. [7] Однако разложение можно предотвратить, сделав диспропорционирование кинетически невыгодным. При низких температурах (ниже 77 К ) диспропорционирование происходит достаточно медленно, поэтому твердый AlCl может сохраняться в течение длительного периода времени. [1]
Синтез
[ редактировать ]AlCl синтезируется путем реакции жидкого алюминия с газообразным HCl при 1200 К и 0,2 мбар с получением газообразного AlCl и газообразного водорода. [1] При 77 К AlCl представляет собой темно-красное твердое вещество, которое при диспропорционировании становится черным при температуре выше 180 К. При температурах ниже 77 К он растворяется в матрице полярных и неполярных растворителей и существует в виде метастабильного раствора, реакционная способность которого может быть учился. AlBr, красное масло, получают аналогичным образом из жидкого алюминия и газообразного HBr . [4]
Из-за природы HF , который обладает гораздо более прочной связью, чем у его сородичей, [8] Вместо этого AlF синтезируется путем пропорционального распределения Al и AlF 3 , которые прессуются и смешиваются в гранулы. [9] Затем окатыши загружают в графитовую печь и нагревают до 1050 К. [9]
Стабильность увеличивается с увеличением массы: в то время как AlCl разлагается при 77 К и выше, AlBr остается стабильным до 253 К. [1] [4] Примечательно, что было обнаружено, что при любой заданной температуре давление пара AlF на несколько порядков ниже, чем у других моногалогенидов алюминия. [9]
Диспропорционирование
[ редактировать ]При комнатной температуре соединения AlX имеют тенденцию диспропорционироваться с Al и AlX 3 . Когда темно-красному твердому AlCl дают нагреться, он становится черным, образуя алюминий и более стабильную хлоридную соль алюминия (III). [1]
Домьер и др. документально подтверждено, что исключением является AlBr. AlBr достаточно стабилен при температурах ниже -30°С, поэтому становится пропорциональным AlBr2 в присутствии AlBr3 он . [2]
Олигомеризация
[ редактировать ]В основных растворах Льюиса соединения AlX имеют тенденцию к олигомеризации. [2]
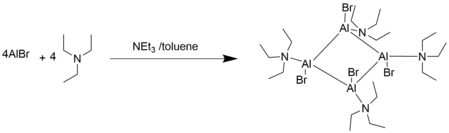
Сложная химия
[ редактировать ]Алюминий — не только самый распространенный металл в земной коре , но и малотоксичный элемент. В связи с этим комплексы алюминия (I) вызывают значительный интерес. Эти комплексы могут поддерживаться различными лигандами и использоваться для активации небольших молекул.
β-Дикетиминато системы
[ редактировать ]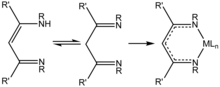
В 2018 году Лю и др. рассмотрена химия алюминия (I) с β-дикетиминатными лигандами, [10] широко используемые лиганды с огромной универсальностью электронных и стерических свойств. Эти комплексы алюминия (I) обладают огромным потенциалом для активации малых молекул. [10]
Синтез
β-дикетиминатоалюминийалкилы и галогениды алюминия синтезируют путем присоединения триалкилалюминиевого соединения к исходным β-дикетиминатным лигандам, добавления йода и восстановления калием. [10]
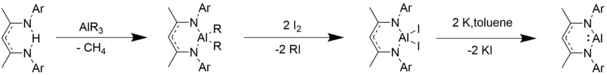
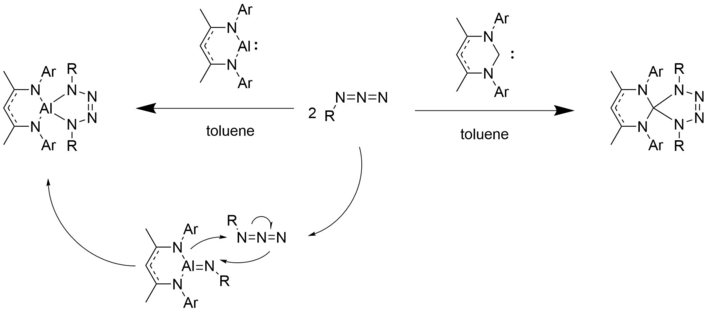
[1+2] Циклодополнения
[ редактировать ]Соединения Al(I) ведут себя аналогично синглетным карбенам . [10] Как и карбены, они подвергаются [1+2]-циклоприсоединениям с алкинами и азидами с образованием производных с трехчленным кольцом, таких как диалюминийциклогексадиен. [1] [10]
Подобно нуклеофильному углеродному центру в карбене, неподеленная пара алюминиевого центра связывается с первым азидным эквивалентом. Выделяется газообразный азот. Со вторым эквивалентом азида образуется пятичленный цикл.
Реакции с другими небольшими молекулами
[ редактировать ]Такие комплексы алюминия (I) могут активировать воду, а также элементарный фосфор, кислород и серу с образованием мостиковых димеров. Это происходит за счет частичного восстановления элементарной небольшой молекулы. [10]


АлКП*
[ редактировать ]AlCp*, состоящий из алюминия (I), связанного с анионом пентаметилциклопентадиена ((CCH3) 5 − ), был впервые синтезирован в 1991 году Dohmier et al. [12] (AlCp*) 4, желтое кристаллическое твердое вещество, которое сначала получают из комбинации AlCl и MgCp* 2. [6] При испарении длинные связи Al-Al (276,9 мкм) [12] расщепляется, и образуются мономерные молекулы [AlCp*].
Как показала работа Шнокеля, [AlCp*] реагирует, внедряясь в другие связи. Реакция с Al 2 I 6 приводит к образованию субвалентных галогенидов; реакция с As 4 tBu 4 дает связи As-Al. [6] При взаимодействии с комплексами переходного металла и циклопентадиенила, такими как NiCp 2 , он открывает прямой путь к соединениям, содержащим связи алюминий-переходный металл, что имеет большой потенциал для важных каталитических реакций. [2]


Как и другие лиганды AlR, [AlCp*] можно рассматривать как аналог CO , поскольку он имеет 2 пустые π-орбитали и участвует в аналогичных режимах координации (терминальном и мостиковом). [6] Это сходство подразумевает возможность обратных связей между AlCp* и металлами, с которыми он образует комплексы.
Металлоидные кластеры
[ редактировать ]Работу в алюминиевых кластерах провели Линти и Шнокель. Эти металлоидные кластеры могут быть образованы соединениями Al(I) – моногалогенидами алюминия. Эти кластеры называются «металлоидными кластерами», потому что количество мостиковых связей металл-металл превышает количество локализованных связей металл-лиганд. На пути к образованию металлов промежуточные соединения улавливаются объемистыми лигандами, замещающими атомы галогенидов. [6] [1] В результате богатые металлами кластеры, такие как Al 77 R 20 , которые позволяют понять процесс образования твердых металлов в объеме. возможны [6]
Тетраэдрический алюминий получается в результате реакции между частицами алюминия (I) и металлоорганическими соединениями. [6] Эти кластеры могут быть созданы с помощью таких комбинаций, как AlCp* и LiR, AlBr и Li(THF) 3 (SiMe 3 ) 3 , а также AlI и NaSiBu 3 . [6]


Этот метод формирования кластеров создал единственный известный случай октаэдрического алюминиевого кластера [Al 6 (tBu) 6 ] − , который образовался в результате реакции между AlCl и т Каждый. [6] Подобным образом AlCl и LiN(SiMe 3 ) 2 реагируют с образованием первого известного примера кластера, в котором два тетраэдра M 4 соединены общим центром. [6]
Естественное явление
[ редактировать ]Алюминий редко встречается в природе в степени окисления +1 из-за огромной стабильности степени окисления +3.
Вращательные переходы AlF и AlCl были обнаружены в околозвездных оболочках вблизи IRC +10216 . [9] [13] Присутствие AlF позволяет предположить, что фтор образуется в результате вспышек гелиевых оболочек вместо взрывного нуклеосинтеза . [13]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час Таке, Матиас; Шнёкель, Хансгеорг (1 июля 1989 г.). «Метастабильный хлорид алюминия AlCl в твердом состоянии и в растворе». Неорганическая химия . 28 (14): 2895–2896. дои : 10.1021/ic00313a039 . ISSN 0020-1669 .
- ^ Jump up to: а б с д и ж г час я Домейер, Карстен; Лоос, Дагмар; Шнёкель, Хансгеорг (2 февраля 1996 г.). «Соединения алюминия (I) и галлия (I): синтезы, структуры и реакции». Angewandte Chemie International Edition на английском языке . 35 (2): 129–149. дои : 10.1002/anie.199601291 . ISSN 0570-0833 .
- ^ ван дер Вёрд, Марк Дж.; Ламмертсма, Куп; Дюк, Брайан Дж.; Шефер, Генри Ф. (15 июля 1991 г.). «Простые смешанные гидриды бора, алюминия и галлия: AlBH6, AlGaH6 и BGaH6». Журнал химической физики . 95 (2): 1160–1167. дои : 10.1063/1.461146 . ISSN 0021-9606 .
- ^ Jump up to: а б с Мокер, Марио; Робл, Кристиан; Шнёкель, Хансгеорг (2 мая 1994 г.). «Донор-стабилизированный бромид алюминия (II)». Angewandte Chemie International Edition на английском языке . 33 (8): 862–863. дои : 10.1002/anie.199408621 . ISSN 0570-0833 .
- ^ Борен, Крейг (2006). Основы атмосферной радиации: введение с 400 задачами . Вайли-ВЧ. стр. 214 . ISBN 978-3-527-40503-9 .
- ^ Jump up to: а б с д и ж г час я дж к Шнокель (01 сентября 2000 г.). «Соединения низковалентного алюминия и галлия - структурное разнообразие и способы координации фрагментов переходных металлов». Обзоры координационной химии . 206–207: 285–319. дои : 10.1016/S0010-8545(00)00339-8 . ISSN 0010-8545 .
- ^ Нагендран, Сельвараджан; Роски, Герберт В. (5 февраля 2008 г.). «Химия алюминия (I), кремния (II) и германия (II)». Металлоорганические соединения . 27 (4): 457–492. дои : 10.1021/om7007869 . ISSN 0276-7333 .
- ^ Бенсон, Сидни В. (1965). «III – Энергии связи». Журнал химического образования . 42 (9): 502. Бибкод : 1965ЖЧЭд..42..502Б . дои : 10.1021/ed042p502 . ISSN 0021-9584 .
- ^ Jump up to: а б с д Дайк, Дж. М.; Кирби, К.; Моррис, А.; Грейвенор, BWJ; Кляйн, Р.; Росмус, П. (1 августа 1984 г.). «Исследование монофторида и трифторида алюминия методом высокотемпературной фотоэлектронной спектроскопии». Химическая физика . 88 (2): 289–298. Бибкод : 1984CP.....88..289D . дои : 10.1016/0301-0104(84)85286-6 . ISSN 0301-0104 .
- ^ Jump up to: а б с д и ж г Лю, Яшуай; Ли, Цзя; Ма, Сяоли; Ян, Чжи; Роски, Герберт В. (01 ноября 2018 г.). «Химия алюминия (I) с β-дикетиминатными лигандами и пентаметилциклопентадиенильными заместителями: синтез, реакционная способность и применение». Обзоры координационной химии . 374 : 387–415. дои : 10.1016/j.ccr.2018.07.004 . ISSN 0010-8545 . S2CID 105749253 .
- ^ Цуй, Чуньмин; Роски, Герберт В.; Шмидт, Ханс-Георг; Нольтемейер, Матиас; Хао, Хайджун; Чимпоесу, Фаника (1 декабря 2000 г.). «Синтез и структура мономерного соединения алюминия (I) [{HC(CMeNAr)2}Al] (Ar=2,6–iPr2C6H3): стабильный алюминиевый аналог карбена». Angewandte Chemie, международное издание . 39 (23): 4274–4276. doi : 10.1002/1521-3773(20001201)39:23<4274::AID-ANIE4274>3.0.CO;2-K . ISSN 1521-3773 . ПМИД 29711904 .
- ^ Jump up to: а б Домейер, Карстен; Робл, Кристиан; Таке, Матиас; Шнёкель, Хансгеорг (1991). «Тетрамерное соединение алюминия (I) [{Al (η5-C5Me5)}4]». Angewandte Chemie International Edition на английском языке . 30 (5): 564–565. дои : 10.1002/anie.199105641 . ISSN 0570-0833 .
- ^ Jump up to: а б Зюрис, LM ; Аппони, AJ; Филлипс, Т.Г. (7 апреля 1994 г.). «Экзотические молекулы фторида в IRC +10216: Подтверждение AlF и поиск MgF и CaF». Астрофизический журнал . 433 : 729–732. Бибкод : 1994ApJ...433..729Z . дои : 10.1086/174682 . ISSN 0004-637X .




