Сеть регулирования генов


Генная генетическая (или ) регуляторная сеть ( GRN ) представляет собой совокупность молекулярных регуляторов, которые взаимодействуют друг с другом и с другими веществами в клетке, управляя экспрессии генов уровнями мРНК и белков, которые, в свою очередь, определяют функцию клетки. . GRN также играет центральную роль в морфогенезе , создании структур тела, что, в свою очередь, играет центральную роль в эволюционной биологии развития (эво-дево).
Регулятором может быть ДНК , РНК , белок или любая комбинация двух или более из этих трех, которые образуют комплекс, например, специфическая последовательность ДНК и фактор транскрипции для активации этой последовательности. Взаимодействие может быть прямым или непрямым (через транскрибируемую РНК или транслируемый белок). В общем, каждая молекула мРНК образует определенный белок (или набор белков). В некоторых случаях этот белок будет структурным и будет накапливаться на клеточной мембране или внутри клетки, придавая ей определенные структурные свойства. В других случаях белок будет ферментом , то есть микромашиной, которая катализирует определенную реакцию, например расщепление источника пищи или токсина. Однако некоторые белки служат только для активации других генов, и именно эти факторы транскрипции играют главную роль в регуляторных сетях или каскадах. Связываясь с промоторной областью в начале других генов, они включают их, инициируя выработку другого белка и так далее. Некоторые факторы транскрипции являются ингибирующими. [1]
В одноклеточных организмах регуляторные сети реагируют на внешнюю среду, оптимизируя клетку в данный момент времени для выживания в этой среде. Таким образом, дрожжевая клетка, оказавшись в растворе сахара, активирует гены для выработки ферментов, перерабатывающих сахар в спирт. [2] Этот процесс, который мы связываем с виноделием, заключается в том, как дрожжевая клетка живет, получая энергию для размножения, что при нормальных обстоятельствах повышает ее шансы на выживание.
У многоклеточных животных тот же принцип используется в каскадах генов, контролирующих форму тела. [3] Каждый раз, когда клетка делится, образуются две клетки, которые, хотя и содержат один и тот же полный геном, могут различаться тем, какие гены включаются и производят белки. Иногда «самоподдерживающаяся петля обратной связи» гарантирует, что клетка сохраняет свою идентичность и передает ее дальше. Менее понятным является механизм эпигенетики , с помощью которого модификация хроматина может обеспечивать клеточную память, блокируя или разрешая транскрипцию. Главной особенностью многоклеточных животных является использование градиентов морфогена , которые, по сути, обеспечивают систему позиционирования, сообщающую клетке, в каком месте тела она находится и, следовательно, какой клеткой ей стать. Ген, включенный в одной клетке, может производить продукт, который покидает клетку и диффундирует через соседние клетки, проникая в них и активируя гены только тогда, когда его присутствие превышает определенный пороговый уровень. Таким образом, эти клетки приобретают новую судьбу и могут даже генерировать другие морфогены , которые передают сигнал исходной клетке. На больших расстояниях морфогены могут использовать активный процесс трансдукция сигнала . Такая передача сигналов контролирует эмбриогенез , построение плана тела с нуля посредством ряда последовательных шагов. Они также контролируют и поддерживают организм взрослого человека посредством процессов обратной связи , и потеря такой обратной связи из-за мутации может быть ответственна за пролиферацию клеток, наблюдаемую при раке . Параллельно с этим процессом построения структуры каскад генов включает гены, которые производят структурные белки , которые придают каждой клетке необходимые ей физические свойства.
Обзор
[ редактировать ]На одном уровне биологические клетки можно рассматривать как «частично смешанные пакеты» биологических химических веществ – при обсуждении сетей регуляции генов этими химическими веществами в основном являются информационные РНК (мРНК) и белки , которые возникают в результате экспрессии генов. Эти мРНК и белки взаимодействуют друг с другом с различной степенью специфичности. Некоторые диффундируют по клетке. Другие связываются с клеточными мембранами , взаимодействуя с молекулами окружающей среды. Третьи проходят через клеточные мембраны и передают сигналы дальнего действия другим клеткам многоклеточного организма. Эти молекулы и их взаимодействия составляют сеть регуляции генов . Типичная сеть регуляции генов выглядит примерно так:
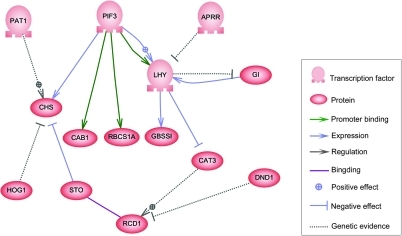
Узлы этой сети могут представлять собой гены, белки, мРНК, белково-белковые комплексы или клеточные процессы. Узлы, которые изображены лежащими вдоль вертикальных линий, связаны с интерфейсами ячейка/среда, тогда как остальные являются свободно плавающими и могут распространяться . Ребра между узлами представляют собой взаимодействия между узлами, которые могут соответствовать отдельным молекулярным реакциям между ДНК, мРНК, микроРНК, белками или молекулярным процессам, посредством которых продукты одного гена влияют на продукты другого, хотя отсутствие экспериментально полученной информации часто подразумевает, что некоторые реакции не моделируются на таком высоком уровне детализации. Эти взаимодействия могут быть индуктивными (обычно обозначаются стрелками или знаком +), с увеличением концентрации одного приводит к увеличению другого, тормозными (обозначаются закрашенными кружками, тупыми стрелками или знаком минус), с увеличением в одном приводящее к уменьшению другого, или двойственное, когда в зависимости от обстоятельств регулятор может активировать или затормозить целевой узел. Узлы могут регулировать себя прямо или косвенно, создавая петли обратной связи, которые образуют циклические цепочки зависимостей в топологической сети. Сетевая структура — это абстракция молекулярной или химической динамики системы, описывающая множество способов, которыми одно вещество влияет на все остальные, с которыми оно связано. На практике такие GRN выводятся из биологической литературы по данной системе и представляют собой квинтэссенцию коллективных знаний о наборе связанных биохимических реакций. Чтобы ускорить ручное курирование GRN, некоторые недавние попытки пытаются использовать интеллектуальный анализ текста , курируемые базы данных, сетевой вывод на основе массивных данных, проверка моделей и другие технологии извлечения информации для этой цели. [4]
Гены можно рассматривать как узлы в сети, где входными данными являются белки, такие как факторы транскрипции , а выходными данными — уровень экспрессии генов . Значение узла зависит от функции, которая зависит от значения его регуляторов на предыдущих временных шагах (в описанной ниже булевой сети это логические функции , обычно И, ИЛИ и НЕ). Эти функции интерпретируются как своего рода обработка информации внутри клетки, которая определяет клеточное поведение. Основными движущими силами внутри клеток являются концентрации некоторых белков, которые определяют как пространственные (расположение внутри клетки или ткани), так и временные (клеточный цикл или стадия развития) координаты клетки, как своего рода «клеточная память». Генные сети только начинают понимать, и следующим шагом биологии станет попытка определить функции каждого генного «узла», чтобы помочь понять поведение системы на возрастающих уровнях сложности, от гена до сигнального пути. , клеточном или тканевом уровне. [5]
Математические модели GRN были разработаны для отражения поведения моделируемой системы и в некоторых случаях для генерации прогнозов, соответствующих экспериментальным наблюдениям. В некоторых других случаях модели доказали, что они дают точные новые предсказания, которые можно проверить экспериментально, предлагая тем самым новые подходы к исследованию в эксперименте, которые иногда не учитываются при разработке протокола экспериментальной лаборатории. Методы моделирования включают дифференциальные уравнения (ОДУ), логические сети, сети Петри , байесовские сети , графические сетевые модели Гаусса , стохастические вычисления и исчисления процессов . [6] И наоборот, были предложены методы создания моделей GRN, которые лучше всего объясняют набор наблюдений временных рядов . Недавно было показано, что сигнал модификации гистонов ChIP-seq в большей степени коррелирует с мотивами транскрипционных факторов на промоторах, чем с уровнем РНК. [7] Следовательно, предполагается, что модификация гистонов ChIP-seq временных рядов может обеспечить более надежный вывод о генно-регуляторных сетях по сравнению с методами, основанными на уровнях экспрессии.
Структура и эволюция
[ редактировать ]Глобальная функция
[ редактировать ]Обычно считается, что сети генной регуляции состоят из нескольких узлов с высокой степенью связи ( концентраторов ) и множества узлов со слабой связью, вложенных в иерархический режим регуляции. Таким образом, сети регуляции генов приближаются к иерархического топологии свободной сети масштаба . [8] Это согласуется с мнением, что большинство генов обладают ограниченной плейотропией и действуют в рамках регуляторных модулей . [9] Считается, что эта структура развивается из-за преимущественного прикрепления дублированных генов к более тесно связанным генам. [8] Недавние исследования также показали, что естественный отбор имеет тенденцию отдавать предпочтение сетям с редкой связностью. [10]
В основном существует два пути развития сетей, оба из которых могут происходить одновременно. Во-первых, топология сети может быть изменена путем добавления или удаления узлов (генов) или части сети (модули) могут быть выражены в разных контекстах. Hippo сигнальный путь Drosophila . Хорошим примером является Сигнальный путь Hippo контролирует как митотический рост, так и постмитотическую клеточную дифференцировку. [11] Недавно было обнаружено, что сеть, в которой действует сигнальный путь Hippo, различается между этими двумя функциями, что, в свою очередь, меняет поведение сигнального пути Hippo. Это предполагает, что сигнальный путь Hippo действует как консервативный регуляторный модуль, который может использоваться для множества функций в зависимости от контекста. [11] Таким образом, изменение топологии сети может позволить консервативному модулю выполнять несколько функций и изменить конечный результат работы сети. Второй способ развития сетей — это изменение силы взаимодействий между узлами, например, насколько сильно транскрипционный фактор может связываться с цис-регуляторным элементом . Было показано, что такие различия в прочности краев сети лежат в основе межвидовых различий в паттерне судеб клеток вульвы червей Caenorhabditis . [12]
Местная особенность
[ редактировать ]
Другой широко цитируемой характеристикой регуляторной сети генов является обилие определенных повторяющихся подсетей, известных как сетевые мотивы . Сетевые мотивы можно рассматривать как повторяющиеся топологические закономерности при разделении большой сети на маленькие блоки. Предыдущий анализ обнаружил несколько типов мотивов, которые чаще появлялись в сетях генной регуляции, чем в случайно сгенерированных сетях. [13] [14] [15] Например, один из таких мотивов называется петлями прямой связи, которые состоят из трех узлов. Этот мотив является наиболее распространенным среди всех возможных мотивов, состоящих из трех узлов, как показано в регуляторных сетях генов мухи, нематоды и человека. [15]
Было предложено, чтобы обогащенные мотивы следовали конвергентной эволюции , предполагая, что они представляют собой «оптимальные конструкции» для определенных целей регулирования. [16] Например, моделирование показывает, что петли прямой связи способны координировать изменения в узле A (с точки зрения концентрации и активности) и динамику выражения узла C, создавая различное поведение ввода-вывода. [17] [18] Система галактозы утилизации E. coli содержит петлю прямой связи, которая ускоряет активацию оперона утилизации галактозы galETK , потенциально облегчая метаболический переход к галактозе при истощении запасов глюкозы. [19] Петля прямой связи в арабинозы системах утилизации E.coli задерживает активацию оперона и транспортеров катаболизма арабинозы, потенциально избегая ненужного метаболического перехода из-за временных колебаний в вышестоящих сигнальных путях. [20] Аналогично в сигнальном пути Wnt у Xenopus петля прямой связи действует как детектор кратных изменений, который реагирует на кратность изменения, а не на абсолютное изменение уровня β-катенина, потенциально увеличивая устойчивость к колебаниям β-катенина. -уровень катенина. [21] Согласно гипотезе конвергентной эволюции, обогащение контуров прямой связи будет адаптацией для быстрого реагирования и устойчивости к шуму. Недавнее исследование показало, что у дрожжей, выращенных в среде с постоянным уровнем глюкозы, развиваются мутации в сигнальных путях глюкозы и пути регуляции роста, что позволяет предположить, что регуляторные компоненты, реагирующие на изменения окружающей среды, необязательны в постоянной среде. [22]
С другой стороны, некоторые исследователи предполагают, что обогащение сетевых мотивов носит неадаптивный характер. [23] Другими словами, сети генной регуляции могут эволюционировать до аналогичной структуры без специального отбора предполагаемого поведения ввода-вывода. Подтверждение этой гипотезы часто приходит с помощью компьютерного моделирования. Например, колебания количества петель прямой связи в модели, которая моделирует эволюцию сетей генной регуляции путем случайного пересоединения узлов, могут свидетельствовать о том, что обогащение петель прямой связи является побочным эффектом эволюции. [24] В другой модели эволюции сетей генных регуляторов соотношение частот дупликации и делеции генов оказывает большое влияние на топологию сети: определенные соотношения приводят к обогащению петель прямой связи и создают сети, которые демонстрируют черты сетей без иерархического масштаба. Эволюция de novo когерентных контуров прямой связи типа 1 была продемонстрирована вычислительно в ответ на выбор их гипотетической функции по фильтрации короткого паразитного сигнала, поддерживая адаптивную эволюцию, но для неидеализированного шума - основанную на динамике систему подачи- Вместо этого было отдано предпочтение прямому регулированию с другой топологией. [25]
Бактериальные регуляторные сети
[ редактировать ]Регуляторные сети позволяют бактериям адаптироваться практически к каждой экологической нише на Земле. [26] [27] Сеть взаимодействий между различными типами молекул, включая ДНК, РНК, белки и метаболиты, используется бактериями для регулирования экспрессии генов. У бактерий основная функция регуляторных сетей заключается в контроле реакции на изменения окружающей среды, например, на состояние питания и экологический стресс. [28] Сложная организация сетей позволяет микроорганизму координировать и интегрировать множество сигналов окружающей среды. [26]
Одним из примеров стресса является ситуация, когда окружающая среда внезапно становится бедной питательными веществами. Это запускает сложный процесс адаптации у бактерий , таких как кишечная палочка . После этого изменения окружающей среды тысячи генов меняют уровень экспрессии. Однако эти изменения предсказуемы исходя из топологии и логики генной сети. [29] Об этом сообщается в RegulonDB . В частности, в среднем силу ответа гена можно было предсказать по разнице между количеством активирующих и репрессирующих входных факторов транскрипции этого гена. [29]
Моделирование
[ редактировать ]Связанные обыкновенные дифференциальные уравнения
[ редактировать ]Обычно такую сеть моделируют с помощью набора связанных обыкновенных дифференциальных уравнений (ОДУ) или СДУ , описывающих кинетику реакций составных частей. Предположим, что наша регулирующая сеть имеет узлы, и пусть представляют концентрации соответствующие вещества во время . Тогда временная эволюция системы может быть приближенно описана выражением
где функции выразить зависимость от концентрации других веществ, присутствующих в клетке. Функции в конечном итоге выводятся из основных принципов химической кинетики или простых выражений, полученных на их основе, например, Михаэлиса-Ментена ферментативной кинетики . Следовательно, функциональные формы обычно выбираются в виде полиномов низкого порядка или функций Хилла , которые служат анзацем для реальной молекулярной динамики. Такие модели затем изучаются с использованием математики нелинейной динамики . Специфическая для системы информация, такая как константы скорости реакции и чувствительность, кодируется как постоянные параметры. [30]
Решая для неподвижной точки системы:
для всех , можно получить (возможно, несколько) профили концентрации белков и мРНК, которые теоретически устойчивы (хотя и не обязательно стабильны ). Таким образом, устойчивые состояния кинетических уравнений соответствуют потенциальным типам клеток, а осциллирующие решения приведенного выше уравнения - естественно циклическим типам клеток. Математическая устойчивость этих аттракторов обычно может характеризоваться знаком высших производных в критических точках и тогда соответствовать биохимической устойчивости концентрационного профиля. Критические точки и бифуркации в уравнениях соответствуют критическим состояниям клеток, в которых небольшие изменения состояния или параметров могут переключить систему между одним из нескольких стабильных судеб дифференцировки. Траектории соответствуют развертыванию биологических путей, а переходные процессы уравнений — краткосрочным биологическим событиям. Более математическое обсуждение см. в статьях о нелинейности , динамических системах , теории бифуркаций и теории хаоса .
Логическая сеть
[ редактировать ]Следующий пример иллюстрирует, как булева сеть может моделировать GRN вместе с продуктами его генов (выходные данные) и веществами из окружающей среды, которые на него влияют (входные данные). Стюарт Кауфман был одним из первых биологов, использовавших метафору булевых сетей для моделирования генетических регуляторных сетей. [31] [32]
- Каждый ген, каждый вход и каждый выход представлены узлом ориентированного графа , в котором есть стрелка от одного узла к другому тогда и только тогда, когда между двумя узлами существует причинная связь.
- Каждый узел графа может находиться в одном из двух состояний: включен или выключен.
- Для гена «вкл» соответствует экспрессируемому гену; для входов и выходов «включено» соответствует присутствию вещества.
- Время рассматривается как происходящее дискретными шагами. На каждом шаге новое состояние узла представляет собой булеву функцию предыдущих состояний узлов со стрелками, указывающими на него.
Валидность модели можно проверить путем сравнения результатов моделирования с наблюдениями временных рядов. Частичная проверка модели булевой сети также может быть получена путем проверки предсказанного существования еще неизвестной регуляторной связи между двумя конкретными факторами транскрипции, каждый из которых является узлами модели. [33]
Непрерывные сети
[ редактировать ]Непрерывные сетевые модели GRN являются расширением описанных выше логических сетей. Узлы по-прежнему представляют собой гены и связи между ними, оказывающие регуляторное влияние на экспрессию генов. Гены в биологических системах демонстрируют непрерывный диапазон уровней активности, и утверждается, что использование непрерывного представления отражает некоторые свойства сетей регуляции генов, отсутствующие в булевой модели. [34] Формально большинство этих подходов похожи на искусственную нейронную сеть , поскольку входные данные узла суммируются, а результат служит входными данными для сигмовидной функции , например: [35] однако белки часто контролируют экспрессию генов синергическим, т. е. нелинейным образом. [36] Однако сейчас существует непрерывная сетевая модель. [37] это позволяет группировать входы в узел, реализуя, таким образом, другой уровень регулирования. Эта модель формально ближе к рекуррентной нейронной сети более высокого порядка . Та же модель также использовалась для имитации эволюции клеточной дифференцировки. [38] и даже многоклеточный морфогенез . [39]
Стохастические генные сети
[ редактировать ]Результаты экспериментов [40] [41] продемонстрировали, что экспрессия генов является стохастическим процессом. Таким образом, многие авторы теперь используют стохастический формализм после работы Аркина и др. [42] Работает над экспрессией одного гена [43] и небольшие синтетические генетические сети, [44] [45] такие как генетический тумблер Тима Гарднера и Джима Коллинза , предоставили дополнительные экспериментальные данные о фенотипической изменчивости и стохастической природе экспрессии генов. Первые версии стохастических моделей экспрессии генов включали только мгновенные реакции и основывались на алгоритме Гиллеспи . [46]
Поскольку некоторые процессы, такие как транскрипция генов, включают в себя множество реакций и не могут быть корректно смоделированы как мгновенные реакции в один этап, было предложено моделировать эти реакции как одностадийные реакции с множественной задержкой, чтобы учесть время, необходимое для весь процесс должен быть завершен. [47]
Отсюда был предложен набор реакций. [48] которые позволяют генерировать GRN. Затем они моделируются с использованием модифицированной версии алгоритма Гиллеспи, который может моделировать множественные реакции с задержкой по времени (химические реакции, в которых каждому из продуктов предоставляется временная задержка, которая определяет, когда он будет выпущен в систему как «готовый продукт»). .
Например, базовую транскрипцию гена можно представить следующей одностадийной реакцией (РНКП — РНК-полимераза, RBS — сайт связывания РНК-рибосомы, а Pro i — промоторная область гена i ):
Более того, похоже, существует компромисс между шумом в экспрессии генов, скоростью, с которой гены могут переключаться, и метаболическими затратами, связанными с их функционированием. Точнее, для любого заданного уровня метаболических затрат существует оптимальный компромисс между шумом и скоростью обработки, а увеличение метаболических затрат приводит к лучшему компромиссу между скоростью и шумом. [49] [50] [51]
В недавней работе был предложен симулятор (SGNSim, Stochastic Gene Networks Simulator ), [52] который может моделировать GRN, где транскрипция и трансляция моделируются как события с множественной задержкой во времени, а его динамика определяется алгоритмом стохастического моделирования (SSA), способным справляться с событиями с множественной задержкой во времени.Временные задержки можно получить из нескольких распределений, а скорости реакции — из комплексныхфункций или физических параметров. SGNSim может генерировать ансамбли GRN в рамках набора определяемых пользователем параметров, таких как топология. Его также можно использовать для моделирования конкретных GRN и систем химических реакций. Также можно моделировать генетические нарушения, такие как делеции генов, сверхэкспрессия генов, инсерции, мутации сдвига рамки считывания.
GRN создается из графа с желаемой топологией, налагающей распределения входящей и исходящей степени. На активность промотора гена влияют другие продукты экспрессии генов, которые действуют как входные данные в форме мономеров или объединены в мультимеры и установлены как прямые или непрямые. Затем каждый прямой входной сигнал назначается операторскому сайту, и различным факторам транскрипции можно разрешить или запретить конкурировать за один и тот же операторный сайт, в то время как косвенным входным сигналам присваивается цель. Наконец, каждому гену присваивается функция, определяющая реакцию гена на комбинацию факторов транскрипции (состояние промотора). Передаточные функции (то есть то, как гены реагируют на комбинацию входных сигналов) могут быть назначены каждой комбинации состояний промотора по желанию.
В других недавних работах были разработаны многомасштабные модели сетей генной регуляции, ориентированные на приложения синтетической биологии. Было использовано моделирование, которое моделирует все биомолекулярные взаимодействия при транскрипции, трансляции, регуляции и индукции генных регуляторных сетей, что определяет дизайн синтетических систем. [53]
Прогноз
[ редактировать ]Другая работа была сосредоточена на прогнозировании уровней экспрессии генов в сети регуляции генов. Подходы, используемые для моделирования сетей регуляции генов, были ограничены для интерпретации и, как следствие, обычно представляют собой упрощенные версии сети. Например, логические сети использовались из-за их простоты и способности обрабатывать зашумленные данные, но терять информацию данных из-за двоичного представления генов. Кроме того, искусственные нейронные сети не используют скрытый слой, чтобы их можно было интерпретировать, теряя способность моделировать корреляции более высокого порядка в данных. Используя модель, которая не ограничена интерпретацией, можно создать более точную модель. Возможность более точно прогнозировать экспрессию генов дает возможность изучить, как лекарства влияют на систему генов, а также определить, какие гены взаимосвязаны в этом процессе. Этому способствовал конкурс DREAM. [54] что способствует конкуренции на лучшие алгоритмы прогнозирования. [55] В некоторых других недавних работах использовались искусственные нейронные сети со скрытым слоем. [56]
Приложения
[ редактировать ]Рассеянный склероз
[ редактировать ]Выделяют три класса рассеянного склероза: рецидивно-ремиттирующий (РРС), первично-прогрессирующий (ППРС) и вторично-прогрессирующий (ВПРС). Сеть регуляции генов (GRN) играет жизненно важную роль в понимании механизма заболевания в трех различных классах рассеянного склероза. [57]
См. также
[ редактировать ]- План кузова
- Цис-регуляторный модуль
- Генная сеть (база данных)
- Морфоген
- Оперон
- Синевыражение
- Системная биология
- Анализ сети взвешенной совместной экспрессии генов
Ссылки
[ редактировать ]- ^ Латчман Д.С. (сентябрь 1996 г.). «Ингибирующие факторы транскрипции». Международный журнал биохимии и клеточной биологии . 28 (9): 965–974. дои : 10.1016/1357-2725(96)00039-8 . ПМИД 8930119 .
- ^ Ли Т.И., Ринальди Н.Дж., Роберт Ф., Одом Д.Т., Бар-Джозеф З., Гербер Г.К. и др. (октябрь 2002 г.). «Сети регуляции транскрипции у Saccharomyces cerevisiae». Наука . 298 (5594). Молодая лаборатория: 799–804. Бибкод : 2002Sci...298..799L . дои : 10.1126/science.1075090 . ПМИД 12399584 . S2CID 4841222 .
- ^ Дэвидсон Э., Левин М. (апрель 2005 г.). «Сети регуляции генов» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (14): 4935. Бибкод : 2005PNAS..102.4935D . дои : 10.1073/pnas.0502024102 . ПМК 556010 . ПМИД 15809445 .
- ^ Лейтнер Ф., Краллингер М., Трипати С., Койпер М., Легрейд А., Валенсия А. (июль 2013 г.). «Извлечение цис-регуляторных сетей транскрипции из литературы». Материалы BioLINK SIG 2013 : 5–12.
- ^ Аспейтиа Э., Муньос С., Гонсалес-Токман Д., Мартинес-Санчес М.Е., Вайнштейн Н., Нальди А. и др. (февраль 2017 г.). «Сочетание функций схем обратной связи является определяющим для количества и размера аттракторов в булевых сетях, подобных маршрутам» . Научные отчеты . 7 : 42023. Бибкод : 2017NatSR...742023A . дои : 10.1038/srep42023 . ПМК 5301197 . ПМИД 28186191 .
- ^ Банф М., Ри С.Ю. (январь 2017 г.). «Вычислительный вывод генных регуляторных сетей: подходы, ограничения и возможности» . Biochimica et Biophysica Acta (BBA) - Механизмы регуляции генов . 1860 (1): 41–52. дои : 10.1016/j.bbagrm.2016.09.003 . ПМИД 27641093 .
- ^ Кумар В., Муратани М., Райан Н.А., Краус П., Луфкин Т., Нг Х.Х., Прабхакар С. (июль 2013 г.). «Единая, оптимальная обработка сигналов сопоставленных данных глубокого секвенирования» . Природная биотехнология . 31 (7): 615–622. дои : 10.1038/nbt.2596 . ПМИД 23770639 .
- ^ Перейти обратно: а б Барабаси А.Л., Олваи З.Н. (февраль 2004 г.). «Сетевая биология: понимание функциональной организации клетки». Обзоры природы. Генетика . 5 (2): 101–113. дои : 10.1038/nrg1272 . ПМИД 14735121 . S2CID 10950726 .
- ^ Вагнер ГП, Чжан Дж (март 2011 г.). «Плейотропная структура карты генотип-фенотип: эволюционность сложных организмов». Обзоры природы. Генетика . 12 (3): 204–213. дои : 10.1038/nrg2949 . ПМИД 21331091 . S2CID 8612268 .
- ^ Леклерк Р.Д. (август 2008 г.). «Выживание самых редких: надежные генные сети экономны» . Молекулярная системная биология . 4 (1): 213. doi : 10.1038/msb.2008.52 . ПМК 2538912 . ПМИД 18682703 .
- ^ Перейти обратно: а б Джукам Д., Се Б., Ристер Дж., Террел Д., Чарльтон-Перкинс М., Пистилло Д. и др. (октябрь 2013 г.). «Противоположные обратные связи на пути бегемотов для контроля роста и судьбы нейронов» . Наука . 342 (6155): 1238016. doi : 10.1126/science.1238016 . ПМК 3796000 . ПМИД 23989952 .
- ^ Ойос Э., Ким К., Милло Дж., Баркулас М., Пениго Ж.Б., Манро Э., Феликс М.А. (апрель 2011 г.). «Количественные различия в аутокринной передаче сигналов и перекрестных помехах в вульвальной сети Caenorhabditis» . Современная биология . 21 (7): 527–538. дои : 10.1016/j.cub.2011.02.040 . ПМК 3084603 . ПМИД 21458263 .
- ^ Шен-Орр СС, Майло Р., Манган С., Алон У (май 2002 г.). «Сетевые мотивы в сети регуляции транскрипции Escherichia coli» . Природная генетика . 31 (1): 64–68. дои : 10.1038/ng881 . ПМИД 11967538 . S2CID 2180121 .
- ^ Ли Т.И., Ринальди Н.Дж., Роберт Ф., Одом Д.Т., Бар-Джозеф З., Гербер Г.К. и др. (октябрь 2002 г.). «Сети регуляции транскрипции у Saccharomyces cerevisiae». Наука . 298 (5594): 799–804. Бибкод : 2002Sci...298..799L . дои : 10.1126/science.1075090 . ПМИД 12399584 . S2CID 4841222 .
- ^ Перейти обратно: а б Бойл А.П., Арайя К.Л., Брдлик С., Кэйтинг П., Ченг С., Ченг Ю. и др. (август 2014 г.). «Сравнительный анализ регуляторной информации и схем между отдаленными видами» . Природа . 512 (7515): 453–456. Бибкод : 2014Natur.512..453B . дои : 10.1038/nature13668 . ПМЦ 4336544 . ПМИД 25164757 .
- ^ Конант Г.К., Вагнер А. (июль 2003 г.). «Конвергентная эволюция генных цепей». Природная генетика . 34 (3): 264–266. дои : 10.1038/ng1181 . ПМИД 12819781 . S2CID 959172 .
- ^ Манган С., Алон У (октябрь 2003 г.). «Структура и функция мотива сети петли прямой связи» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (21): 11980–11985. Бибкод : 2003PNAS..10011980M . дои : 10.1073/pnas.2133841100 . ПМК 218699 . ПМИД 14530388 .
- ^ Гоенторо Л., Шовал О., Киршнер М.В., Алон У. (декабрь 2009 г.). «Некогерентная петля прямой связи может обеспечить обнаружение складчатых изменений в регуляции генов» . Молекулярная клетка . 36 (5): 894–899. doi : 10.1016/j.molcel.2009.11.018 . ПМК 2896310 . ПМИД 20005851 .
- ^ Манган С., Ицковиц С., Заславер А., Алон У. (март 2006 г.). «Некогерентная петля прямой связи ускоряет время реакции гал-системы Escherichia coli». Журнал молекулярной биологии . 356 (5): 1073–1081. CiteSeerX 10.1.1.184.8360 . дои : 10.1016/j.jmb.2005.12.003 . ПМИД 16406067 .
- ^ Манган С., Заславер А., Алон У. (ноябрь 2003 г.). «Когерентная петля прямой связи служит чувствительным к знаку элементом задержки в сетях транскрипции». Журнал молекулярной биологии . 334 (2): 197–204. CiteSeerX 10.1.1.110.4629 . дои : 10.1016/j.jmb.2003.09.049 . ПМИД 14607112 .
- ^ Гоэнторо Л., Киршнер М.В. (декабрь 2009 г.). «Доказательства того, что изменение кратности, а не абсолютный уровень бета-катенина диктует передачу сигналов Wnt» . Молекулярная клетка . 36 (5): 872–884. doi : 10.1016/j.molcel.2009.11.017 . ПМК 2921914 . ПМИД 20005849 .
- ^ Квитек DJ, Шерлок Джи (ноябрь 2013 г.). «Секвенирование всего генома и всей популяции показывает, что потеря сигнальных сетей является основной адаптивной стратегией в постоянной среде» . ПЛОС Генетика . 9 (11): e1003972. дои : 10.1371/journal.pgen.1003972 . ПМЦ 3836717 . ПМИД 24278038 .
- ^ Линч М. (октябрь 2007 г.). «Эволюция генетических сетей посредством неадаптивных процессов». Обзоры природы. Генетика . 8 (10): 803–813. дои : 10.1038/nrg2192 . ПМИД 17878896 . S2CID 11839414 .
- ^ Кордеро ОХ, Хогевег П. (октябрь 2006 г.). «Петлевые схемы прямой связи как побочный эффект эволюции генома». Молекулярная биология и эволюция . 23 (10): 1931–1936. дои : 10.1093/molbev/msl060 . ПМИД 16840361 .
- ^ Сюн К., Ланкастер А.К., Сигал М.Л., Масел Дж. (июнь 2019 г.). «При наличии собственного шума регулирование с прямой связью адаптивно развивается через динамику, а не топологию» . Природные коммуникации . 10 (1): 2418. Бибкод : 2019NatCo..10.2418X . дои : 10.1038/s41467-019-10388-6 . ПМК 6546794 . ПМИД 31160574 .
- ^ Перейти обратно: а б Филлу А.А. , изд. (2012). Бактериальные регуляторные сети . Кайстер Академик Пресс . ISBN 978-1-908230-03-4 .
- ^ Гросс Р., Бейер Д., ред. (2012). Двухкомпонентные системы у бактерий . Кайстер Академик Пресс . ISBN 978-1-908230-08-9 .
- ^ Рекена Дж.М., изд. (2012). Стрессовая реакция в микробиологии . Кайстер Академик Пресс . ISBN 978-1-908230-04-1 .
- ^ Перейти обратно: а б Алмейда Б.Л., Бахрудин М.Н., Чаухан В., Даш С., Кандавалли В., Хаккинен А. и др. (июнь 2022 г.). «Сеть транскрипционных факторов E. coli управляет глобальными реакциями на изменения концентрации РНКП» . Исследования нуклеиновых кислот . 50 (12): 6801–6819. дои : 10.1093/nar/gkac540 . ПМЦ 9262627 . PMID 35748858 .
- ^ Чу Д., Забет Н.Р., Митавский Б. (апрель 2009 г.). «Модели связывания факторов транскрипции: чувствительность функций активации к предположениям модели» (PDF) . Журнал теоретической биологии . 257 (3): 419–429. Бибкод : 2009JThBi.257..419C . дои : 10.1016/j.jtbi.2008.11.026 . ПМИД 19121637 . S2CID 12809260 .
- ^ Кауфман С.А. (1993). Истоки порядка Издательство Оксфордского университета. ISBN 978-0-19-505811-6 .
- ^ Кауфман С.А. (март 1969 г.). «Метаболическая стабильность и эпигенез в случайно построенных генетических сетях». Журнал теоретической биологии . 22 (3): 437–467. Бибкод : 1969JThBi..22..437K . дои : 10.1016/0022-5193(69)90015-0 . ПМИД 5803332 .
- ^ Ловрич А., Гао И., Юхас Б., Бок И., Бирн Х.М., Диньес А., Ковач К.А. (ноябрь 2014 г.). «Булево моделирование выявляет новые регуляторные связи между факторами транскрипции, управляющими развитием вентральной части спинного мозга» . ПЛОС ОДИН . 9 (11): е111430. Бибкод : 2014PLoSO...9k1430L . дои : 10.1371/journal.pone.0111430 . ПМЦ 4232242 . ПМИД 25398016 .
- ^ Воградский Ю. (сентябрь 2001 г.). «Нейронная модель генетической сети» . Журнал биологической химии . 276 (39): 36168–36173. дои : 10.1074/jbc.M104391200 . ПМИД 11395518 .
- ^ Гирд Н., Уайлс Дж. (2005). «Модель генной сети для развития клеточных линий». Искусственная жизнь . 11 (3): 249–267. CiteSeerX 10.1.1.1.4742 . дои : 10.1162/1064546054407202 . ПМИД 16053570 . S2CID 8664677 .
- ^ Шилстра М.Дж., Болури Х. (2 января 2002 г.). «Моделирование регуляции экспрессии генов в генетических регуляторных сетях» . Группа биокомпьютеров, Университет Хартфордшира. Архивировано из оригинала 13 октября 2007 года.
- ^ Кнабе Дж. Ф., Неханив К. Л., Шилстра М. Дж., Квик Т. (2006). «Развитие биологических часов с использованием генетических регуляторных сетей». Материалы конференции Artificial Life X (Alife 10) . МТИ Пресс. стр. 15–21. CiteSeerX 10.1.1.72.5016 .
- ^ Кнабе Ю.Ф., Неханив К.Л., Шилстра М.Ю. (2006). «Эволюционная устойчивость дифференциации генетических регуляторных сетей». Материалы 7-го немецкого семинара по искусственной жизни 2006 г. (GWAL-7) . Берлин: Академическое издательство АКА . стр. 75–84. CiteSeerX 10.1.1.71.8768 .
- ^ Кнабе Ю.Ф., Шилстра М.Ю., Неханив К.Л. (2008). «Эволюция и морфогенез дифференцированных многоклеточных организмов: автономно генерируемые градиенты диффузии для позиционной информации» (PDF) . Искусственная жизнь XI: Материалы одиннадцатой Международной конференции по моделированию и синтезу живых систем . МТИ Пресс.
- ^ Еловиц М.Б., Левин А.Дж., Сиггиа Э.Д., Суэйн П.С. (август 2002 г.). «Стохастическая экспрессия генов в одной клетке» . Наука . 297 (5584): 1183–1186. Бибкод : 2002Sci...297.1183E . дои : 10.1126/science.1070919 . ПМИД 12183631 . S2CID 10845628 .
- ^ Блейк У.Дж., К.Эрн М., Кантор Ч.Р., Коллинз Дж.Дж. (апрель 2003 г.). «Шум в экспрессии генов эукариот». Природа . 422 (6932): 633–637. Бибкод : 2003Natur.422..633B . дои : 10.1038/nature01546 . ПМИД 12687005 . S2CID 4347106 .
- ^ Аркин А., Росс Дж., МакАдамс Х.Х. (август 1998 г.). «Стохастический кинетический анализ бифуркации путей развития в клетках Escherichia coli, инфицированных фагом лямбда» . Генетика . 149 (4): 1633–1648. дои : 10.1093/генетика/149.4.1633 . ПМК 1460268 . ПМИД 9691025 .
- ^ Разер Дж. М., О'Ши Э. К. (сентябрь 2005 г.). «Шум в экспрессии генов: происхождение, последствия и контроль» . Наука . 309 (5743): 2010–2013. Бибкод : 2005Наука...309.2010Р . дои : 10.1126/science.1105891 . ПМК 1360161 . ПМИД 16179466 .
- ^ Еловиц М.Б., Лейблер С. (январь 2000 г.). «Синтетическая колебательная сеть регуляторов транскрипции». Природа . 403 (6767): 335–338. Бибкод : 2000Natur.403..335E . дои : 10.1038/35002125 . ПМИД 10659856 . S2CID 41632754 .
- ^ Гарднер Т.С., Кантор Ч.Р., Коллинз Дж.Дж. (январь 2000 г.). «Создание генетического тумблера в Escherichia coli». Природа . 403 (6767): 339–342. Бибкод : 2000Natur.403..339G . дои : 10.1038/35002131 . ПМИД 10659857 . S2CID 345059 .
- ^ Гиллеспи Д.Т. (1976). «Общий метод численного моделирования стохастической временной эволюции связанных химических реакций». Дж. Компьютер. Физ . 22 (4): 403–34. Бибкод : 1976JCoPh..22..403G . дои : 10.1016/0021-9991(76)90041-3 .
- ^ Руссель М.Р., Чжу Р. (декабрь 2006 г.). «Валидация алгоритма задержки стохастического моделирования транскрипции и трансляции при экспрессии генов прокариот». Физическая биология . 3 (4): 274–284. Бибкод : 2006PhBio...3..274R . дои : 10.1088/1478-3975/3/4/005 . ПМИД 17200603 . S2CID 21456299 .
- ^ Рибейро А., Жу Р., Кауфман С.А. (ноябрь 2006 г.). «Общая стратегия моделирования сетей генной регуляции со стохастической динамикой». Журнал вычислительной биологии . 13 (9): 1630–1639. дои : 10.1089/cmb.2006.13.1630 . ПМИД 17147485 . S2CID 6629364 .
- ^ Забет Н.Р., Чу Д.Ф. (июнь 2010 г.). «Вычислительные пределы бинарных генов» . Журнал Королевского общества, Интерфейс . 7 (47): 945–954. дои : 10.1098/rsif.2009.0474 . ПМЦ 2871807 . ПМИД 20007173 .
- ^ Чу Д.Ф., Забет Н.Р., Хоне А.Н. (май – июнь 2011 г.). «Оптимальные настройки параметров для обработки информации в сетях генной регуляции» (PDF) . Биосистемы . 104 (2–3): 99–108. Бибкод : 2011BiSys.104...99C . doi : 10.1016/j.biosystems.2011.01.006 . ПМИД 21256918 .
- ^ Забет Н.Р. (сентябрь 2011 г.). «Отрицательная обратная связь и физические ограничения генов». Журнал теоретической биологии . 284 (1): 82–91. arXiv : 1408.1869 . Бибкод : 2011JThBi.284...82Z . дои : 10.1016/j.jtbi.2011.06.021 . ПМИД 21723295 . S2CID 14274912 .
- ^ Рибейро А.С., Ллойд-Прайс Дж. (март 2007 г.). «SGN Sim, симулятор стохастических генетических сетей» . Биоинформатика . 23 (6): 777–779. doi : 10.1093/биоинформатика/btm004 . ПМИД 17267430 .
- ^ Казнессис Ю.Н. (ноябрь 2007 г.). «Модели для синтетической биологии» . Системная биология BMC . 1 : 47. дои : 10.1186/1752-0509-1-47 . ПМК 2194732 . ПМИД 17986347 .
- ^ «Проект МЕЧТА» . Центр многомасштабного анализа геномных и клеточных сетей Колумбийского университета (MAGNet).
- ^ Густафссон М., Хернквист М. (февраль 2010 г.). «Прогнозирование экспрессии генов посредством мягкой интеграции и эластичной сети — лучшая производительность в тесте на экспрессию генов DREAM3» . ПЛОС ОДИН . 5 (2): е9134. Бибкод : 2010PLoSO...5.9134G . дои : 10.1371/journal.pone.0009134 . ПМЦ 2821917 . ПМИД 20169069 .
- ^ Смит М.Р., Клемент М., Мартинес Т., Снелл К. (2010). «Прогнозирование экспрессии генов временных рядов с использованием нейронных сетей со скрытыми слоями» (PDF) . Материалы 7-го симпозиума по биотехнологии и биоинформатике (БИОТ 2010) . стр. 67–69.
- ^ Гнанаккумаар П., Муругесан Р., Ахмед СС (сентябрь 2019 г.). «Сети регуляции генов в периферических мононуклеарных клетках раскрывают критические регуляторные модули и регуляторы рассеянного склероза» . Научные отчеты . 9 (1): 12732. Бибкод : 2019НатСР...912732Г . дои : 10.1038/s41598-019-49124-x . ПМК 6726613 . ПМИД 31484947 .
Дальнейшее чтение
[ редактировать ]- Болури Х., Бауэр Дж. М. (2001). Компьютерное моделирование генетических и биохимических сетей . Кембридж, Массачусетс: MIT Press. ISBN 978-0-262-02481-5 .
- Кауфман С.А. (март 1969 г.). «Метаболическая стабильность и эпигенез в случайно построенных генетических сетях». Журнал теоретической биологии . 22 (3): 437–467. Бибкод : 1969JThBi..22..437K . дои : 10.1016/0022-5193(69)90015-0 . ПМИД 5803332 .
Внешние ссылки
[ редактировать ]- База данных факторов транскрипции растений и платформа данных и анализа регуляции транскрипции растений
- Веб-сервис с открытым исходным кодом для анализа GRN
- BIB: Браузер биологического взаимодействия дрожжей
- Графические гауссовские модели для данных генома . Вывод о сетях ассоциаций генов с GGM.
- Библиография по изучению причинных сетей взаимодействий генов — регулярно обновляется, содержит сотни ссылок на статьи по биоинформатике, статистике, машинному обучению.
- https://web.archive.org/web/20060907074456/http://mips.gsf.de/proj/biorel/ BIOREL — это веб-ресурс для количественной оценки систематической ошибки генной сети по отношению к доступной информации из базы данных о генная активность/функция/свойства/ассоциации/взаимодействие.
- Эволюция биологических часов с использованием генетических регуляторных сетей — информационная страница с исходным кодом модели и Java-апплетом.
- Инженерные генные сети
- Учебное пособие: Генетические алгоритмы и их применение к искусственной эволюции генетических регуляторных сетей
- BEN: веб-ресурс для изучения связей между генами, болезнями и другими биомедицинскими объектами.
- Глобальное белок-белковое взаимодействие и сеть регуляции генов Arabidopsis thaliana. Архивировано 16 марта 2016 г. в Wayback Machine.








