Siglec
| Связывание сиаловой кислоты Ig-подобное семейство лектинов | |
|---|---|
| Идентификаторы | |
| Символ | Siglec |
| Мембраном | 210 |
Сиглеки (сиаловая кислота-связывающие иммуноглобулиновые лектины) представляют собой белки клеточной поверхности , которые связывают сиаловую кислоту . Они встречаются в основном на поверхности иммунных клеток и являются подмножеством лектинов I-типа . Существует 14 различных сиглеков млекопитающих, обеспечивающих множество различных функций, основанных на взаимодействии рецепторной поверхности клеточной поверхности. [ 1 ]
История
[ редактировать ]Первым описанным кандидатом SIGLEC был сиалоадгезин (SIGLEC-1/CD169), лектиноподобным белком адгезии на макрофагах . [ 2 ] Параллельные исследования Ajit Varki и коллег по ранее клонированному CD22 (белок A B -клеток, участвующий в адгезии и активации), показали прямые доказательства распознавания сиаловой кислоты. Последующее клонирование сиалоадгезина с помощью Crocker выявило гомологию для CD22 (Siglec-2), CD33 (Siglec-3) и миелинового гликопротеина (MAG/Siglec-4), что приводит к предложению для семейства «сиалаадгезинов». Затем Варки предложил термин SIGLEC в качестве лучшей альтернативы и в качестве подмножества лектинов I-типа (IG-тип) . Эта номенклатура была согласована и была принята почти всеми исследователями, работающими над этими молекулами (согласно Таким образом, все вместе называются «Siglecs, связанные с CD33». [ 3 ] Дальнейшие Siglecs были идентифицированы, включая SIGLEC-14 и SIGLEC-15. Сиглеки были охарактеризованы в две различные группы: первая и высококонсервативная группа млекопитающих, состоящая из сиалоадгезинов, CD22, MAG и Siglec-15, и вторая группа, составляющая SigleC, тесно связанные с CD33. [ 4 ] [ 5 ] Другие, такие как Siglec-8 и Siglec-9, имеют гомологи у мышей и крыс (Siglec-F и Siglec-E соответственно в обоих). Люди имеют большее количество сиглеков, чем мышей, и поэтому система нумерации была основана на белках человека. [ 6 ]
Структура
[ редактировать ]
Сиглеки - это трансмембранные белки типа I , где NH 3 + -Мермин находится во внеклеточном пространстве и COO − -Terminus является цитозольным . [ 7 ] Каждый Siglec содержит N-концевой иммуноглобулиновый домен V-типа (домен IG), который действует как связывающий рецептор для сиаловой кислоты. Эти лектины помещаются в группу лектинов I-типа, потому что домен лектина представляет собой иммуноглобулин. Все сиглеки расширяются от клеточной поверхности с помощью IG-доменов типа C2, которые не имеют активности связывания. Сиглеки отличаются по количеству этих доменов типа C2. [ 6 ] Поскольку эти белки содержат домены IG, они являются членами суперсемейства иммуноглобулина (IGSF).
Большинство сиглеков, таких как CD22 и семейство, связанное с CD33, содержат IIM ( иммунорецепторные ингибирующие мотивы на основе тирозина ) в их цитозольной области. [ 7 ] Они действуют для подавления сигнальных путей , включающих фосфорилирование , например, индуцированные итамами ( мотивы активации на основе тирозина иммунорецептора ). [ 8 ] Некоторые, однако, такие как Siglec-14, содержат положительные аминокислотные остатки, которые помогают стыковожать итам, содержащие белки адаптерных адаптерных лиц, такие как DAP12. [ 1 ]
Связывание лиганда
[ редактировать ]Из -за кислой природы сиаловой кислоты активные сайты Siglec содержат консервативный остаток аргинина , который положительно заряжается при физиологическом pH . Эта аминокислота образует солевые мосты с карбоксильной группой остатков сахара. [ 6 ] Это лучше всего увидеть в сиалоадгезине, где аргинин в положении 97 образует соленый мосты с COO − Группа сиаловой кислоты, создавая стабильное взаимодействие. [ 9 ] Каждый домен лектина специфичен для связи, которая соединяет сиаловую кислоту с гликаном . Сиаловая кислота содержит многочисленные гидроксильные группы, которые могут быть вовлечены в образование гликозидных связей , которые наблюдаются в углеродах № 2, 3, 6 и 8 сахара. Специфичность связывания каждого сиглека обусловлена различными химическими взаимодействиями между сахарным лигандом и аминокислотами Siglec. Положение в пространстве отдельных групп на сахаре и аминокислотах белка влияет на связь сиаловой кислоты, с которой связывается каждый сиглек. Например, сиалоадгезин преимущественно связывает α2,3 связей по сравнению с α2,6 связками. [ 9 ]
Функция
[ редактировать ]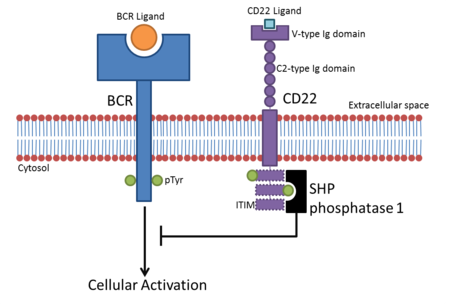
Основная функция сиглеков заключается в связывании гликанов, содержащих сиаловые кислоты. Эти рецептор-гликановые взаимодействия могут использоваться в клеточной адгезии, передаче сигналов клеток и других. Функция SIGLECS ограничена их клеточным распределением. Например, MAG обнаруживается только на олигодендроцитах и клетках Schwann , тогда как сиалоадгезин локализуется в макрофагах.
Большинство сиглеков короткие и не простираются далеко от клеточной поверхности. Это предотвращает связывание большинства сиглеков с другими клетками, поскольку клетки млекопитающих покрыты в гликанах сиаловой кислоты. Это означает, что большинство сиглеков связывают лиганды только на поверхности одной и той же клетки, так называемые цис -лиганды, поскольку они «завалены» гликанами на той же клетке. Одним из исключений является сиалоадгезин, который содержит 16 доменов C2 -IG, создавая длинный расширенный белок, позволяющий ему связывать транс -лиганды, то есть лиганды, обнаруженные на других клетках. Также было показано, что другие, такие как MAG, связывают транс -лиганды.
Сигнализация
[ редактировать ]Члены семейства Siglec являются парными рецепторами с противоположными внутриклеточными сигнальными функциями. [ 10 ] [ 11 ] Из-за их цитоплазматических областей, содержащих ITIM, большинство сиглеков мешают клеточной передаче сигналов, ингибируя активацию иммунных клеток. После того, как они связаны с их лигандами, SIGLEC рекрутируют ингибирующие белки, такие как SHP -фосфатазы, через их домены ITIM. [ 12 ] Тирозин, содержащий в ITIM, фосфорилируется после связывания лиганда и действует как сайт стыковки для белков, содержащих домен SH2, таких как фосфатазы SHP. Это приводит к де-фосфорилированию клеточных белков, подавляющему активационным сигнальным путям.
Примеры отрицательной сигнализации:
- CD22 обнаруживается на В -клетках. В-клетки становятся активными, когда B-клеточный рецептор (BCR) связывается с его родственным лигандом. Как только BCR связан с его лигандом, рецептор автофосфорилирует ее цитоплазматическую область (цитоплазматический хвост). Это приводит к фосфорилированию трех ITIM в цитоплазматическом хвосте CD22, что приводит к рекрутированию SHP-1 , что отрицательно регулирует активацию клеток на основе BCR. Это создает порог активации для активации В -клеток, в результате чего преходящая активация В -клеток предотвращается. [ 13 ] Первоначально считалось, что ингибирование передачи сигналов BCR является независимым от сиаловой кислоты, но данные свидетельствуют о том, что лиганды α2,6 сиаловой кислоты необходимы для ингибирования. [ 14 ]
- SIGLEC-7 обнаруживается на естественных клетках-убийце (NK-клетках). SIGLEC-7 приводит к клеточной инактивации, которая однажды связана с его содержащей сиаловой кислотой лигандом и обнаруживается на высоких уровнях на поверхностях NK-клеток. Он используется в клеточных контактах, связываясь с сиалитированными гликанами на клетках-мишенях, что приводит к ингибированию зависимого от NK-клеток, уничтожая клетку-мишени. Клетки млекопитающих содержат высокие уровни сиаловой кислоты, и поэтому, когда NK-клетки связывают так называемые «самостоятельные», они не активируются и не убивают клетки-хозяина.
Siglec-14 содержит остаток аргинина в ее трансмембранной области. [ 15 ] Это связывается с белками DAP10 и DAP12 DAP12 DAP10. При связи со своим лигандом, Siglec-14 приводит к активации клеточных сигнальных путей через белки DAP10 и DAP12. [ 7 ] Эти белки активируют каскады фосфорилирования с участием многочисленных клеточных белков, что приводит к клеточной активации. SIGLEC-14, по-видимому, совместно локализует SIGLEC-5, и поскольку этот белок ингибирует клеточные сигнальные пути, координирует противоположные функции в иммунных клетках. [ 15 ]
Фагоцитоз и адгезия
[ редактировать ]Сиглеки, которые могут связывать транс -лиганды, такие как сиалоадгезин, позволяют иметь место взаимодействие клеток. Эти взаимодействия гликана-сиглека позволяют клеткам связываться друг с другом, позволяя сигнализировать в некоторых случаях, или в случае сиалоадгезина, поглощения патогена . Первоначально считалось, что функция Сиалоадгезина была важной для связывания с эритроцитами . Сиалоадгезину не хватает цитозольного итма или положительного остатка для связывания адаптеров, содержащих итам, и, следовательно, считается, что он не влияет на передачу сигналов. Исследования показывают, что этот белок участвует в фагоцитозе бактерий, которые содержат высоко сиалированные структуры гликана, такие как липополисахарид Neisseria meningitidis . [ 16 ] Связывание с этими структурами позволяет макрофагам фагоцитозу эти бактерии, очищая систему патогенных микроорганизмов.
SIGLEC-7 также используется при связывании с патогенами, такими как Campylobacter jejuni . Это происходит в зависимости от сиаловой кислоты и привносит NK-клетки и моноциты , на которых экспрессируется SIGLEC-7, в контакт с этими бактериями. [ 17 ] Затем NK -клетка может убить эти иностранные патогены.
Нокаутированные исследования
[ редактировать ]Нокаутные исследования часто используются для раскрытия функциональных белков в клетке. Мышей часто используются, поскольку они экспрессируют ортологичные наши белки или очень похожие гомологи.
Некоторые примеры нокаутных сиглеков включают:
- CD22: Уокер и Смит провели эксперименты с нокаутами CD22 и делеционными мутантами, чтобы различить функцию CD22. [ 18 ] Эти мутантные В -клетки не выводили каких -либо аутоиммунных заболеваний , но они действительно видели увеличенную продукцию аутоантител из -за отсутствия ингибирования передачи сигналов BCR, обычно проводимых CD22. Аутоантитела являются специфичными для белков самостоятельно и могут привести к вреда у хозяина. CD22 обычно активируется липополисахаридным связыванием с рецепторами, подобными Toll . Мутантные В-клетки не могут активизировать мутантный белок и поэтому становятся гиперчувствительными в присутствии липополисахарида. Это означает, что В -клетки перепроизводят антитела, когда антитела обычно не продуцируются.
- MAG (миелиновый гликопротеин) экспрессируется на клетках, которые образуют миелиновые оболочки (клетки Schwann и олигодендроциты) вокруг нейронов . Маг связывается с сиалированными лигандами на нейроне. Нокаут MAG в периферической нервной системе приводит к снижению миелинизации нейронов. Нокаутирование MAG в центральной нервной системе мышей, по-видимому, не влияет на миелинизация, но взаимодействие между миелином и нейроном ухудшается с возрастом. Это приводит к неврологическим дефектам, поскольку потенциал действия не может так быстро проходить по длине аксона во время нервной стимуляции. Удаление лиганда для MAG, выбив ген Galnac Transferase, необходимый для формирования лиганда, оказывает сходное влияние на влияние мышей, нокаутированных Mag, нокаутированных [ 19 ]
Человеческие/примальные сиглеки
[ редактировать ]| Имя | Клеточное распределение [ 7 ] | Специфичность связи сиаловой кислоты [ 6 ] | Количество доменов C2-IG [ 7 ] | Itim или положительный остаток [ 7 ] |
|---|---|---|---|---|
| Siglec-1 ( Sialoadhesin ) | Макрофаги | α2,3> α2,6 | 16 | Никто |
| SIGLEC-2 ( CD22 ) | В -клетки | A2.6 | 6 | Черный |
| SIGLEC-3 ( CD33 ) | Миелоидные предшественники, моноциты | α2,6> α2,3 [ 20 ] | 1 | Черный |
| Siglec-4 ( Mag ) | Миель | α2,3> α2,6 | 4 | Никто |
| SIGEC-5 ( CD170 ) | Нейтрофилы, моноциты | A2.3 | 3 | Черный |
| SIGLEC-6 ( CD327 ) | Трофобласты, тучные клетки | A2.6 | 2 | Черный |
| Siglec-7 ( CD328 ) | NK -клетки | α2,8> α2,6> α2,3 | 2 | Черный |
| SIGEC-8 | Эозинофилы, тучные клетки | α2,3> α2,6 | 2 | Черный |
| Siglec-9 ( CD329 ) | Моноциты, нейтрофилы, дендритные клетки | α2,3 = α2,6 (предпочитает сульфатированные остатки) | 2 | Черный |
| SIGEC-10 | В -клетки | A2.3 = A2.6 | 4 | Черный |
| SIGEC-11 | В -клетки | A2.8 | 4 | Черный |
| SIGEC-12 [ 21 ] | Макрофаги | Нет связывания [ 6 ] | 2 | Черный |
| SIGEC-13 [ 22 ] | Шимпанзе моноциты | |||
| SIGEC-14 | Неизвестный | A2.6 [ 15 ] | 2 | Аргинин [ 15 ] |
| SIGEC-15 [ 4 ] | Остеокласты, макрофаги, DCS Siglec-15 [ 4 ] [ 23 ] [ 24 ] | A2.6 [ 25 ] | 1 | Лизин [ 25 ] |
| SIGEC-16 [ 26 ] | Тканевые макрофаги | |||
| SIGEC-17 [ 22 ] | NK -клетки |
Эта таблица кратко суммирует клеточное распределение каждого человека/приматов; Специфичность связи, каждая для связывания сиаловой кислоты; количество доменов C2-IG, которое он содержит; и содержит ли он ITIM или положительный остаток, чтобы связывать адаптерные белки, содержащиеся итам. Ссылки в заголовках столбцов соответствуют всей информации, отображаемой в этом столбце, если не показаны другие ссылки. Информация SIGLEC-12 ссылается [ 21 ] Только, исключая специфичность связи.
Миметика
[ редактировать ]Многие патологии были связаны с спонтанными взаимодействиями между сиаловой кислотой и иммуносупрессивной сиаловой кислотой, связывающей иммуноглобулиноподобную лектин (SIGLEC) рецепторы на иммунных клетках, таких как рак , [ 27 ] ВИЧ-1 [ 28 ] и группу B стрепкотокопной инфекции . [ 29 ] [ 30 ] Семейство сиаловой кислоты разветвляется из гликанов, сахарные цепи, содержащие различные моносахариды, которые покрывают мембрану каждой живой клетки и демонстрируют ошеломляющее структурное разнообразие. Сиаловые кислоты функционируют в складывании белков, развитии нерв, клеточном взаимодействии, среди многих других физиологических процессов. Поскольку сиаловые кислоты в изобилии экспрессируются у позвоночных, а не в микроорганизмах, они считаются самостоятельными или самоструктуру, которые играют основную роль в ингибировании вредной активности иммунной системы путем регуляции нейтрофилов и толерантности к В-клеткам. [ 31 ]
Внутри иммунной системы SIGLEC, особенно те, которые связаны с CD33, сиаловой кислотой и SigleC-связывающими патогенами, подвергаются явлению сбежавшей ко-эволюции Red Queen-Queen благодаря отборочному давлению, которое поддерживает врожденную способность иммунной системы для самоуправления и обеспечивает профилактику аутоиммула. Болезни. [ 32 ] [ 33 ] Эта эволюционная цепь и непрекращающиеся мутации сделали Siglecs одним из наиболее быстро развивающихся генов, о чем свидетельствуют как внутри-, так и межвидовые различия. [ 33 ] Полиморфизм Siglec -12, -14 и -16 человека, -14 и -16 предполагает, что давление отбора продолжается. [ 32 ]
Поскольку SIGLEC имеют различные предпочтения связывания для сиаловой кислоты и ее модификации, было предпринято несколько попыток химически модифицировать природные лиганды сиаловой кислоты и в конечном итоге привело к созданию миметики сиаловой кислоты (SAM) с усиленной способностью связывания и селективностью в отношении SIGLEC. [ 34 ]
Синтез
[ редактировать ]SAM могут использоваться для нацеливания на сиглека и модуляции SIGLEC-экспрессирующих клеток путем модификации основной цепи сиаловой кислоты в различных положениях, от C-2 до C-9. [ 34 ] [ 35 ] [ 36 ] Карбоновая кислота, однако, должна быть оставлена нетронутой. [ 34 ] Были предприняты первые попытки разработать миметику сиалиновой кислоты с высокой аффинной кислотой для Siglec-2, что привело к открытию, что повышение аффинности связывания стало водородным связью и липофильными взаимодействиями между SAMS и SIGLEC-2. [ 34 ] Несколько отдельных модификаций были сделаны в положениях C-2, C-5 и C-9, ведущих Mesch et al. Чтобы предположить, что одновременная модификация во всех трех положениях может привести к оптимизации связывания. [ 37 ]
Успех в резко усиленном связывании SAM с Siglec 2 предполагает, что аналогичный подход может работать с другими членами семьи. Некоторые модификации включали дополнительную одновременную модификацию в положении C-4 на основной цепи сиаловой кислоты. [ 34 ] Разработка (медной) I -катализированной азидной алкинской циклической циклической циклической ( CUAAC ) Click Chemistry ускорила идентификацию новых SAM и позволила создать новые SAM с высоким связыванием с Siglec -3, -5, -6, -7 и 10 [ 38 ] По состоянию на 2017 год было зарегистрировано SAMS для большинства SIGLEC, за исключением SIGLEC -6, -8, -11, -14, -15 и -16. [ 34 ]
Кластеризация рецепторов и связывания с высокой агисткой, коллективно известной как мультивалентное связывание , может повысить эффективность SAM в организме человека. В настоящее время достижения в GlycoEngineering использовали, украшенные SAM-регистрацией, полимеры, украшенные SAM и синтез SAMS для представления SAM для SIGLEC. [ 34 ] Также было показано, что липосомы, сшитые с помощью SAM, помогают представлять антигены антиген-презентативным клеткам через пути Siglec-1 или -7. [ 39 ] Более того, клетки человека, разработанные сиаловыми кислотами, несущими AC 5 Neunpoc, включенные в его сиалогликаны и 3-бромбензил азид, показали гиперактивность в направлении Siglec-2. [ 34 ] [ 40 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный Pillai S, Netravali IA, Cariappa A, Mattoo H (2012). «Сиглеки и иммунная регуляция» . Ежегодный обзор иммунологии . 30 : 357–92. doi : 10.1146/Annurev-Immunol-020711-075018 . PMC 3781015 . PMID 22224769 .
- ^ Crocker PR, Гордон С. (декабрь 1986 г.). «Свойства и распределение лектиноподобного гемагглютинина дифференциально экспрессируется макрофагами мышиной стромальной ткани» . Журнал экспериментальной медицины . 164 (6): 1862–75. doi : 10.1084/jem.164.6.1862 . PMC 2188478 . PMID 3783087 .
- ^ Crocker PR, Varki A (июнь 2001 г.). «Сиглеки в иммунной системе» . Иммунология . 103 (2): 137–45. doi : 10.1046/j.0019-2805.2001.01241.x . PMC 1783234 . PMID 11412300 .
- ^ Jump up to: а беременный в Wang Y, Zhan X, et al. (22 января 2024 г.). «Ось SIGLEC-15/сиаловой кислоты в качестве центральной глико-имммунной контрольной точки в метастазировании костей рака молочной железы» . Труды Национальной академии наук Соединенных Штатов Америки . 121 (5): E2312929121. doi : 10.1073/pnas.2312929121 . PMC 10835054 . PMID 38252825 .
- ^ Маколи М.С., Крокер П.Р., Полсон Дж.С. (октябрь 2014 г.). «Сиглек-опосредованная регуляция функции иммунных клеток при заболевании» . Природные обзоры. Иммунология . 14 (10): 653–66. doi : 10.1038/nri3737 . PMC 4191907 . PMID 25234143 .
- ^ Jump up to: а беременный в дюймовый и Варки А., Ангата Т (январь 2006 г.). «Сиглеки-главное подсемейство лектинов I-типа» . Гликобиология . 16 (1): 1R - 27R. doi : 10.1093/glycob/cwj008 . PMID 16014749 .
- ^ Jump up to: а беременный в дюймовый и фон Crocker PR, Paulson JC, Varki A (апрель 2007 г.). «Сиглеки и их роли в иммунной системе» . Природные обзоры. Иммунология . 7 (4): 255–66. doi : 10.1038/nri2056 . PMID 17380156 . S2CID 26722878 .
- ^ Daëron M, Jaeger S, Du Pasquier L, Vivier E (август 2008 г.). «Мотивы ингибирования на основе тирозина иммунорецептора: квест в прошлом и будущем». Иммунологические обзоры . 224 : 11–43. doi : 10.1111/j.1600-065x.2008.00666.x . PMID 18759918 . S2CID 24902428 .
- ^ Jump up to: а беременный Hartnell A, Steel J, Turley H, Jones M, Jackson DG, Crocker PR (январь 2001 г.). «Характеристика сиалоадгезина человека, рецептора связывания сиаловой кислоты, экспрессируемого резидентными и воспалительными популяциями макрофагов». Кровь . 97 (1): 288–96. doi : 10.1182/blood.v97.1.288 . PMID 11133773 .
- ^ Ленца, Мария Пия; Atxabal, Unoi; Ойнарте, Икер; Джименес-Барберо, Хесус; Эрено-Орбеа, июнь (2020-12-15). «Состояние текущего на терапевтических молекулах, нацеленных на рецепты доступа» . Ячейки 9 (12): 2691. doi : 10.3390/cells9122691 . PMC 7765293 . PMID 3333862 .
- ^ Аккайя, Мунир; Барклай, А. Нил (февраль 2013 г.). «Как патогены стимулируют эволюцию парных рецепторов?: Основные моменты» . Европейский журнал иммунологии . 43 (2): 303–313. doi : 10.1002/eji.201242896 . PMID 23280392 . S2CID 677081 .
- ^ Avril T, Floyd H, Lopez F, Vivier E, Crocker PR (декабрь 2004 г.). «Мембрано-проксимальный иммунорецептор тирозин ингибирующий мотив является критическим для ингибирующей передачи сигналов, опосредованной Siglecs-7 и -9, связанные с CD33 SIGLEC, экспрессируемыми на моноцитах человека и NK-клетках» . Журнал иммунологии . 173 (11): 6841–9. doi : 10.4049/jimmunol.173.11.6841 . PMID 15557178 .
- ^ Nitschke L, Carsetti R, Ocker B, Köhler G, Lamers MC (февраль 1997 г.). «CD22 является отрицательным регулятором передачи сигналов рецептора B-клеток» . Текущая биология . 7 (2): 133–43. Bibcode : 1997cbio .... 7..133n . doi : 10.1016/s0960-9822 (06) 00057-1 . PMID 9016707 .
- ^ Nitschke L, Tsubata T (октябрь 2004 г.). «Молекулярные взаимодействия регулируют ингибирование сигнала BCR CD22 и CD72». Тенденции в иммунологии . 25 (10): 543–50. doi : 10.1016/j.it.2004.08.002 . PMID 15364057 .
- ^ Jump up to: а беременный в дюймовый Ангата Т., Хаякава Т., Яманака М., Варки А., Накамура М (октябрь 2006 г.). «Открытие Siglec-14, нового рецептора сиаловой кислоты, перенесшего согласованную эволюцию с Siglec-5 у приматов» . FASEB Journal . 20 (12): 1964–73. doi : 10.1096/fj.06-5800com . PMID 17012248 . S2CID 13740587 .
- ^ Джонс С., Вирджи М., Крокер П.Р. (сентябрь 2003 г.). «Распознавание сиалитированного менингококкового липополисахарида сиглеками, экспрессируемыми на миелоидных клетках, приводит к усилению бактериального поглощения». Молекулярная микробиология . 49 (5): 1213–25. doi : 10.1046/j.1365-2958.2003.03634.x . PMID 12940982 . S2CID 22620398 .
- ^ Аврил Т., Вагнер Э.Р., Уиллисон Х.Дж., Крокер Пар (июль 2006 г.). «Связывание сиаловой кислоты иммуноглобулиноподобного лектина 7 опосредует селективное распознавание сиалированных гликанов, экспрессируемых на липоолигосахаридах Campylobacter jejuni» . Инфекция и иммунитет . 74 (7): 4133–41. doi : 10.1128/iai.02094-05 . PMC 1489752 . PMID 16790787 .
- ^ Уокер JA, Smith KG (март 2008 г.). «CD22: ингибирующая загадка» . Иммунология . 123 (3): 314–25. doi : 10.1111/j.1365-2567.2007.02752.x . PMC 2433339 . PMID 18067554 .
- ^ Тейлор я, Дрикамер К. (2011). «Глава 12: Гликобиология и развитие». Введение в гликобиологию (3 -е изд.). Издательство Оксфордского университета . С. 228–235. ISBN 978-0-19-956911-3 .
- ^ Рази Н., Варки А (ноябрь 1999 г.). «Загадочная сиаловая кислота, связывающие лектины по лейкоцитам крови человека, могут быть разоблачены обработкой сиалидазы или клеточной активацией» . Гликобиология . 9 (11): 1225–34. doi : 10.1093/glycob/9.11.1225 . PMID 10536038 .
- ^ Jump up to: а беременный Митра Н., Банда К., Алтеид Т.К., Шаффер Л., Джонсон-Пейс Т.Л., Бетен Дж., Лич Р.Дж., Ангата Т., Варки Н., Варки А (июль 2011 г.). «Siglec12, специфичный для человека ген сегрегации (псевдо), кодирует сигнальную молекулу, экспрессируемую в раке предстательной железы» . Журнал биологической химии . 286 (26): 23003–11. doi : 10.1074/jbc.m111.244152 . PMC 3123068 . PMID 215555517 .
- ^ Jump up to: а беременный Wang X, Mitra N, Secudino I, Band K, Cruz P, Padler-Kavavani V, Verhagen A, Reid C, Lari M, Rizzi E, Balsam C, Corti G, De Bellis, Songggs W, Caramelli D, Tishkoff SA, Hakayakawa T, Green Ed, Mullikin JC, Nizet V, Bui J, Varki A (июнь 2012 г.). «Специфическая инактивация двух иммунодулирующих генов сиглека в эволюции человека » Труды Национальной академии наук Соединенных Штатов Америки 109 (25): 9935–4 Bibcode : 2012pnas..109.9 Doi : 10.1073/pnas.1119459109 . PMC 338253 PMID 22665810
- ^ Камеда, Юсуке; Такахата, Массиан; Запятая, Мики; Микуни, Шунтаро; Хейтайма, Шигегетсугу; Shimizu, Tomohiro; Ангата, Такаши; Кинджо, Масатака; мой, Акио; Ивасаки, Норимаса (декабрь 2013 г.). InddidDylinoSitol 3-Kase/AKT и ERK в связи с сигнальным адаптером DAP1 «Сиглек-15 регулирует различие остеокластов путем модуляции путей RANKL - Журнал исследований костей и минералов 28 (12): 2463–2 Doi : 10.1002/ jbmr.1 PMID 236777868 S2CID 36545506 .
- ^ Ангата, т; Табучи, y; Накамура, К (август 2007 г.). «Siglec-15: иммунная система Siglec, сохранившаяся во всей эволюции позвоночных» . Гликобиология . 17 (8): 838–46. doi : 10.1093/glycob/cwm049 . PMID 17483134 .
- ^ Jump up to: а беременный Ангата Т., Табучи Ю., Накамура К., Накамура М (август 2007 г.). «Siglec-15: иммунная система Siglec, сохранившаяся во всей эволюции позвоночных» . Гликобиология . 17 (8): 838–46. doi : 10.1093/glycob/cwm049 . PMID 17483134 .
- ^ Cao H, Lakner U, De Bono B, Traherne JA, Trowsdale J, Barrow AD (август 2008 г.). «SIGLEC16 кодирует рецептор, связанный с DAP12, экспрессируемый в макрофагах, которые развивались из его ингибирующего аналога SIGLEC11 и имеют функциональные и нефункциональные аллели у людей» . Европейский журнал иммунологии . 38 (8): 2303–15. doi : 10.1002/eji.200738078 . PMID 18629938 .
- ^ Ван Рис DJ, Szilagyi K, Kuijpers TW, Matlung HL, Van Den Berg TK (апрель 2016 г.). «Иммунорецепторы на нейтрофилах» . Семинары по иммунологии . 28 (2): 94–108. Doi : 10.1016/j.smim.2016.02.004 . PMC 7129252 . PMID 26976825 .
- ^ Martinez-Picado J, McLaren PJ, Telenti A, Izquierdo-Useros N (2017-11-21). «Ретровирусы как миелоидные клетки: что естественные человеческие Siglec-1« нокауты »рассказывают нам о патогенезе» . Границы в иммунологии . 8 : 1593. DOI : 10.3389/fimmu.2017.01593 . PMC 5702442 . PMID 29209326 .
- ^ Surolia I, Pirnie SP, Chellappa V, Taylor KN, Cariappa A, Moya J, Liu H, Bell DW, Driscoll DR, Deerichs S, Haider K, Netravali I, Le S, Elia R, Dow E, Lee A, Freudenberg J , De Jager PL, Chretien Y, Varki A, Macdonald ME, Gillis T, Behrens TW, Bloch D, Collier D, Korzenik J, Podolsky DK, Hafler D, Murali M, Sands B, Stone JH, Gregersen PK, Pillai S ( Июль 2010). «Функционально дефектные варианты зародышевой линии ацетилэстеразы сиалиновой кислоты в аутоиммунитете» . Природа . 466 (7303): 243–7. Bibcode : 2010natur.466..243s . doi : 10.1038/nature09115 . PMC 2900412 . PMID 20555325 .
- ^ Chen W, Han C, Xie B, Hu X, Yu Q, Shi L, Wang Q, Li D, Wang J, Zheng P, Liu Y, Cao X (январь 2013). «Индукция siglec-g вирусами РНК ингибирует врожденный иммунный ответ, способствуя деградации RIG-I» . Клетка . 152 (3): 467–78. doi : 10.1016/j.cell.2013.01.011 . PMID 23374343 .
- ^ Nitschke L (сентябрь 2014 г.). «CD22 и SIGLEC-G регулируют ингибирование сигналов B-клеток с помощью лиганда сиаловой кислоты, связывающего лиганда и контроля B-клерусную толерантность» (PDF) . Гликобиология . 24 (9): 807–17. doi : 10.1093/glycob/cwu066 . PMID 25002414 .
- ^ Jump up to: а беременный Schwarz F, Fong JJ, Varki A (2015). «Специфичные для человека эволюционные изменения в биологии сиглеков». Биохимические роли макромолекул эукариотической клеточной поверхности . Достижения в области экспериментальной медицины и биологии. Тол. 842. Springer, Cham. С. 1–16. doi : 10.1007/978-3-319-11280-0_1 . ISBN 9783319112794 Полем PMID 25408333 .
- ^ Jump up to: а беременный Варки А (сентябрь 2017 г.). «Люди подвержены аутоиммунитету? Последствия эволюционных изменений в биологии гомининовой кислоты». Журнал аутоиммунитета . 83 : 134–142. doi : 10.1016/j.jaut.2017.07.011 . PMID 28755952 .
- ^ Jump up to: а беременный в дюймовый и фон глин час Büll C, Heise T, Adema GJ, Boltje TJ (июнь 2016 г.). «Миметика сиаловой кислоты для нацеливания оси сиаловой кислоты-сиглека». Тенденции в биохимических науках . 41 (6): 519–531. doi : 10.1016/j.tibs.2016.03.007 . HDL : 2066/166259 . PMID 27085506 .
- ^ Ангата Т., Ничолат С.М., Макоули М.С. (октябрь 2015). «Терапевтическое нацеливание на сиглеки с использованием подходов на основе антител и гликана» . Тенденции в фармакологических науках . 36 (10): 645–660. doi : 10.1016/j.tips.2015.06.008 . PMC 4593978 . PMID 26435210 .
- ^ Hudak Je, Bertozzi CR (январь 2014 г.). «Гликотерапия: новые достижения вдохновляют возрождение гликанов в медицине» . Химия и биология . 21 (1): 16–37. doi : 10.1016/j.chembiol.2013.09.010 . PMC 4111574 . PMID 24269151 .
- ^ Mesch S, Lemme K, Wittwer M, Koliwer-Brandl H, Schwardt O, Kelm S, Ernst B (январь 2012 г.). «От библиотеки маг -антагонистов до наномолярных лигандов CD22». Chemmedchem . 7 (1): 134–43. doi : 10.1002/cmdc.201100407 . PMID 21990163 . S2CID 28028027 .
- ^ Риллахан CD, Schwartz E, Rademacher C, McBride R, Rangarajan J, Fokin VV, Paulson JC (июль 2013 г.). «Синтез и скрининг библиотеки сиалосида дает высокий аффинный лиганд для Siglec-7» . ACS Химическая биология . 8 (7): 1417–22. doi : 10.1021/cb400125w . PMC 3751994 . PMID 23597400 .
- ^ Chen WC, Kawasaki N, Nycholat CM, Han S, Pilotte J, Crocker PR, Paulson JC (2012-06-19). «Доставка антигена в макрофаги с использованием липосомальных наночастиц, нацеленных на сиалоадгезин/CD169» . Plos один . 7 (6): E39039. BIBCODE : 2012PLOSO ... 739039C . doi : 10.1371/journal.pone.0039039 . PMC 3378521 . PMID 22723922 .
- ^ Büll C, Heise T, Beurskens DM, Riersma M, Ashikov A, Rutjes FP, Van Copelt TH, Lefeber DJ, Den Brk MH, Adema GJ, Boltje TJ (октябрь 2015). «Гликоэгенерирование сиаловой кислоты с использованием неестественной сиаловой кислоты для обнаружения дефектов биосинтеия сиааалогикана и синтеза сиглека лигандов сиглека» ACS Химическая биология 10 (10): 2353–6 Doi : 10.1021/ acschembio.5b000501 HDL : 2066/152725 26258433PMID
Внешние ссылки
[ редактировать ]- Функциональный гликомический шлюз , сотрудничество между консорциумом для функциональной гликомики и издательской группы природы
- Исследования лектинов I-типа (SIGLECS), проведенные в Имперском колледже Лондон, предоставляя еще один обзор лектинов I-типа