Sacubitril/Valsartan
 | |
| Комбинация | |
|---|---|
| Сакубитрил | Neprilysin inhibitor |
| Вальсартан | Антагонист рецептора ангиотензина II |
| Клинические данные | |
| Торговые названия | Энтересто, Азмарда, Непарвис, другие |
| Другие имена | LCZ696 |
| AHFS / Drugs.com | Монография |
| MedlinePlus | A615039 |
| Данные лицензии | |
| Беременность категория |
|
| Маршруты администрация | Уст в уст |
| Код ATC | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| PubChem CID | |
| НЕКОТОРЫЙ | |
| Кегг | |
| Comptox Dashboard ( EPA ) | |
| Химические и физические данные | |
| Формула | C 96 H 120 N 12 NA 6 O 21 |
| Молярная масса | 1 916 .018 g·mol −1 |
| 3D model ( JSmol ) | |
Sacubitril/Valsartan , проданный под брендом Enteresto, фиксированной дозы среди других, представляет собой комбинированное лекарство от для использования при сердечной недостаточности . Он состоит из ингибитора неприлизина Sacubitril и блокатора рецептора ангиотензина Валсартана . Комбинация иногда описывается как «ингибитор ангиотензинного рецептора-неприлизина» (ARNI). [ 9 ] В 2016 году Целевая группа Американского колледжа кардиологии/Американской кардиологической ассоциации рекомендовала ее в качестве замены ингибитора ACE или блокатора рецепторов ангиотензина у людей с сердечной недостаточностью с уменьшенной фракцией выброса . [ 10 ]
Потенциальные побочные эффекты включают в себя ангионевротическую оценку , нефротоксичность и низкое кровяное давление . [ 10 ]
Он был утвержден для медицинского использования в Соединенных Штатах и в Европейском союзе в 2015 году, [ 11 ] [ 12 ] [ 13 ] [ 7 ] и в Австралии в 2016 году. [ 1 ] В 2021 году в Соединенных Штатах было 189 -м наиболее часто назначаемым лекарством с более чем 2 миллионами рецептов. [ 14 ] [ 15 ] Это доступно как общее лекарство . [ 16 ]
Медицинское использование
[ редактировать ]Sacubitril/Valsartan можно использовать вместо ингибитора ACE или блокатора рецептора ангиотензина у людей с сердечной недостаточностью и уменьшенной фракцией выброса левого желудочка (LVEF), [ 17 ] [ 9 ] Наряду с другими стандартными методами терапии (например, бета-блокаторы ) для сердечной недостаточности. [ 10 ] [ 11 ] [ 18 ] Чтобы исследовать его использование для сердечной недостаточности у тех, у кого сохранившийся LVEF (HFPEF), Novartis финансировал исследование Paragon-HF, которое было предназначено для исследования использования Sacubitril/Valsartan при лечении пациентов с HFPEF с LVEF 45% или более. Завершая в 2019 году, он не продемонстрировал значимость для снижения госпитализации, связанной с сердечной недостаточностью или снижением смерти по сердечно -сосудистым причинам, и, следовательно, показал ограниченную пользу для тех, у кого HFPEF. [ 19 ] Кокрановский систематический обзор данных из 37 испытаний, исследующих методы лечения HFPEF, предположил, что в настоящее время не хватает доказательств для поддержки использования ингибиторов АПФ, ARB или Arnis у пациентов с HFPEF, и что фармакологическая терапия HFPEF остается лечением, и что основная фармакологическая терапия для HFPEF остается лечением, и что основная фармакологическая терапия для HFPEF остается лечением, и что основная фармакологическая терапия для HFPEF остается лечением, и что основная фармакологическая терапия для HFPEF остается лечением, и что основная фармакологическая терапия для HFPEF остается лечением, и что основная фармакологическая терапия для HFPEF остается лечением, и что основная фармакологическая терапия для HFPEF остается лечением, и что фармакологическая терапия HFPEF остается сопутствующих заболеваний, таких как гипертония или другие триггеры для декомпенсации. [ 20 ] [ нуждается в обновлении ] Пациенты, которые проявляют симптомы сердечной недостаточности NYHA II или III и все еще являются симптомами, несмотря на максимально переносимую дозу ингибитора ACE или только ARB, могут быть рассмотрены для двойной терапии Sacubitril/Valsartan, чтобы снизить риск сердечно-сосудистых заболеваний и смертности от всеобщего обстоятельства. Полем [ 21 ] Пособия по смертности наблюдались только на сегодняшний день у людей с LVEF менее 35%. [ 19 ] [ 21 ]
Неблагоприятные эффекты
[ редактировать ]Обычные побочные эффекты [> 1%] включают гиперкалиемию [высокие уровни калия в крови, известный побочный эффект валсартана], гипотония [низкое кровяное давление, распространенное у вазодилататоров и уменьшение объема внеклеточного жидкости], постоянный сухой кашель и нарушение почек [ Снижение функции почек]. [ 21 ] [ 19 ] [ 22 ]
У некоторых пациентов может возникнуть ангионевровая отек, редкая, но более серьезная реакция, и включает отек лица и губ. [ 21 ] [ 19 ] [ 22 ] Ангионевротическое образование чаще встречается у чернокожих (афроамериканцев) пациентов. [ 21 ] Sacubitril/Valsartan не следует принимать в течение 36 часов после ингибитора ангиотензинного фермента, чтобы снизить риск развития ангионевротического образования. [ 21 ]
Профиль побочного эффекта в испытаниях сакубитрила/валсартана по сравнению с одним вальсартаном или эналаприлом [ингибитор ангиотензина, преобразующий фермент), очень похожа, а частота гипотонии немного выше у сакубитрила/валсартана, риск, сопоставимый для ангиорезиации, и вероятность гиперкалемии, риск, сопоставимый для ангиотезмом, и вероятность гиперкалемии. Почечная нарушение и кашель немного ниже. [ 21 ] [ 19 ] [ 22 ]
Sacubitril/Valsartan противопоказан при беременности, потому что он содержит валсартан, известный риск врожденных дефектов. [ 6 ]
Pharmacology
[edit]Valsartan blocks the angiotensin II receptor type 1 (AT1). This receptor is found on both vascular smooth muscle cells, and on the zona glomerulosa cells of the adrenal gland which are responsible for aldosterone secretion. In the absence of AT1 blockade, angiotensin causes both direct vasoconstriction and adrenal aldosterone secretion, the aldosterone then acting on the distal tubular cells of the kidney to promote sodium reabsorption which expands extracellular fluid (ECF) volume. Blockade of (AT1) thus causes blood vessel dilation and reduction of ECF volume.[23][24]
Sacubitril is a prodrug that is activated to sacubitrilat (LBQ657) by de-ethylation via esterases.[25] Sacubitrilat inhibits the enzyme neprilysin,[26] a neutral endopeptidase that degrades vasoactive peptides, including natriuretic peptides, bradykinin, and adrenomedullin. Thus, sacubitril increases the levels of these peptides, causing blood vessel dilation and reduction of ECF volume via sodium excretion.[27]
Despite these actions, neprilysin inhibitors have been found to have limited efficacy in the treatment of hypertension and heart failure when taken on their own.[28][29] This is attributed to a reduction in enzymatic breakdown of angiotensin II by the reduction of neprilysin activity, which results in an increase in systemic angiotensin II levels and the negation of the positive effects of this drug family in cardiovascular disease treatment.[29] Combined treatment with a neprilysin inhibitor and an angiotensin converting enzyme (ACE) inhibitor has been shown to be effective in reducing angiotensin II levels, and demonstrated superiority in lowering blood pressure compared to ACE inhibition alone.[30] However, due to an increase in bradykinins from the inhibition of both ACE and neprilysin, there was a threefold increase in relative risk of angioedema compared with ACE inhibition alone following this combination treatment.[30] The combination of a neprilysin inhibitor with an angiotensin receptor blocker instead of the ACE inhibitor has been shown to have a comparable risk of angioedema, whilst also demonstrating superiority in treating moderate-severe heart failure to ACE inhibitor treatment.[18][22]
Neprilysin also has a role in clearing the protein amyloid beta from the cerebrospinal fluid, and its inhibition by sacubitril has shown increased levels of AB1-38 in healthy subjects (Entresto 194/206 for two weeks). Amyloid beta is considered to contribute to the development of Alzheimer's disease, and there exist concerns that sacubitril may promote the development of Alzheimer's disease.[6][31]
Structure activity relationship
[edit]Sacubitril is the molecule that is metabolically activated by de-ethylation by esterases. The active form of the molecule, sacubitrilat, is responsible for the molecule's drug lowering effects.[32]
Chemistry
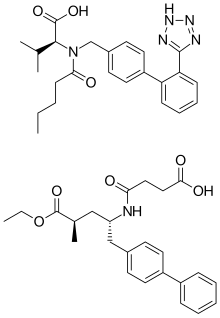
[edit]Sacubitril/valsartan is co-crystallized sacubitril and valsartan, in a one-to-one molar ratio. One sacubitril/valsartan complex consists of six sacubitril anions, six valsartan dianions, 18 sodium cations, and 15 molecules of water, resulting in the molecular formula C288H330N36Na18O48·15H2O and a molecular mass of 5748.03 g/mol.[33][34]
The substance is a white powder consisting of thin hexagonal plates. It is stable in solid form as well as in aqueous (water) solution with a pH of 5 to 7, and has a melting point of about 138 °C (280 °F).[34]
History
[edit]During its development by Novartis, Entresto was known as LCZ696.[9] It was approved under the FDA's priority review process on 7 July 2015.[11] It was also approved in Europe in 2015.[7] In 2022, Novartis sold its India marketing rights of Sacubitril Valsartan to JB Pharma, under the brand name Azmarda.[35]
Society and culture
[edit]Trial design
[edit]There was controversy over the PARADIGM-HF trial—the Phase III trial on the basis of which the drug was approved by the FDA. For example, both Richard Lehman, a physician who writes a weekly review of key medical articles for the BMJ Blog and a December 2015, report from the Institute for Clinical and Economic Review (ICER) found that the risk–benefit ratio was not adequately determined because the design of the clinical trial was too artificial and did not reflect people with heart failure that doctors usually encounter.[36]: 28 [37] In 2019, the PIONEER-HF and PARAGON-HF trials studied the effect of sacubitril/valsartan in 800 patients recently hospitalised with severe heart failure and 4800 patients with less severe symptoms of heart failure respectively.[22][19] The medication consistently demonstrated similar levels of safety, with higher rates of very low blood pressure, compared to current treatments across all three trials in a variety of patients, however it has only shown effectiveness in those with more advanced heart failure.[21][19][22] In December 2015, Steven Nissen and other thought leaders in cardiology said that the approval of sacubitril/valsartan had the greatest impact on clinical practice in cardiology in 2015, and Nissen called the drug "truly a breakthrough approach."[38]
One 2015 review stated that sacubitril/valsartan represents "an advancement in the chronic treatment of heart failure with reduced ejection fraction" but that widespread clinical success with the drug will require taking care to use it in appropriate patients, specifically those with characteristics similar to those in the clinical trial population.[39] Another 2015 review called the reductions in mortality and hospitalization conferred by sacubitril/valsartan "striking", but noted that its effects in heart failure people with hypertension, diabetes, chronic kidney disease, and the elderly needed to be evaluated further.[40]
Economics
[edit]The wholesale cost to the National Health Service (NHS) in the UK is approximately £1,200 per person per year as of 2017.[41]
The wholesale cost in the United States is US$4,560 per year as of 2015[update].[36] One industry-funded analysis found a cost of US$45,017 per quality-adjusted life year (QALY).[42]
Similar class generic drugs without sacubitril, such as valsartan alone, cost approximately US$48 a year.[43]
Research
[edit]The PARADIGM-HF trial (in which Milton Packer was one of the principal investigators) compared treatment with sacubitril/valsartan to treatment with enalapril.[44] People with heart failure and reduced LVEF (10,513) were sequentially treated on a short-term basis with enalapril and then with sacubitril/valsartan. Those that were able to tolerate both regimens (8442, 80%) were randomly assigned to long-term treatment with either enalapril or sacubitril/valsartan. Participants were mainly white (66%), male (78%), middle aged (median 63.8 +/- 11 years) with NYHA stage II (71.6%) or stage III (23.1%) heart failure.[45]
The trial was stopped early after a prespecified interim analysis revealed a reduction in the primary endpoint of cardiovascular death or heart failure in the sacubitril/valsartan group relative to those treated with enalapril. Taken individually, the reductions in cardiovascular death and heart failure hospitalizations retained statistical significance.[18] Relative to enalapril, sacubitril/valsartan provided reductions[45][46] in:
- the composite endpoint of cardiovascular death or hospitalization for heart failure (incidence 21.8% vs 26.5%)
- cardiovascular death (incidence 13.3% vs 16.5%)
- first hospitalization for worsening heart failure (incidence 12.8% vs 15.6%), and
- all-cause mortality (incidence 17.0% vs 19.8%)
Limitations of the trial include scarce experience with initiation of therapy in hospitalized patients and in those with NYHA heart failure class IV symptoms.[47][48] Additionally the trial compared a maximal dose of valsartan (plus sacubitril) with a sub-maximal dose of enalapril, and was thus not directly comparable with current gold-standard use of ACE inhibitors in heart failure, diminishing the validity of the trial results.[49][50]
References
[edit]- ^ Jump up to: a b c "Entresto 24/26 tablets, Entresto 49/51 tablets, Entresto 97/103 tablets (sacubitril/valsartan) Product Information". Therapeutic Goods Administration (TGA). Novartis. Archived from the original on 11 November 2020. Retrieved 21 September 2020.
- ^ "Prescription medicines: registration of new chemical entities in Australia, 2016". Therapeutic Goods Administration (TGA). 21 June 2022. Archived from the original on 10 April 2023. Retrieved 10 April 2023.
- ^ AusPAR for sacubitril / valsartan salt complex (PDF) (Report). Therapeutic Goods Administration (TGA). September 2016.
- ^ "Health Canada New Drug Authorizations: 2015 Highlights". Health Canada. 4 May 2016. Retrieved 7 April 2024.
- ^ "Entresto 24 mg/26 mg film-coated tablets - Summary of Product Characteristics (SmPC)". (emc). Archived from the original on 24 January 2021. Retrieved 21 September 2020.
- ^ Jump up to: a b c "Entresto- sacubitril and valsartan tablet, film coated". DailyMed. 14 June 2020. Archived from the original on 19 April 2020. Retrieved 21 September 2020.
- ^ Jump up to: a b c "Entresto EPAR". European Medicines Agency (EMA). 17 September 2018. Archived from the original on 27 February 2021. Retrieved 21 September 2020.
- ^ "Neparvis EPAR". European Medicines Agency (EMA). 17 September 2018. Archived from the original on 28 December 2020. Retrieved 23 September 2020.
- ^ Jump up to: a b c Hubers SA, Brown NJ (March 2016). "Combined Angiotensin Receptor Antagonism and Neprilysin Inhibition". Circulation. 133 (11): 1115–1124. doi:10.1161/CIRCULATIONAHA.115.018622. PMC 4800749. PMID 26976916.
- ^ Jump up to: a b c Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Colvin MM, et al. (September 2016). "2016 ACC/AHA/HFSA Focused Update on New Pharmacological Therapy for Heart Failure: An Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America". Circulation. 134 (13): e282–e293. doi:10.1161/CIR.0000000000000435. PMID 27208050.
{{cite journal}}: CS1 maint: overridden setting (link) - ^ Jump up to: a b c "FDA approves new drug to treat heart failure" (Press release). U.S. Food and Drug Administration (FDA). 7 July 2015. Archived from the original on 26 January 2018.
- ^ "Entresto (sacubitril/valsartan) Tablets". U.S. Food and Drug Administration (FDA). 14 August 2015. Archived from the original on 31 March 2021. Retrieved 22 September 2020.
- ^ Thompson A (12 June 2015). Summary review of LCZ696, a fixed-dose combination of valsartan and sacubitril (PDF) (Report). Center for Drug Evaluation and Research. 207620Orig1s000. Partially redacted.
- ^ "The Top 300 of 2021". ClinCalc. Archived from the original on 15 January 2024. Retrieved 14 January 2024.
- ^ "Sacubitril; Valsartan - Drug Usage Statistics". ClinCalc. Retrieved 14 January 2024.
- ^ "FDA Roundup: May 31, 2024". U.S. Food and Drug Administration (FDA) (Press release). 31 May 2024. Retrieved 31 May 2024.
 This article incorporates text from this source, which is in the public domain.
This article incorporates text from this source, which is in the public domain.
- ^ Chang HY, Chen KC, Fong MC, Feng AN, Fu HN, Huang KC, et al. (March 2020). "Recovery of left ventricular dysfunction after sacubitril/valsartan: predictors and management". Journal of Cardiology. 75 (3): 233–241. doi:10.1016/j.jjcc.2019.08.005. PMID 31563433.
{{cite journal}}: CS1 maint: overridden setting (link) - ^ Jump up to: a b c McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, et al. (September 2014). "Angiotensin-neprilysin inhibition versus enalapril in heart failure". The New England Journal of Medicine. 371 (11): 993–1004. doi:10.1056/NEJMoa1409077. hdl:2336/552372. PMID 25176015. S2CID 11383.
{{cite journal}}: CS1 maint: overridden setting (link) - ^ Jump up to: a b c d e f g Solomon SD, McMurray JJ, Anand IS, Ge J, Lam CS, Maggioni AP, et al. (October 2019). "Angiotensin-Neprilysin Inhibition in Heart Failure with Preserved Ejection Fraction". The New England Journal of Medicine. 381 (17): 1609–1620. doi:10.1056/NEJMoa1908655. hdl:2445/175935. PMID 31475794.
{{cite journal}}: CS1 maint: overridden setting (link) - ^ Martin N, Manoharan K, Thomas J, Davies C, Lumbers RT (June 2018). "Beta-blockers and inhibitors of the renin-angiotensin aldosterone system for chronic heart failure with preserved ejection fraction". The Cochrane Database of Systematic Reviews. 6 (6): CD012721. doi:10.1002/14651858.CD012721.pub2. PMC 6513293. PMID 29952095.
- ^ Jump up to: a b c d e f g h McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, et al. (September 2014). "Angiotensin-neprilysin inhibition versus enalapril in heart failure". The New England Journal of Medicine. 371 (11): 993–1004. doi:10.1056/NEJMoa1409077. hdl:2336/552372. PMID 25176015. S2CID 11383.
{{cite journal}}: CS1 maint: overridden setting (link) - ^ Jump up to: a b c d e f Velazquez EJ, Morrow DA, DeVore AD, Duffy CI, Ambrosy AP, McCague K, et al. (February 2019). "Angiotensin-Neprilysin Inhibition in Acute Decompensated Heart Failure". The New England Journal of Medicine. 380 (6): 539–548. doi:10.1056/NEJMoa1812851. PMID 30415601. S2CID 53280900.
{{cite journal}}: CS1 maint: overridden setting (link) - ^ Mutschler E, Schäfer-Korting M (2001). Arzneimittelwirkungen (in German) (8 ed.). Stuttgart: Wissenschaftliche Verlagsgesellschaft. p. 579. ISBN 978-3-8047-1763-3.
{{cite book}}: CS1 maint: overridden setting (link) - ^ Zouein FA, de Castro Brás LE, da Costa DV, Lindsey ML, Kurdi M, Booz GW (July 2013). "Heart failure with preserved ejection fraction: emerging drug strategies". Journal of Cardiovascular Pharmacology. 62 (1): 13–21. doi:10.1097/FJC.0b013e31829a4e61. PMC 3724214. PMID 23714774.
- ^ Solomon SD. "HFpEF in the Future: New Diagnostic Techniques and Treatments in the Pipeline". Boston. p. 48. Archived from the original on 12 September 2014. Retrieved 26 January 2012.
- ^ Gu J, Noe A, Chandra P, Al-Fayoumi S, Ligueros-Saylan M, Sarangapani R, et al. (April 2010). "Pharmacokinetics and pharmacodynamics of LCZ696, a novel dual-acting angiotensin receptor-neprilysin inhibitor (ARNi)". Journal of Clinical Pharmacology. 50 (4): 401–414. doi:10.1177/0091270009343932. PMID 19934029. S2CID 24853279.
{{cite journal}}: CS1 maint: overridden setting (link) - ^ Schubert-Zsilavecz M, Wurglics M. "Neue Arzneimittel 2010/2011" (in German).
- ^ Беван Э.Г., Коннелл Дж. М., Дойл Дж., Кармайкл Х.А., Дэвис Д.Л., Лоример А.Р. и др. (Июль 1992). «Каноксатрил, нейтральный ингибитор эндопептидазы: эффективность и переносимость при важнейшей гипертонии». Журнал гипертонии . 10 (7): 607–613. doi : 10.1097/00004872-199207000-00002 . PMID 1321186 . S2CID 23507064 .
- ^ Jump up to: а беременный Ричардс А.М., Виттерт Г.А., Крозье И.Г., Эспинер Е.А., Яндл Т.Г., Икрам Х. и др. (Апрель 1993 г.). «Хроническое ингибирование эндопептидазы 24.11 при необходимой гипертонии: доказательства усиления натрийуретического пептида и ангиотензина II». Журнал гипертонии . 11 (4): 407–416. doi : 10.1097/00004872-199304000-00011 . PMID 8390508 . S2CID 25333484 .
- ^ Jump up to: а беременный Kostis JB, Packer M, Black HR, Schmieder R, Henry D, Levy E (февраль 2004 г.). «Omapatrilat и Enalapril у пациентов с гипертонией: сердечно -сосудистое лечение Omapatrilat против исследования Enalapril (октав)» . Американский журнал гипертонии . 17 (2): 103–111. doi : 10.1016/j.amjhyper.2003.09.014 . PMID 14751650 .
- ^ Patel N, Gluck J (июль 2017 г.). "Подходит ли для мозга?" Полем Всемирный журнал кардиологии . 9 (7): 594–599. doi : 10.4330/wjc.v9.i7.594 . PMC 5545143 . PMID 28824789 .
- ^ Абдин А., Шульц М., Ример У, Хадери Б., Вахтер Р., Лауфс У. и др. (Август 2022). «Sacubitril/Valsartan в сердечной недостаточности: эффективность и безопасность в клинических испытаниях и за ее пределами» . Сердце ESC терпит неудачу . 9 (6): 3737–3750. doi : 10.1002/ehf2.14097 . PMC 9773772 . PMID 35921043 .
- ^ Monge M, Lorthioir A, Bobrie G, Azizi M (декабрь 2013 г.). «Новая лекарственная терапия, мешающая системе ренин-ангиотензин-альдостерона для устойчивой гипертонии» . Журнал системы ренин-ангиотензин-альдостерона . 14 (4): 285–289. doi : 10.1177/1470320313513408 . PMID 24222656 .
- ^ Jump up to: а беременный Feng L, Karpinski PH, Sutton P, Liu Y, Hook Df, Hu B, et al. (2012). «LCZ696: супрамолекулярный комплекс натрия с двумя действиями». Тетраэдр буквы . 53 (3): 275–276. doi : 10.1016/j.tetlet.2011.11.029 .
{{cite journal}}: Cs1 maint: переопределенная настройка ( ссылка ) - ^ «Азмарда (Sacubitril valsartan): обзор, показания, клинические данные и дозировка» . Медицинские диалоги . 30 июня 2022 года. Архивировано с оригинала 5 июля 2022 года . Получено 30 июня 2022 года .
- ^ Jump up to: а беременный Ollendorf DA, Tarlochan Sandhu A, Chapman R, Heidenreich PA, Russo E, Shore KK, et al. (1 декабря 2015 г.). «Cardiomems HF System (St. Jude Medical, Inc.) и Sacubitril/Valsartan (Enteresto, Novartis AG) для управления застойной сердечной недостаточностью: эффективность, стоимость и контрольные показатели цены на основе стоимости: окончательный отчет» . 101672986. Архивировано с оригинала 29 августа 2021 года . Получено 4 октября 2019 года .
- ^ Обзор журнала Ричарда Лемана - 8 сентября 2014 года. NEJM 4 сентября 2014 года. Архивировано 16 мая 2021 года в The Wayback Machine Vol 371. BMJ, 8 сентября 2014 года.
- ^ Роджер Сергель для MedPage сегодня. 5 игр в кардиологии в 2015 году: Anteresto Archived 27 июня 2021 года на машине Wayback
- ^ MP Lillyblad (ноябрь 2015). «Двойной рецептор ангиотензина и ингибирование неприлизина с сакубитрилом/валсартаном при хронической систолической сердечной недостаточности: понимание новой парадигмы». Анналы фармакотерапии . 49 (11): 1237–1251. doi : 10.1177/1060028015593093 . PMID 26175499 . S2CID 28918702 .
- ^ Бавиши С., Мессерли Ф.Х., Кадош Б., Руилоп Л.М., Карио К (август 2015 г.). «Роль комбинаций ингибиторов неприлизина в гипертонии: понимание исследований гипертонии и сердечной недостаточности» . Европейский сердечный журнал . 36 (30): 1967–1973. doi : 10.1093/eurheartj/ehv142 . PMID 25898846 .
- ^ "Энтересто" . Майс . Архивировано из оригинала 5 августа 2017 года . Получено 25 июля 2017 года .
- ^ Gaziano TA, Fonarow GC, Claggett B, Chan WW, Deschaseaux-Voinet C, Turner SJ, et al. (Сентябрь 2016 г.). «Анализ экономической эффективности Sacubitril/Valsartan vs Enalapril у пациентов с сердечной недостаточностью и уменьшенной фракцией выброса» . Джама кардиология . 1 (6): 666–672. doi : 10.1001/jamacardio.2016.1747 . PMID 27438344 .
{{cite journal}}: Cs1 maint: переопределенная настройка ( ссылка ) - ^ Поллак A (30 августа 2014 г.). «Новый препарат Novartis, эффективный при лечении сердечной недостаточности» . New York Times . Архивировано из оригинала 5 мая 2021 года . Получено 3 марта 2017 года .
{{cite news}}: Cs1 maint: переопределенная настройка ( ссылка ) - ^ Husten L (31 марта 2014 г.). «Испытание Novartis было остановлено рано из -за значительного падения сердечно -сосудистой смертности» . Форбс . Архивировано из оригинала 24 июня 2021 года . Получено 6 августа 2017 года .
- ^ Jump up to: а беременный Кинг Дж. Б., Бресс А.П., Риз А.Д., Мангер Массачусетс (сентябрь 2015 г.). «Ингибирование неприлизин при сердечной недостаточности с уменьшенной фракцией выброса: клинический обзор». Фармакотерапия . 35 (9): 823–837. doi : 10.1002/phar.1629 . PMID 26406774 . S2CID 6363036 .
- ^ Дрешер К.С., Десаи как (3 марта 2017 г.). «Комбинированный препарат Sacubitril/Valsartan: 2 года спустя» . Американский колледж кардиологии. Архивировано из оригинала 24 июня 2021 года . Получено 20 июня 2019 года .
- ^ Havakuk O, Elkayam U (июль 2017 г.). «Ингибирование рецептора ангиотензина-неприлизина». Журнал сердечно -сосудистой фармакологии и терапии . 22 (4): 356–364. doi : 10.1177/1074248416683049 . PMID 28587583 . S2CID 4066142 .
- ^ Perez AL, Kittipibul V, Tang WH, Starling RC (июнь 2017 г.). «Пациенты, не соответствующие критериям регистрации Paradigm-HF, имеют право на Sacubitril/Valsartan на основе одобрения FDA: необходимость сокращения разрыва» . Jacc. Сердечная недостаточность . 5 (6): 460–463. doi : 10.1016/j.jchf.2017.03.007 . PMID 28571599 .
- ^ «Обзор журнала Ричарда Лемана - 8 сентября 2014 года» . BMJ . 8 сентября 2014 года. Архивировано с оригинала 11 февраля 2018 года . Получено 20 мая 2019 года .
- ^ Ahn R, Prasad V (декабрь 2018 г.). «Оправдывают ли ограничения в дизайне Paradigm-HF медленное поглощение реального мира Sacubitril/Valsartan (Entesto)?». Сердечно -сосудистые лекарства и терапия . 32 (6): 633–635. doi : 10.1007/s10557-018-6830-x . PMID 30232657 . S2CID 52298581 .