Электрофорез белков сыворотки
| Электрофорез белков сыворотки | |
|---|---|
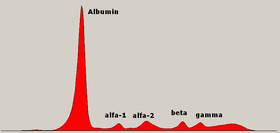 Диаграмма электрофореза нормальных белков сыворотки с обозначением различных зон. | |
| МеШ | D001797 |

Электрофорез белков сыворотки ( SPEP или SPE ) – это лабораторный тест, который исследует специфические белки в крови, называемые глобулинами . [ 1 ] Наиболее распространенными показаниями к электрофорезу белков сыворотки являются диагностика или мониторинг множественной миеломы , моноклональной гаммапатии неопределенного значения (MGUS) или дальнейшее исследование несоответствия между низким уровнем альбумина и относительно высоким уровнем общего белка. Необъяснимая боль в костях, анемия, протеинурия , хроническое заболевание почек и гиперкальциемия также являются признаками множественной миеломы и показаниями к ТПЭ. [ 2 ] кровь Сначала необходимо собрать , обычно в герметичный флакон или шприц . Электрофорез — это лабораторный метод, при котором сыворотка крови (жидкая часть крови после свертывания крови) наносится либо на ацетатную мембрану, пропитанную жидким буфером, либо на ацетатную мембрану, пропитанную жидким буфером. [ 3 ] или в матрицу забуференного агарозного геля , или в жидкость в капиллярной трубке и подвергают воздействию электрического тока для разделения белковых компонентов сыворотки на пять основных фракций по размеру и электрическому заряду: сывороточный альбумин , глобулины альфа-1 , глобулины альфа-2. , бета 1 и 2 глобулины и гамма глобулины .
Ацетатный или гель-электрофорез
[ редактировать ]Белки разделяются как электрическими силами, так и электроэндоосмотическими силами. Чистый заряд белка основан на сумме заряда его аминокислот и pH буфера. Белки наносят на твердую матрицу, такую как агарозный гель или мембрану из ацетата целлюлозы в жидком буфере, и подают электрический ток. Белки с отрицательным зарядом будут мигрировать к положительно заряженному аноду. Альбумин имеет наиболее отрицательный заряд и будет мигрировать дальше всего к аноду. Эндоосмотический поток – это движение жидкости к катоду, которое заставляет белки с более слабым зарядом двигаться назад от места нанесения. Гамма-белки в основном разделяются эндоосмотическими силами. [ 4 ] Рисунок электрофоретических полос, предоставленный лабораторией, может быть трудным для запоминания, и студенты-медики, ординаторы, медсестры и неспециализированные практикующие врачи могут найти визуальную мнемонику полезной для запоминания пяти основных полос и формы нормального электрофореза сыворотки. [ 5 ]

Капиллярный электрофорез
[ редактировать ]При капиллярном электрофорезе твердая матрица отсутствует. Белки разделяются преимущественно сильными электроэндосмотическими силами. Образец вводится в капилляр с отрицательным поверхностным зарядом. Прикладывается сильный ток, и отрицательно заряженные белки, такие как альбумин, пытаются двигаться к аноду. Жидкий буфер течет к катоду и увлекает за собой белки с более слабым зарядом. [ 6 ] [ 7 ]
Фракции сывороточного белка
[ редактировать ]
Альбумин
[ редактировать ]Альбумин является основной фракцией нормального СПЭП. Необходимо падение на 30%, прежде чем снижение покажет электрофорез. Обычно видна одна полоса. У гетерозиготных особей может наблюдаться бисальбуминемия – две одинаково окрашенные полосы, продукт двух генов. Некоторые варианты вызывают появление широкой полосы или двух полос различной интенсивности, но ни один из этих вариантов не связан с заболеванием. [ 8 ] Повышенная анодная подвижность обусловлена связыванием билирубина , неэтерифицированных жирных кислот , пенициллина и ацетилсалициловой кислоты , а иногда и триптическим расщеплением при остром панкреатите . [ нужна ссылка ]
Отсутствие альбумина, известное как анальбуминемия , встречается редко. Однако пониженный уровень альбумина часто встречается при многих заболеваниях, включая заболевания печени , недостаточность питания , мальабсорбцию, нефропатию с потерей белка и энтеропатию. [ 9 ]
Альбумин – интерзона альфа-1
[ редактировать ]Даже окрашивание в этой зоне обусловлено липопротеином альфа-1 ( липопротеином высокой плотности – ЛПВП). Снижение происходит при тяжелом воспалении, остром гепатите и циррозе печени . Также нефротический синдром может привести к снижению уровня альбумина; вследствие его потери с мочой через поврежденный непроницаемый клубочек . Увеличение наблюдается у тяжелых алкоголиков, а также у женщин во время беременности и в период полового созревания. [ нужна ссылка ]
Высокие уровни АФП , которые могут возникнуть при гепатоцеллюлярной карциноме, могут привести к появлению резкой полосы между альбумином и зоной альфа-1. [ нужна ссылка ]
Зона Альфа-1
[ редактировать ]Оросомукоид и антитрипсин мигрируют вместе, но оросомукоид плохо окрашивается, поэтому альфа-1-антитрипсин (ААТ) составляет большую часть полосы альфа-1. Альфа-1-антитрипсин имеет группу SG, и тиоловые соединения могут связываться с белком, изменяя их подвижность. Уменьшение полосы наблюдается в состоянии дефицита. Снижается при нефротическом синдроме. [ 10 ] и отсутствие может указывать на возможный дефицит альфа-1-антитрипсина. В конечном итоге это приводит к эмфиземе из-за нерегулируемой активности эластазы нейтрофилов в легочной ткани. Однако фракция альфа-1 не исчезает при дефиците альфа-1-антитрипсина, поскольку туда мигрируют и другие белки, включая альфа- липопротеин и оросомукоид. Как положительный реагент острой фазы, ААТ увеличивается при остром воспалении. [ нужна ссылка ]
Белок Бенс-Джонса может связываться с полосой альфа-1 и замедлять ее. [ нужна ссылка ]
Альфа-1 – межзонная альфа-2
[ редактировать ]Можно увидеть две слабые полосы, представляющие альфа-1-антхимотрипсин и связывающий витамин D. белок , Эти полосы сливаются и усиливаются на ранних стадиях воспаления из-за увеличения содержания альфа-1-антихимотрипсина, белка острой фазы . [ нужна ссылка ]
Зона Альфа-2
[ редактировать ]Эта зона состоит в основном из макроглобулина альфа-2 (АМГ или А2М) и гаптоглобина . Обычно наблюдаются низкие уровни гемолитической анемии (гаптоглобин представляет собой молекулу-самоубийцу, которая связывается со свободным гемоглобином, высвобождаемым из эритроцитов , и эти комплексы быстро удаляются фагоцитами ). Гаптоглобин повышается как часть реакции острой фазы, что приводит к типичному повышению зоны альфа-2 во время воспаления. Нормальная зона альфа-2 и повышенная зона альфа-1 являются типичной картиной при метастазах в печени и циррозе печени.
Комплексы гаптоглобин/гемоглобин мигрируют более катодно, чем гаптоглобин, как видно в интерзоне альфа-2-бета. Обычно это рассматривается как расширение зоны альфа-2.
Уровень макроглобулина альфа-2 может быть повышен у детей и пожилых людей. Это рассматривается как резкий фронт к полосе альфа-2. АМГ заметно повышается (в 10 раз и более) в сочетании с потерей клубочкового белка, как при нефротическом синдроме . Из-за своего большого размера АМГ не может проходить через клубочки, в то время как другие низкомолекулярные белки теряются. Усиленный синтез АМГ объясняет его абсолютное увеличение при нефротическом синдроме. Увеличение АМГ также отмечается у крыс без альбумина, что указывает на то, что это реакция на низкий уровень альбумина, а не сам нефротический синдром. [ 11 ]
АМГ слегка повышен на ранних стадиях диабетической нефропатии . [ нужна ссылка ]
Альфа-2 - бета-интерзона
[ редактировать ]Холодный нерастворимый глобулин образует здесь полосу, которая не видна в плазме , поскольку осаждается гепарином . Существуют низкие уровни при воспалении и высокие уровни при беременности. [ нужна ссылка ]
Бета-липопротеин образует в этой зоне неправильную зубчатую полосу. Высокие уровни наблюдаются при гиперхолестеринемии II типа , гипертриглицеридемии и нефротическом синдроме.
Бета-зона
[ редактировать ]Трансферрин и бета-липопротеин ( ЛПНП ) включают бета-1. Повышение уровня белка бета-1 за счет повышения уровня свободного трансферрина характерно для железодефицитной анемии , беременности и эстрогенами терапии . Увеличение белка бета-1 из-за повышения ЛПНП происходит при гиперхолестеринемии . Снижение уровня белка бета-1 происходит при остром или хроническом воспалении. [ нужна ссылка ]
Бета-2 содержит C3 ( белок комплемента 3). Он повышается в острой фазе реакции. Депрессия C3 возникает при аутоиммунных заболеваниях, когда активируется система комплемента, C3 связывается с иммунными комплексами и удаляется из сыворотки. Фибриноген, белок бета-2, обнаруживается в нормальной плазме, но отсутствует в нормальной сыворотке. Иногда кровь, взятая у гепаринизированных пациентов, не полностью свертывается, что приводит к появлению видимой полосы фибриногена между бета- и гамма-глобулинами. [ нужна ссылка ]
Бета-гамма интерзона
[ редактировать ]С-реактивный белок находится между бета- и гамма-зонами, обеспечивая слияние бета-гамма. IgA имеет наибольшую анодную подвижность и обычно мигрирует в области между бета- и гамма-зонами, что также вызывает слияние бета/гамма у пациентов с циррозом печени, респираторными инфекциями, кожными заболеваниями или ревматоидным артритом (повышение уровня IgA). Фибриноген в образцах плазмы будет виден в бета-гамма-области. Фибриноген, белок бета-2, обнаруживается в нормальной плазме, но отсутствует в нормальной сыворотке. Иногда кровь, взятая у гепаринизированных пациентов, не полностью свертывается, что приводит к появлению видимой полосы фибриногена между бета- и гамма-глобулинами. [ нужна ссылка ]
Гамма-зона
[ редактировать ]Иммуноглобулины антитела или . обычно являются единственными белками, присутствующими в нормальной гамма-области Следует отметить, что любой белок, мигрирующий в гамма-области, будет окрашен и появится на геле, что может включать белковые примеси, артефакты или определенные лекарства. В зависимости от того, используется ли агарозный или капиллярный метод, помехи различаются. Иммуноглобулины состоят из тяжелых цепей (μ, δ, γ, α и ε) и легких цепей (κ и λ). Нормальная гамма-зона должна выглядеть как гладкий «румянец» или размазывание без асимметрии или резких пиков. [ 12 ] Уровень гамма-глобулинов может быть повышен ( гипергаммаглобулинемия ), снижен ( гипогаммаглобулинемия ) или иметь аномальный пик или пики. Обратите внимание, что иммуноглобулины могут быть обнаружены и в других зонах; IgA обычно мигрирует в бета-гамма-зоне, и, в частности, патогенные иммуноглобулины могут мигрировать куда угодно, включая альфа-области. [ нужна ссылка ]
Гипогаммаглобулинемия легко определяется как «спад» или уменьшение гамма-зоны. У младенцев это нормально. Встречается у больных Х-сцепленной агаммаглобулинемией . Дефицит IgA встречается у 1:500 населения, о чем свидетельствует бледность гамма-зоны. Следует отметить, что гипогаммаглобулинема может наблюдаться на фоне MGUS или множественной миеломы. [ нужна ссылка ]
Если гамма-зона показывает увеличение, первым шагом в интерпретации является определение узкой или широкой области. Широкая «набухающая» форма (широкая) указывает на продукцию поликлонального иммуноглобулина. Если он повышен асимметрично или имеет один или несколько пиков или узкие «шипы», это может указывать на клональную продукцию одного или нескольких иммуноглобулинов. [ 13 ]
Поликлональная гаммапатия проявляется в виде «набухания» в гамма-зоне, что обычно указывает на неопухолевое состояние (хотя не является исключительным для неопухолевых состояний). Наиболее частыми причинами поликлональной гипергаммаглобулинемии, выявляемой с помощью электрофореза, являются тяжелые инфекции , хронические заболевания печени, ревматоидный артрит, системная красная волчанка и другие заболевания соединительной ткани. [ нужна ссылка ]
Узкий спайк указывает на моноклональную гаммапатию, также известную как ограниченная полоса или «М-спайк». Чтобы подтвердить, что ограниченная полоса представляет собой иммуноглобулин, контрольное тестирование с иммунофиксацией проводят или иммуносмещением/иммуносубтракцией (капиллярные методы). Терапевтические моноклональные антитела (mAb) также мигрируют в этой области и могут быть ошибочно истолкованы как моноклональная гаммапатия, а также могут быть идентифицированы с помощью иммунофиксации или иммуноперемещения/иммуносубтракции, поскольку они структурно сопоставимы с иммуноглобулинами человека. [ 14 ] Наиболее распространенной причиной ограниченного диапазона является MGUS (моноклональная гаммапатия неопределенного значения), которая, хотя и является необходимым предшественником, лишь изредка прогрессирует в множественную миелому. (В среднем 1% в год.) [ 15 ] Как правило, моноклональная гаммапатия имеет злокачественное или клональное происхождение, при этом миелома является наиболее распространенной причиной всплесков IgA и IgG . хронический лимфолейкоз и лимфосаркома не являются редкостью и обычно приводят к образованию IgM парапротеинов . Обратите внимание, что до 8% здоровых пожилых пациентов могут иметь моноклональный спайк. [ 16 ] Макроглобулинемия Вальденстрема (IgM), моноклональная гаммапатия неустановленного значения (MGUS), амилоидоз, плазмоклеточный лейкоз и одиночные плазмоцитомы также вызывают М-спайк.
На олигоклональную гаммапатию указывают наличие одного или нескольких отдельных клонов. [ нужна ссылка ]
Лизоцим можно рассматривать как катодную по отношению к гамма-зоне полосу при миеломоноцитарном лейкозе , при котором он высвобождается из опухолевых клеток. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Дженкинс, Маргарет А. (1999). «Электрофорез сывороточных белков». Клиническое применение капиллярного электрофореза . Методы молекулярной медицины. Том. 27. С. 11–20. дои : 10.1385/1-59259-689-4:11 . ISBN 1-59259-689-4 . ПМИД 21374283 .
- ^ Харрис, Нил С.; Винтер, Уильям Э. (2012). Множественная миелома и связанные с ней нарушения белков сыворотки: руководство по электрофорезу . Демос Медикал. п. 5. ISBN 978-1-933864-75-4 .
- ^ Каплан, А; Сэвори, Дж. (1965). «Оценка системы электрофореза ацетата целлюлозы для фракционирования белков сыворотки» . Клиническая химия . 11 (10): 937–42. дои : 10.1093/клинчем/11.10.937 . ПМИД 4158264 .
- ^ Харрис 2012 , стр. 9–16.
- ^ Медина-Де ла Гарса CE, Гарсия-Эрнандес М, Кастро-Корона Массачусетс. Визуальная мнемоника для электрофореза белков сыворотки https://www.tandfonline.com/doi/full/10.3402/meo.v18i0.22585
- ^ Харрис, 2012 г. и страницы 117–123 .
- ^ Керен, Дэвид Ф. (2003). Белковый электрофорез в клинической диагностике . Ходдер Арнольд. стр. 1–14. ISBN 0340-81213-3 .
- ^ Хоанг, Май П; Баскин, Лиланд Б; Вианс, Фрэнк Х (1999). «Бисальбуминурия у взрослых с бисальбуминемией и нефротическим синдромом». Клиника Химика Акта . 284 (1): 101–7. дои : 10.1016/S0009-8981(99)00054-6 . ПМИД 10437648 .
- ^ Перальта, Рубен; Руби, Брэд А. (30 июля 2012 г.). Пинский, Майкл Р.; Шарма, суббота; Талавера, Франциско; Мэннинг, Гарольд Л; Райс, Тимоти Д. (ред.). «Гипоальбуминемия» . Медскейп . Проверено 2 октября 2013 г.
- ^ Лонгсворт, LG; Макиннес, Д.А. (1 января 1940 г.). «Электрофоретическое исследование нефротической сыворотки и мочи» . Журнал экспериментальной медицины . 71 (1): 77–82. дои : 10.1084/jem.71.1.77 . ПМК 2135007 . ПМИД 19870946 .
- ^ Стивенсон, штат Форт; Грин, С; Кайсен, Джорджия (январь 1998 г.). «Концентрации альфа-2-макроглобулина и альфа-1-ингибитора 3 в сыворотке увеличиваются при гипоальбуминемии за счет посттранскрипционных механизмов» . Почки Интернешнл . 53 (1): 67–75. дои : 10.1046/j.1523-1755.1998.00734.x . ПМИД 9453001 .
- ^ Круто 2003 , стр. 93–97.
- ^ Туазон, Шерилин Альваран; Скарпачи, Энтони П. (11 мая 2012 г.). Старос, Эрик Б. (ред.). «Электрофорез белков сыворотки » . Медскейп . Получено 2 октября.
- ^ Маккадден, К. (2016). «Мониторинг пациентов с множественной миеломой, получающих даратумумаб: выявление влияния моноклональных антител» . Клин Химическая Лаборатория Мед . 54 (6): 1095–104. дои : 10.1515/cclm-2015-1031 . hdl : 2066/170995 . ПМИД 27028734 .
- ^ Харрис 2012 , с. 60.
- ^ Вадхера, Риши К.; Раджкумар, С. Винсент (2010). «Распространенность моноклональной гаммапатии неопределенного значения: систематический обзор» . Труды клиники Мэйо . 85 (10): 933–42. дои : 10.4065/mcp.2010.0337 . ПМЦ 2947966 . ПМИД 20713974 .
Внешние ссылки
[ редактировать ]- Электрофорез белков в Lab Tests Online
- Визуальная мнемоника для электрофореза белков сыворотки
[1]