Гибридомная технология

Гибридомная технология – это метод получения большого количества идентичных антител , также называемых моноклональными антителами . Этот процесс начинается с инъекции мыши (или другому млекопитающему) антигена , вызывающего иммунный ответ. Тип лейкоцитов, В-клетки , вырабатывает антитела, которые связываются с введенным антигеном. Эти B-клетки, продуцирующие антитела, затем собирают у мышей и, в свою очередь, сливают с бессмертными раковыми клетками миеломы , чтобы получить гибридную клеточную линию, называемую гибридомой , которая обладает как способностью B-клеток продуцировать антитела, так и долговечностью. и репродуктивность миеломы.
Гибридомы можно выращивать в культуре, при этом каждая культура начинается с одной жизнеспособной клетки гибридомы, получая культуры, каждая из которых состоит из генетически идентичных гибридом, которые продуцируют одно антитело на культуру (моноклональные), а не смеси различных антител (поликлональные). Линия клеток миеломы, используемая в этом процессе, отбирается по ее способности расти в культуре ткани и по отсутствию синтеза антител. В отличие от поликлональных антител , которые представляют собой смеси множества различных молекул антител, моноклональные антитела, продуцируемые каждой линией гибридомы, химически идентичны.
Производство моноклональных антител было изобретено Сезаром Мильштейном и Жоржем Дж. Ф. Кёлером в 1975 году. Они разделили Нобелевскую премию 1984 года по медицине и физиологии с Нильсом Каем Йерне , который внес и другие вклады в иммунологию. Термин «гибридома» был придуман Леонардом Герценбергом во время его творческого отпуска в лаборатории Сезара Мильштейна в 1976–1977 годах. [ 1 ]
Метод
[ редактировать ]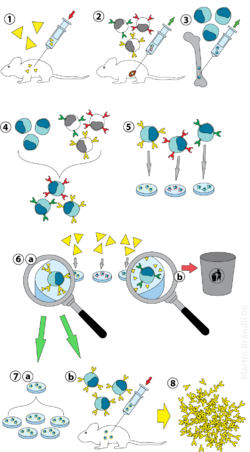
(2) Выделение В-клеток из селезенки
(3) Культивирование клеток миеломы
(4) Слияние миеломы и В-клеток
(5) Разделение клеточных линий
(6) Скрининг подходящих клеточных линий
(7) in vitro (а) или in vivo (б) размножение
(8) Сбор урожая
Лабораторные животные ( млекопитающие , например мыши) сначала подвергаются воздействию антигена, против которого должны быть выработаны антитела. Обычно это делается путем серии инъекций рассматриваемого антигена в течение нескольких недель. За этими инъекциями обычно следует электропорация in vivo , которая значительно усиливает иммунный ответ. После выделения спленоцитов млекопитающего из селезенки В-клетки сливаются с иммортализованными клетками миеломы. Слияние В-клеток с клетками миеломы можно осуществить с помощью электрослияния. Электрослияние заставляет В-клетки и клетки миеломы выравниваться и сливаться под действием электрического поля. Альтернативно, B-клетки и миеломы можно слить с помощью химических протоколов, чаще всего с использованием полиэтиленгликоля . Клетки миеломы отбираются заранее, чтобы убедиться, что они сами не секретируют антитела и что в них отсутствует ген гипоксантин-гуанинфосфорибозилтрансферазы (HGPRT), что делает их чувствительными (или уязвимыми) к ШЛЯПА средняя (см. ниже).
Слитые клетки инкубируют в среде HAT ( среда гипоксантин - аминоптерин - тимидин ) в течение примерно 10-14 дней. Аминоптерин блокирует путь, обеспечивающий синтез нуклеотидов. Следовательно, неслитые клетки миеломы погибают, поскольку они не могут производить нуклеотиды путем de novo или путем спасения, поскольку у них отсутствует HGPRT. Удаление несросшихся клеток миеломы необходимо, поскольку они могут перерасти другие клетки, особенно слабо прижившиеся гибридомы. Неслитые В-клетки умирают, поскольку имеют короткую продолжительность жизни. Таким образом, выживают только гибриды В-клеток и миеломы, поскольку ген HGPRT, происходящий из В-клеток, функционален. Эти клетки вырабатывают антитела (свойство В-клеток) и бессмертны (свойство клеток миеломы). Инкубируемую среду затем разводят в многолуночные планшеты до такой степени, чтобы каждая лунка содержала только одну клетку. Поскольку антитела в лунке продуцируются одной и той же В-клеткой, они будут направлены к одному и тому же эпитопу и, таким образом, являются моноклональными антителами.
Следующим этапом является быстрый процесс первичного скрининга, в ходе которого выявляются и отбираются только те гибридомы, которые продуцируют антитела соответствующей специфичности. Первый использованный метод скрининга называется ELISA . Затем инкубируют супернатант культуры гибридомы, конъюгат, меченный вторичным ферментом, и хромогенный субстрат, и образование окрашенного продукта указывает на положительную гибридому. Альтернативно, иммуноцитохимический, [ 2 ] вестерн-блоттинг и иммунопреципитационная масс-спектрометрия. В отличие от вестерн-блот-анализа, иммунопреципитационная масс-спектрометрия облегчает скрининг и ранжирование клонов, которые связываются с нативными (неденатурированными) формами антигенных белков. [ 3 ] Скрининг проточной цитометрией использовался для первичного скрининга большого количества (~ 1000) клонов гибридом, распознающих нативную форму антигена на поверхности клетки. [ 4 ] При скрининге на основе проточной цитометрии смесь антиген-отрицательных и антиген-положительных клеток используется в качестве антигена, подлежащего тестированию для каждого образца супернатанта гибридомы. [ 4 ]
В-клетку, продуцирующую нужные антитела, можно клонировать для получения множества идентичных дочерних клонов. дополнительные среды, содержащие интерлейкин-6 (например, бриклон На этом этапе необходимы ). Как только колония гибридомы создана, она будет постоянно расти в культуральной среде, такой как RPMI-1640 (с антибиотиками и фетальной бычьей сывороткой), и продуцировать антитела. [ 2 ]
Многолуночные планшеты первоначально используются для выращивания гибридом, а после отбора их заменяют на более крупные колбы для тканевых культур. Это поддерживает благополучие гибридом и обеспечивает достаточное количество клеток для криоконсервации и супернатанта для последующих исследований. Культуральный супернатант может давать от 1 до 60 мкг/мл моноклональных антител, которые поддерживают при -20°C или ниже до тех пор, пока они не потребуются. [ 2 ]
Используя культуральный супернатант или очищенный препарат иммуноглобулина, можно провести дальнейший анализ потенциальной гибридомы, продуцирующей моноклональные антитела, с точки зрения реактивности, специфичности и перекрестной реактивности. [ 2 ]
Приложения
[ редактировать ]Использование моноклональных антител широко распространено и включает профилактику, диагностику и лечение заболеваний. Например, моноклональные антитела могут различать подгруппы В-клеток и Т-клеток , что полезно при выявлении различных типов лейкозов . использовались специфические моноклональные антитела , для определения маркеров клеточной поверхности лейкоцитов Кроме того и других типов клеток . Это привело к кластерной дифференцировке серии маркеров. Их часто называют маркерами CD, и они определяют несколько сотен различных компонентов клеточной поверхности, каждый из которых определяется связыванием определенного моноклонального антитела. Такие антитела чрезвычайно полезны для сортировки клеток, активируемой флуоресценцией , специфической изоляции определенных типов клеток.
В диагностической гистопатологии
[ редактировать ]С помощью моноклональных антител ткани и органы можно классифицировать на основе экспрессии определенных маркеров, отражающих тканевый или клеточный генезис. Специфический антиген простаты , плацентарная щелочная фосфатаза , хорионический гонадотропин человека , α-фетопротеин и другие являются органассоциированными антигенами, и продукция моноклональных антител против этих антигенов помогает в определении природы первичной опухоли. [ 2 ]
Моноклональные антитела особенно полезны при различении морфологически сходных поражений, таких как плевры и мезотелиома брюшины , аденокарцинома , а также при определении органного или тканевого происхождения недифференцированных метастазов . Отобранные моноклональные антитела помогают в обнаружении скрытых метастазов ( рак неизвестного первичного происхождения ) с помощью иммуноцитологического анализа костного мозга, аспиратов других тканей, а также лимфатических узлов и других тканей и могут иметь повышенную чувствительность по сравнению с обычным гистопатологическим окрашиванием . [ 2 ]
Одно исследование [ 5 ] провели чувствительный иммуногистохимический анализ аспиратов костного мозга 20 пациентов с локализованным раком простаты. В анализе использовали три моноклональных антитела (Т16, С26 и АЕ-1), способных распознавать мембранные и цитоскелетные антигены, экспрессируемые эпителиальными клетками, для обнаружения опухолевых клеток. Аспираты костного мозга 22% пациентов с локализованным раком простаты (стадия B, 0/5; стадия C, 2/4) и 36% пациентов с метастатическим раком простаты (стадия D1, 0/7 пациентов; стадия D2, 4/). у 4 пациентов) в костном мозге были антиген-положительные клетки. Был сделан вывод, что иммуногистохимическое окрашивание аспиратов костного мозга очень полезно для выявления скрытых метастазов в костный мозг у пациентов с явно локализованным раком предстательной железы.
Хотя иммуноцитохимия с использованием опухолеассоциированных моноклональных антител привела к улучшению способности обнаруживать скрытые клетки рака молочной железы в аспиратах костного мозга и периферической крови, необходима дальнейшая разработка этого метода, прежде чем его можно будет использовать в рутинном порядке. [ 6 ] Одним из основных недостатков иммуноцитохимии является то, что используются только опухолеассоциированные, а не опухолеспецифические моноклональные антитела, и в результате могут возникнуть некоторые перекрестные реакции с нормальными клетками. [ 7 ]
Чтобы эффективно определить стадию рака молочной железы и оценить эффективность схем очистки перед инфузией аутологичных стволовых клеток, важно обнаружить даже небольшие количества клеток рака молочной железы. Иммуногистохимические методы идеально подходят для этой цели, поскольку они просты, чувствительны и достаточно специфичны. Франклин и др. [ 8 ] выполнили чувствительный иммуноцитохимический анализ, используя комбинацию четырех моноклональных антител (260F9, 520C9, 317G5 и BrE-3) против гликопротеинов поверхности опухолевых клеток, чтобы идентифицировать клетки опухоли молочной железы в костном мозге и периферической крови. На основании результатов они пришли к выводу, что иммуноцитохимическое окрашивание костного мозга и периферической крови является чувствительным и простым способом обнаружения и количественного определения клеток рака молочной железы.
Одной из основных причин метастатического рецидива у больных солидными опухолями является ранняя диссеминация злокачественных клеток. Использование моноклональных антител (мАт), специфичных к цитокератинам, позволяет идентифицировать диссеминированные отдельные эпителиальные опухолевые клетки в костном мозге.
Одно исследование [ 9 ] сообщает о разработке иммуноцитохимической процедуры одновременного мечения компонента цитокератина №. 18 (CK18) и специфический антиген простаты (PSA). Это поможет в дальнейшей характеристике диссеминированных отдельных эпителиальных опухолевых клеток у пациентов с раком простаты. Двенадцать контрольных аспиратов пациентов с доброкачественной гипертрофией предстательной железы показали отрицательное окрашивание, что еще раз подтверждает специфичность CK18 при обнаружении эпителиальных опухолевых клеток в костном мозге.
В большинстве случаев злокачественного заболевания, осложненного выпотом, неопластические клетки можно легко распознать. Однако в некоторых случаях злокачественные клетки не так легко увидеть или их присутствие слишком сомнительно, чтобы называть это положительным результатом. Использование иммуноцитохимических методов повышает точность диагностики в этих случаях.
Гош, Мейсон и Сприггс [ 10 ] проанализировали 53 образца плевральной или перитонеальной жидкости от 41 пациента со злокачественными новообразованиями. Традиционное цитологическое исследование не выявило опухолевых клеток. Для поиска злокачественных клеток использовали три моноклональных антитела (анти-CEA, Ca 1 и HMFG-2). Иммуноцитохимическое мечение проводили на неокрашенных мазках, хранившихся при температуре -20°С до 18 месяцев. В двенадцати из сорока одного случая иммуноцитохимического окрашивания были выявлены злокачественные клетки. Результат представляет собой увеличение точности диагностики примерно на 20%. Исследование пришло к выводу, что у пациентов с подозрением на злокачественное заболевание иммуноцитохимическая маркировка должна использоваться регулярно при исследовании цитологически отрицательных образцов и имеет важные последствия для ведения пациентов.
Другое применение иммуноцитохимического окрашивания — обнаружение двух антигенов в одном мазке. Двойное окрашивание антителами к легкой цепи и маркерами Т- и В-клеток может указывать на неопластическое происхождение лимфомы. [ 11 ]
В одном исследовании сообщалось о выделении линии гибридомных клеток (клон 1E10), которая продуцирует моноклональные антитела (IgM, изотип k). Это моноклональное антитело демонстрирует специфическое иммуноцитохимическое окрашивание ядрышек. [ 12 ]
Ткани и опухоли можно классифицировать на основе экспрессии определенных маркеров с помощью моноклональных антител. Они помогают различить морфологически сходные образования и определить органное или тканевое происхождение недифференцированных метастазов. Иммуноцитологический анализ костного мозга, аспиратов тканей, лимфатических узлов и т. д. с использованием выбранных моноклональных антител помогает выявить оккультные метастазы. Моноклональные антитела повышают чувствительность при обнаружении даже небольших количеств инвазивных или метастатических клеток. Моноклональные антитела (мАт), специфичные к цитокератинам, позволяют обнаружить диссеминированные отдельные эпителиальные опухолевые клетки в костном мозге.
Ссылки
[ редактировать ]- ^ Мильштейн, К. (1999). «Гибридомная революция: ответвление фундаментальных исследований». Биоэссе . 21 (11): 966–73. doi : 10.1002/(SICI)1521-1878(199911)21:11<966::AID-BIES9>3.0.CO;2-Z . ПМИД 10517870 .
- ^ Jump up to: а б с д и ж Нельсон, штат Пенсильвания; Рейнольдс, генеральный менеджер; Уолдрон, Э.Э.; Уорд, Э; Яннопулос, К; Мюррей, PG (2000). «Демистифицировано...: Моноклональные антитела» . Молекулярная патология . 53 (3): 111–7. дои : 10.1136/mp.53.3.111 . ПМК 1186915 . ПМИД 10897328 .
- ^ Корбакис, Д; Бринк, Д; Шиза, С; Соосаипиллай, А; Ярви, К; Драбович А.П.; Диамандис, Э (2015). «Мониторинг реакции, выбранной методом иммунозахвата, облегчает разработку метода ELISA для измерения нативного TEX101 в биологических жидкостях» . Молекулярная и клеточная протеомика . 14 (6): 1517–1526. дои : 10.1074/mcp.M114.047571 . ПМЦ 4458717 . ПМИД 25813379 .
- ^ Jump up to: а б Пунг, Йен; Гао, Вэй; Ман, Ян-Гао; Нагата, Сатоши; Хо, Митчелл (сентябрь 2012 г.). «Высокоаффинные моноклональные антитела к опухолевому антигену клеточной поверхности глипикану-3, полученные посредством сочетания пептидной иммунизации и скрининга проточной цитометрией» . МАБ . 4 (5): 592–599. дои : 10.4161/mabs.20933 . ISSN 1942-0870 . ПМК 3499300 . ПМИД 22820551 .
- ^ Бреттон, PR; Меламед, г-н; Ярмарка, WR; Кот, Р.Дж. (1994). «Выявление скрытых микрометастазов в костном мозге у больных раком предстательной железы». Простата . 25 (2): 108–14. дои : 10.1002/pros.2990250208 . ПМИД 7518596 . S2CID 32801503 .
- ^ Квальхейм, Г. (1996). «Обнаружение скрытых опухолевых клеток в костном мозге и крови у больных раком молочной железы — методы и клиническое значение» . Акта Онкол . 35 : 13–18. дои : 10.3109/02841869609098516 . ПМИД 9073044 .
- ^ Квальхейм, Г. (1998). «Диагностика минимальной остаточной болезни костного мозга и крови у онкологических больных - методы и клиническое значение» . Акта Онкологика . 37 (5): 455–62. дои : 10.1080/028418698430403 . ПМИД 9831374 .
- ^ Франклин, Вашингтон; Шпалл, Э.Дж.; Арчер, П; Джонстон, CS; Гарза-Уильямс, С; Хами, Л; Биттер, Массачусетс; Баст, РЦ; Джонс, РБ (1996). «Иммуноцитохимическое обнаружение клеток рака молочной железы в костном мозге и периферической крови пациентов, проходящих высокодозную химиотерапию с поддержкой аутологичных стволовых клеток». Лечение рака молочной железы . 41 (1): 1–13. дои : 10.1007/BF01807031 . ПМИД 8932871 . S2CID 37415751 .
- ^ Ризенберг, Р; Обернедер, Р; Кригмайр, М; Эпп, М; Битцер, Ю; Хофстеттер, А; Браун, С; Ритмюллер, Г; Пантель, К. (1993). «Иммуноцитохимическое двойное окрашивание цитокератина и простатического специфического антигена в отдельных опухолевых клетках предстательной железы». Гистохимия . 99 (1): 61–6. дои : 10.1007/BF00268022 . ПМИД 7682210 . S2CID 8007388 .
- ^ Гош, АК; Мейсон, ДЮ; Сприггс, А.И. (1983). «Иммуноцитохимическое окрашивание моноклональными антителами цитологически «негативных» серозных выпотов больных злокачественными заболеваниями» . Дж. Клин Патол . 36 (10): 1150–53. дои : 10.1136/jcp.36.10.1150 . ПМЦ 498493 . ПМИД 6194182 .
- ^ Гош, АК; Сприггс, А.И.; Тейлор-Пападимитриу, Дж .; Мейсон, ДЮ (1983). «Иммуноцитохимическое окрашивание клеток плеврального и перитонеального выпота панелью моноклональных антител» . Дж. Клин Патол . 36 (10): 1154–64. дои : 10.1136/jcp.36.10.1154 . ПМЦ 498494 . ПМИД 6194183 .
- ^ Виссерс, CJ; Флохил, CC; Де Йонг, А.А.; Диньенс, Западная Нью-Йорк; Босман, FT (1996). «Новое моноклональное антитело для специфического иммуноцитохимического окрашивания ядрышек». Акта гистохимика . 98 (2): 113–21. дои : 10.1016/S0065-1281(96)80028-6 . ПМИД 8739296 .
Внешние ссылки
[ редактировать ]- Гибридомы Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- «Гибридомная технология» . Серия «Понимание рака: иммунная система» . Национальный институт рака . Архивировано из оригинала 5 октября 2014 года.
- «Культура гибридомных клеток» .
