TP53-индуцируемый регулятор гликолиза и апоптоза
| ТИГР | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | TIGAR , FR2BP, C12orf5, TP53 индуцирует регуляторную фосфатазу гликолиза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 610775 ; МГИ : 2442752 ; Гомологен : 32473 ; GeneCards : ТИГР ; ОМА : ТИГАР - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Индуцируемый TP53 регулятор гликолиза и апоптоза (TIGAR), также известный как фруктозо-2,6-бисфосфатаза TIGAR, представляет собой фермент , который у человека кодируется C12orf5 геном . [ 5 ] [ 6 ] [ 7 ]
TIGAR — недавно открытый фермент, который в первую очередь действует как регулятор распада глюкозы в клетках человека . Помимо роли в контроле деградации глюкозы, активность TIGAR может позволить клетке осуществлять репарацию ДНК и деградацию собственных органелл . Наконец, TIGAR может защитить клетку от гибели. С момента своего открытия в 2005 году Куанг-Ю Джен и Вивиан Дж. Чунг, TIGAR стал представлять особый интерес для научного сообщества благодаря его активной роли во многих видах рака . Обычно TIGAR, вырабатываемый организмом, активируется p53 супрессором опухоли белком- после того, как клетка испытала небольшой уровень повреждения ДНК или стресса. При некоторых видах рака TIGAR попадает под контроль других белков. Есть надежда, что будущие исследования TIGAR дадут представление о новых способах лечения рака. [ 8 ] [ 9 ] [ 10 ]
Этот ген регулируется как часть пути супрессора опухоли р53 и кодирует белок, последовательность которого аналогична бисфосфатному домену гликолитического фермента, который расщепляет фруктозо-2,6-бисфосфат. Белок функционирует, блокируя гликолиз и направляя путь в пентозофосфатный шунт . Экспрессия этого белка также защищает клетки от повреждения ДНК активными формами кислорода , вызванного повреждением ДНК и обеспечивает некоторую защиту от апоптоза . Область 12p13.32, включающая этот ген, паралогична области 11q13.3. [ 7 ]
Ген
[ редактировать ]TIGAR У человека ген , известный как C12orf5 , находится на хромосоме 12p 13-3 и состоит из 6 экзонов . [ 9 ] C12orf5 мРНК составляет 8237 пар оснований . Длина [ 11 ]
Открытие
[ редактировать ]Джен и Чунг впервые обнаружили ген c12orf5, используя компьютерные поиски для поиска новых генов, регулируемых р53, которые включаются в ответ на ионизирующее излучение . Они опубликовали свое исследование в журнале Cancer Research в 2005 году. [ 8 ]
Позже Карим Бенсаад и др. опубликовали в журнале Cell исследование, полностью посвященное структуре и функции гена c12orf5, в котором c12orf5 было дано название TIGAR в честь его очевидной функции. [ 9 ]
Выражение
[ редактировать ]TIGAR Транскрипция быстро активируется белком- супрессором опухолей р53 в ответ на низкие уровни клеточного стресса, например, вызванного воздействием низких доз УФ-излучения . [ 12 ] Однако при высоком уровне клеточного стресса экспрессия TIGAR снижается. [ 12 ] P53, фактор транскрипции , может связываться с двумя сайтами человеческого гена TIGAR для активации экспрессии. [ 9 ] [ 13 ] Один сайт находится внутри первого интрона и связывает р53 с высоким сродством. [ 9 ] [ 13 ] Второй находится непосредственно перед первым экзоном, связывает р53 с низким сродством. [ 9 ] [ 13 ] и сохраняется между мышами и людьми. [ 9 ] Экспрессия TIGAR может регулироваться другими механизмами, не связанными с p53, в линиях опухолевых клеток . [ 9 ]
Структура
[ редактировать ]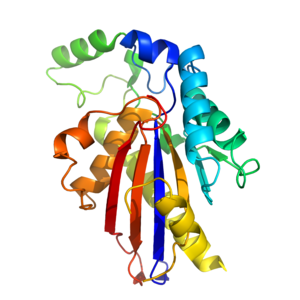
TIGAR составляет примерно 30 кДа. [ 9 ] и имеет третичную структуру , похожую на складку гистидинфосфатазы . [ 14 ] Ядро TIGAR состоит из сэндвича α-β-α, который состоит из шестинитевого β-листа, окруженного 4 α-спиралями . [ 14 ] Дополнительные α-спирали и длинная петля формируются вокруг ядра, образуя полный фермент. [ 14 ] TIGAR имеет активный сайт , который структурно аналогичен PhoE (ферменту бактериальной фосфатазы) и функционально подобен сайту фруктозо-2,6-бисфосфатазы .
Бис-фосфатазоподобный активный центр TIGAR положительно заряжен и катализирует удаление фосфатных групп из других молекул. [ 9 ] [ 14 ] В отличие от фруктозо-2,6-бисфосфатазы, активный сайт TIGAR открыт и доступен, как и PhoE. [ 14 ] Сайт содержит 3 важнейшие аминокислоты (2 гистидина и 1 глутаминовую кислоту). [ 9 ] ), которые участвуют в фосфатазной реакции. Эти три остатка известны под общим названием каталитическая триада . [ 9 ] и обнаружены во всех ферментах, принадлежащих к фосфоглицеромутазной ветви суперсемейства гистидинфосфатаз. [ 9 ] [ 14 ] Один из остатков гистидина электростатически связан с отрицательно заряженным фосфатом. Второй фосфат связан в другом месте активного центра. [ 14 ]
Функция
[ редактировать ]Активность TIGAR может иметь множественные клеточные эффекты. TIGAR действует как прямой регулятор уровня фруктозо-2,6-бисфосфата и активности гексокиназы 2 , и это может косвенно приводить ко многим изменениям внутри клетки в цепочке биохимических событий. TIGAR представляет собой фруктозобисфосфатазу, которая активирует р53, в результате чего ингибируется экспрессия переносчика глюкозы, а также регулируется экспрессия гексокиназы и фосфоглицератмутазы. TIGAR также ингибирует фосфофруктокиназу (PFK), снижая уровень фруктозо-2,6-бисфосфата, поэтому ингибируется гликолиз и активируется пентозофосфатный путь. [ 15 ]
Регуляция фруктозо-2,6-бисфосфата
[ редактировать ]TIGAR снижает уровень фруктозо-2,6-бисфосфата в клетках. [ 9 ] [ 13 ] Он катализирует удаление фосфатной группы из фруктозо-2,6-бисфосфата (F-2,6-BP): [ 9 ] [ 13 ] Фруктозо-2,6-бисфосфат->Фруктозо-6-фосфат (F-6-P) + фосфат
F-2,6-BP является аллостерическим регулятором путей клеточного метаболизма глюкозы . и повышает ее активность Обычно F-2,6-BP связывается с фосфофруктокиназой 1 . Фосфофруктокиназа-1 катализирует присоединение фосфата к F-6-P с образованием фруктозо-1,6-бисфосфата (F-1,6-BP). Это важный этап пути гликолиза , который составляет первую часть аэробного дыхания у млекопитающих . F-2,6-BP также связывается с фруктозо-1,6-бисфосфатазой и снижает ее активность. [ 9 ] Фруктозо-1,6-бисфосфатаза катализирует удаление фосфата из F-1,6-BP с образованием F-6-P. Эта реакция является частью пути глюконеогенеза , который синтезирует глюкозу , и является обратной гликолизу. [ 16 ] Когда TIGAR снижает уровень F-2,6-BP, фосфофруктокиназа становится менее активной, в то время как активность фруктозо-1,6-бисфосфатазы увеличивается. [ 9 ] [ 13 ] Уровень фруктозо-6-фосфата повышается, [ 9 ] [ 13 ] который имеет несколько эффектов внутри ячейки:
- Скорость гликолиза снижается [ 9 ] [ 13 ]
- Скорость глюконеогенеза увеличивается [ 9 ]
- Избыток фруктозо-6-фосфата превращается в глюкозо-6-фосфат в изомеризации . реакции [ 9 ]
- Избыток глюкозо-6-фосфата поступает по пентозофосфатному пути . В конечном итоге это приводит к удалению активных форм кислорода (АФК) в клетке. [ 9 ] [ 13 ]
- Удаление АФК помогает предотвратить апоптоз уменьшить накопление повреждений ДНК . (клеточное самоубийство), а также может со временем [ 9 ] [ 13 ]
Реакция на повреждение ДНК и остановка клеточного цикла
[ редактировать ]TIGAR может предотвращать прохождение клеток через этапы цикла роста и деления, снижая уровень клеточного АТФ . [ 12 ] Это известно как остановка клеточного цикла . [ 12 ] Эта функция TIGAR является частью реакции на повреждение ДНК, опосредованной р53 , когда при низких уровнях клеточного стресса р53 инициирует остановку клеточного цикла , чтобы дать клеткам время для восстановления. [ 13 ] [ 17 ] [ 18 ] Вместо этого при высоком уровне клеточного стресса р53 инициирует апоптоз. [ 13 ] [ 17 ] [ 18 ]
В непокоящихся клетках клеточный цикл состоит из фаз G0 -> G1 -> S -> G2 -> M и жестко регулируется на контрольных точках между фазами. [ 19 ] Если клетка подверглась стрессу, экспрессируются определенные белки, которые предотвращают определенную последовательность макромолекулярных взаимодействий на контрольной точке, необходимую для перехода к следующей фазе. [ 17 ] [ 18 ] [ 19 ]
Активность TIGAR может предотвратить переход клеток в S-фазу через контрольную точку, известную у людей как точка ограничения . В самом начале фазы G1 белок, называемый ретинобластомой (Rb), существует в нефосфорилированном состоянии. В этом состоянии Rb связывается с белковым фактором транскрипции E2F и не позволяет E2F активировать транскрипцию белков, необходимых для S-фазы . Во время нормального клеточного цикла, по мере прогрессирования G1, Rb будет фосфорилироваться в определенном наборе последовательных этапов белками, называемыми циклин-зависимыми киназами (cdks), связанными с белками циклина . Специфическими комплексами, фосфорилирующими Rb, являются циклин D - cdk4 и циклин E - cdk2 . [ 20 ]
Когда Rb фосфорилируется много раз, он диссоциирует от E2F. E2F может активировать экспрессию генов S-фазы. [ 20 ] TIGAR может косвенно предотвратить прохождение клетки через точку рестрикции, сохраняя Rb нефосфорилированным. [ 12 ]
При экспрессии TIGAR снижает уровень клеточного АТФ за счет своей фосфатазной активности. [ 12 ] Для фосфорилирования Rb доступно меньше АТФ, поэтому Rb остается нефосфорилированным и связанным с E2F, который не может активировать гены S-фазы. [ 12 ] Экспрессия циклина D, ckd4, циклина E и cdk2 снижается, когда TIGAR активен из-за отсутствия АТФ, необходимого для их транскрипции и трансляции . [ 12 ] Эта активность TIGAR служит для ареста клеток в G1. [ 12 ]
Активность гексокиназы 2
[ редактировать ]В условиях низкого содержания кислорода, известных как гипоксия , небольшое количество TIGAR попадает в митохондрии и увеличивает активность гексокиназы 2 (HK2), связываясь с ней. [ 21 ]
Во время гипоксии активируется белок Hif1α , который заставляет TIGAR перемещаться из цитоплазмы на внешнюю митохондриальную мембрану . [ 21 ] Здесь HK2 связан с анионным каналом во внешней митохондриальной мембране, называемым VDAC. [ 22 ] TIGAR связывает гексокиназу 2 и увеличивает ее активность по пока неизвестному механизму. [ 21 ]
Гексокиназа 2 (НК2) осуществляет следующую реакцию:
Глюкоза + АТФ -> Глюкозо-6-фосфат + АДФ [ 21 ] [ 22 ] [ 23 ]
Считается, что HK2 поддерживает потенциал митохондриальной мембраны , поддерживая высокий уровень АДФ. [ 23 ] Он также предотвращает апоптоз несколькими способами: снижает уровень АФК в митохондриях, [ 21 ] [ 23 ] , вызывающим апоптоз . белком Bax и он предотвращает создание канала с VDAC [ 22 ] Это останавливает цитохрома C выход белка через VDAC в цитоплазму, где он запускает апоптоз через каскад белков каспаз . [ 22 ]
TIGAR не релокализуется в митохондрии и не связывает HK2 в нормальных клеточных условиях. [ 21 ] или если клетка испытывает недостаток глюкозы. [ 21 ] Релокализация в митохондрии не требует фосфатазного домена TIGAR. [ 21 ] Вместо этого необходимы 4 аминокислоты на С- конце TIGAR. [ 21 ]
Защита от апоптоза
[ редактировать ]Повышенная экспрессия TIGAR защищает клетки от апоптоза, вызванного окислительным стрессом. [ 24 ] за счет снижения уровня АФК. [ 9 ] TIGAR может косвенно снизить АФК двумя разными способами. Внутриклеточная среда клетки будет определять , какой из этих двух способов действия TIGAR более распространен в клетке в любой момент времени. [ 9 ] [ 21 ]
Активность фруктозо-2,6-бисфосфатазы TIGAR снижает АФК за счет увеличения активности пентозофосфатного пути (PPP). [ 9 ] Глюкозо-6-фосфат накапливается в результате дефосфорилирования F-2,6-BP с помощью TIGAR и попадает в PPP. [ 9 ] Это заставляет PPP генерировать больше никотинамидадениндинуклеотида ( НАДФН ). [ 9 ] [ 25 ] НАДФН — переносчик электронов , который используется клеткой в качестве восстановителя во многих анаболических реакциях . НАДФН, вырабатываемый PPP, передает электроны молекуле окисленного глутатиона (GSSG) с образованием восстановленного глутатиона (GSH). [ 9 ] [ 25 ]
GSH становится восстановителем и передает электроны перекиси водорода АФК с образованием безвредной воды в реакции:
ГШ + Н 2 О 2 -> Н 2 О + ГССГ [ 9 ] [ 25 ]
Снижение H 2 O 2 в результате активности TIGAR защищает от апоптоза. [ 9 ] [ 25 ]
TIGAR также снижает АФК за счет увеличения активности HK2. HK2 снижает уровень АФК косвенно, поддерживая высокий уровень АДФ на внешней митохондриальной мембране. Если уровень АДФ падает, частота дыхания снижается и приводит цепи переноса электронов к чрезмерному сокращению из-за избытка электронов. Эти лишние электроны переходят к кислороду и образуют АФК. [ 21 ]
Действие комплекса TIGAR/HK2 защищает клетки от апоптоза только в условиях низкого содержания кислорода. В нормальных условиях или в условиях дефицита глюкозы защита от апоптоза, опосредованная TIGAR, достигается только за счет активности его бисфосфатазы. [ 21 ]
TIGAR не может предотвратить апоптоз через пути гибели, независимые от АФК и р53. [ 9 ] В некоторых клетках экспрессия TIGAR может подтолкнуть клетки к дальнейшему апоптозу. [ 9 ]
Интерлейкин 3 (IL-3) — это фактор роста , который может связываться с рецепторами на поверхности клетки и приказывать клетке выживать и расти. [ 26 ] Когда IL-3-зависимые клеточные линии лишаются IL-3, они умирают. [ 26 ] из-за снижения поглощения и метаболизма глюкозы. [ 26 ] Когда TIGAR сверхэкспрессируется в клетках, лишенных IL-3, скорость гликолиза еще больше снижается, что увеличивает скорость апоптоза. [ 9 ]
Аутофагия
[ редактировать ]Аутофагия – это когда клетка переваривает некоторые из своих собственных органелл путем лизосомальной деградации. Аутофагия используется для удаления поврежденных органелл или в условиях голодания для обеспечения дополнительных питательных веществ. Обычно аутофагия происходит по пути TSC-Mtor, но может быть индуцирована АФК. TIGAR, даже на очень низких уровнях, подавляет аутофагию за счет снижения уровня АФК. Механизм, с помощью которого TIGAR это делает, не зависит от пути Mtor, но точные детали неизвестны. [ 27 ]
Возможная роль в раке
[ редактировать ]TIGAR может способствовать развитию или подавлению некоторых видов рака в зависимости от клеточного контекста. [ 13 ] [ 28 ] [ 29 ] [ 30 ] TIGAR может оказывать определенное влияние на три характеристики рака; способность уклоняться от апоптоза, неконтролируемого деления клеток и изменения метаболизма. [ 13 ] [ 28 ] [ 29 ] [ 30 ] [ 31 ] Многие раковые клетки имеют измененный метаболизм, при котором скорость гликолиза и анаэробного дыхания очень высока, а окислительного дыхания низкая, что называется эффектом Варбурга (или аэробным гликолизом ). [ 31 ] Это позволяет раковым клеткам выживать в условиях низкого содержания кислорода и использовать молекулы дыхательных путей для синтеза аминокислот и нуклеиновых кислот для поддержания быстрого роста. [ 31 ]
При глиоме , типе рака головного мозга, TIGAR может чрезмерно экспрессироваться и оказывать онкогенное воздействие. [ 28 ] В этом случае TIGAR действует для поддержания уровня энергии для ускорения роста за счет увеличения дыхания (обеспечивая изменение метаболизма), а также защищает клетки глиомы от апоптоза, вызванного гипоксией, путем снижения АФК (обеспечивая уклонение от апоптоза). [ 28 ] TIGAR также сверхэкспрессируется при некоторых видах рака молочной железы. [ 30 ]
При множественной миеломе экспрессия TIGAR связана с активностью MUC-1. MUC-1 представляет собой онкопротеин , который сверхэкспрессируется при множественной миеломе и защищает эти клетки от апоптоза, индуцированного АФК, поддерживая активность TIGAR. Когда активность MUC-1 прекращается, уровни TIGAR снижаются, и клетки подвергаются апоптозу, индуцированному АФК. [ 29 ]
При раке головы и шеи, известном как рак носоглотки , онкопротеинкиназа c-Met поддерживает экспрессию TIGAR. TIGAR увеличивает скорость гликолиза и уровень НАДФН, что позволяет раковым клеткам поддерживать высокие темпы роста. [ 32 ]
Однако TIGAR может также оказывать ингибирующее действие на развитие рака, предотвращая клеточную пролиферацию благодаря своей роли в p53-опосредованной остановке клеточного цикла. [ 13 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000078237 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: Ensembl, выпуск 89: ENSMUSG00000038028 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Джен К.Ю., Чунг В.Г. (сентябрь 2005 г.). «Идентификация новых генов-мишеней р53 при реакции на ионизирующее излучение» . Рак Рез . 65 (17): 7666–73. дои : 10.1158/0008-5472.CAN-05-1039 . ПМИД 16140933 .
- ^ Бенсаад К., Цурута А., Селак М.А., Видал М.Н., Накано К., Бартронс Р., Готлиб Э., Вусден К.Х. (июль 2006 г.). «TIGAR, p53-индуцируемый регулятор гликолиза и апоптоза» . Ячейка 126 (1): 107–20. дои : 10.1016/j.cell.2006.05.036 . ПМИД 16839880 . S2CID 15006256 .
- ^ Перейти обратно: а б «Ген Энтрез: хромосома 12 C12orf5 открывает рамку считывания 5» .
- ^ Перейти обратно: а б Джен К.Ю., Чунг В.Г. (сентябрь 2005 г.). «Идентификация новых генов-мишеней р53 при реакции на ионизирующее излучение» . Рак Рез . 65 (17): 7666–73. дои : 10.1158/0008-5472.CAN-05-1039 . ПМИД 16140933 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах Бенсаад К., Цурута А., Селак М.А., Видал М.Н., Накано К., Бартронс Р., Готлиб Э., Вусден К.Х. (июль 2006 г.). «TIGAR, p53-индуцируемый регулятор гликолиза и апоптоза» . Ячейка 126 (1): 107–20. дои : 10.1016/j.cell.2006.05.036 . ПМИД 16839880 . S2CID 15006256 .
- ^ Грин Д.Р., Чипук Дж.Э. (июль 2006 г.). «p53 и метаболизм: внутри TIGAR» . Клетка . 126 (1): 30–2. дои : 10.1016/j.cell.2006.06.032 . ПМИД 16839873 .
- ^ «Сводка NCBI C12orf5 хромосома 12, открытая рамка считывания 5» .
- ^ Перейти обратно: а б с д и ж г час я Мадан Э., Гогна Р., Куппусами П., Бхатт М., Пати У., Махди А.А. (июль 2012 г.). «TIGAR индуцирует опосредованную p53 остановку клеточного цикла путем регуляции комплекса RB-E2F1» . Бр. Дж. Рак . 107 (3): 516–26. дои : 10.1038/bjc.2012.260 . ПМК 3405207 . ПМИД 22782351 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот Мадан Э., Гогна Р., Бхатт М., Пати У., Куппусами П., Махди А.А. (декабрь 2011 г.). «Регуляция метаболизма глюкозы с помощью р53: новые роли супрессора опухоли» . Онкотаргет . 2 (12): 948–57. дои : 10.18632/oncotarget.389 . ПМК 3282098 . ПМИД 22248668 .
- ^ Перейти обратно: а б с д и ж г Ли Х, Йогл Г (январь 2009 г.). «Структурные и биохимические исследования TIGAR (TP53-индуцированный регулятор гликолиза и апоптоза)» . Ж. Биол. Хим . 284 (3): 1748–54. дои : 10.1074/jbc.M807821200 . ПМЦ 2615519 . ПМИД 19015259 .
- ^ Гаррет, Реджинальд (2016). Биохимия . Стэмфорд, Коннектикут: Cengage Learning. п. 631. ИСБН 978-1305577206 .
- ^ Фут JG, Фут D (2004). Биохимия (3-е изд.). Нью-Йорк: Дж. Уайли и сыновья. ISBN 0-471-19350-Х .
- ^ Перейти обратно: а б с Вусден К.Х., Лу X (август 2002 г.). «Живи или дай умереть: реакция клетки на р53» . Нат. Преподобный Рак . 2 (8): 594–604. дои : 10.1038/nrc864 . ПМИД 12154352 . S2CID 6412605 .
- ^ Перейти обратно: а б с Джексон С.П., Бартек Дж. (октябрь 2009 г.). «Реакция на повреждение ДНК в биологии и болезнях человека» . Природа . 461 (7267): 1071–8. Бибкод : 2009Natur.461.1071J . дои : 10.1038/nature08467 . ПМК 2906700 . ПМИД 19847258 .
- ^ Перейти обратно: а б Элледж С.Дж. (декабрь 1996 г.). «Контрольные точки клеточного цикла: предотвращение кризиса идентичности». Наука . 274 (5293): 1664–72. Бибкод : 1996Sci...274.1664E . дои : 10.1126/science.274.5293.1664 . ПМИД 8939848 . S2CID 39235426 .
- ^ Перейти обратно: а б Хенли С.А., Дик Ф.А. (2012). «Семейство белков ретинобластомы и их регуляторные функции в цикле деления клеток млекопитающих» . Подразделение ячейки . 7 (1): 10. дои : 10.1186/1747-1028-7-10 . ПМЦ 3325851 . ПМИД 22417103 .
- ^ Перейти обратно: а б с д и ж г час я дж к л Чунг Э.К., Людвиг Р.Л., Вусден К.Х. (декабрь 2012 г.). «Митохондриальная локализация TIGAR в условиях гипоксии стимулирует HK2 и снижает АФК и гибель клеток» . Учеб. Натл. акад. наук. США . 109 (50): 20491–6. Бибкод : 2012PNAS..10920491C . дои : 10.1073/pnas.1206530109 . ПМЦ 3528527 . ПМИД 23185017 .
- ^ Перейти обратно: а б с д Пасторино Дж. Г., Шульга Н., Хук Дж. Б. (март 2002 г.). «Митохондриальное связывание гексокиназы II ингибирует Bax-индуцированное высвобождение цитохрома с и апоптоз» . Ж. Биол. Хим . 277 (9): 7610–8. дои : 10.1074/jbc.M109950200 . ПМИД 11751859 .
- ^ Перейти обратно: а б с да-Сильва В.С., Гомес-Пую А, де Гомес-Пую М.Т., Морено-Санчес Р., Де Феличе Ф.Г., де Мейс Л., Оливейра М.Ф., Галина А. (сентябрь 2004 г.). «Активность митохондриально-связанной гексокиназы как профилактическая антиоксидантная защита: устойчивое образование АДФ как регуляторный механизм мембранного потенциала и генерации активных форм кислорода в митохондриях» . Ж. Биол. Хим . 279 (38): 39846–55. дои : 10.1074/jbc.M403835200 . ПМИД 15247300 .
- ^ Валко М., Лейбфриц Д., Монкол Дж., Кронин М.Т., Мазур М., Тельсер Дж. (2007). «Свободные радикалы и антиоксиданты в нормальных физиологических функциях и заболеваниях человека». Межд. Дж. Биохим. Клеточная Биол . 39 (1): 44–84. doi : 10.1016/j.biocel.2006.07.001 . ПМИД 16978905 .
- ^ Перейти обратно: а б с д Фико А., Пальялунга Ф., Чильяно Л., Абресия П., Верде П., Мартини Г., Яккарино И., Филоза С. (август 2004 г.). «Глюкозо-6-фосфатдегидрогеназа играет решающую роль в защите от апоптоза, вызванного окислительно-восстановительным стрессом» . Гибель клеток отличается . 11 (8): 823–31. дои : 10.1038/sj.cdd.4401420 . ПМИД 15044966 . (Отозвано, см. дои : 10.1038/s41418-022-01111-y , PMID 36635348 )
- ^ Перейти обратно: а б с Вандер Хайден М.Г., Плас Д.Р., Ратмелл Дж.К. , Фокс С.Дж., Харрис М.Х., Томпсон CB (сентябрь 2001 г.). «Факторы роста могут влиять на рост и выживаемость клеток, воздействуя на метаболизм глюкозы» . Мол. Клетка. Биол . 21 (17): 5899–912. дои : 10.1128/MCB.21.17.5899-5912.2001 . ПМК 87309 . ПМИД 11486029 .
- ^ Бенсаад К., Чунг Э.К., Вусден К.Х. (октябрь 2009 г.). «Модуляция внутриклеточных уровней АФК с помощью TIGAR контролирует аутофагию» . ЭМБО Дж . 28 (19): 3015–26. дои : 10.1038/emboj.2009.242 . ПМК 2736014 . ПМИД 19713938 .
- ^ Перейти обратно: а б с д Ванка С., Штайнбах Дж. П., Ригер Дж. (сентябрь 2012 г.). «Tp53-индуцированный регулятор гликолиза и апоптоза (TIGAR) защищает клетки глиомы от гибели клеток, вызванной голоданием, путем усиления регуляции дыхания и улучшения клеточного окислительно-восстановительного гомеостаза» . Ж. Биол. Хим . 287 (40): 33436–46. дои : 10.1074/jbc.M112.384578 . ПМК 3460445 . ПМИД 22887998 .
- ^ Перейти обратно: а б с Инь Л., Косуги М., Куфе Д. (январь 2012 г.). «Ингибирование онкопротеина MUC1-C вызывает гибель клеток множественной миеломы за счет снижения экспрессии TIGAR и истощения НАДФН» . Кровь . 119 (3): 810–6. дои : 10.1182/blood-2011-07-369686 . ПМК 3265204 . ПМИД 22117045 .
- ^ Перейти обратно: а б с Вон КЮ, Лим С.Дж., Ким Г.И., Ким Ю.В., Хан С.А., Сон Дж.И., Ли Д.К. (февраль 2012 г.). «Регуляторная роль р53 в метаболизме рака через SCO2 и TIGAR при раке молочной железы человека». Хм. Патол . 43 (2): 221–8. дои : 10.1016/j.humpath.2011.04.021 . ПМИД 21820150 .
- ^ Перейти обратно: а б с Ханахан Д., Вайнберг Р.А. (март 2011 г.). «Признаки рака: следующее поколение» . Клетка . 144 (5): 646–74. дои : 10.1016/j.cell.2011.02.013 . ПМИД 21376230 .
- ^ Луи ВВ, Вонг ЭЮ, Хо К, Нг ПК, Лау КП, Цуй СК, Цанг СМ, Цао СВ, Ченг Ш, Нг МХ, Нг ЮК, Лам ЭК, Хонг Б, Ло КВ, Мок ТС, Чан АТ, Миллс ГБ (март 2011 г.). «Ингибирование c-Met подавляет экспрессию TIGAR и снижает выработку НАДФН, что приводит к гибели клеток» . Онкоген . 30 (9): 1127–34. дои : 10.1038/onc.2010.490 . ПМК 3428712 . ПМИД 21057531 .
Дальнейшее чтение
[ редактировать ]- Грин Д.Р., Чипук Дж.Э. (июль 2006 г.). «p53 и метаболизм: внутри TIGAR» . Клетка . 126 (1): 30–2. дои : 10.1016/j.cell.2006.06.032 . ПМИД 16839873 .
- Уайт, Кеннет Э.; Эванс, Уэйн Э.; О'Риордан, Джеффри Л.Х.; Шпеер, Марси К.; Эконс, Майкл Дж.; Лоренц-Депьер, Беттина; Грабовски, Моника; Мейтингер, Томас; Стром, Тим М. (ноябрь 2000 г.). «Аутосомно-доминантный гипофосфатемический рахит связан с мутациями FGF23». Нат. Жене . 26 (3): 345–8. дои : 10.1038/81664 . ПМИД 11062477 . S2CID 38870810 .
- Хартли Дж.Л., Темпл Г.Ф., Браш Массачусетс (ноябрь 2000 г.). «Клонирование ДНК с использованием сайт-специфической рекомбинации in vitro» . Геном Рез . 10 (11): 1788–95. дои : 10.1101/гр.143000 . ПМК 310948 . ПМИД 11076863 .
- Като Ю, Като М (август 2005 г.). «Сравнительная геномика локуса Fgf6-Fgf23 млекопитающих». Межд. Дж. Мол. Мед . 16 (2): 355–8. дои : 10.3892/ijmm.16.2.355 . ПМИД 16012775 .




